溶瘤病毒CNHK300-mIFN-γ表达mIFN-γ及体外胃肠道肿瘤杀伤实验*
彭林辉,周 杰,霍 枫,詹世林,张 琪,苏长青,钱其军,石 英△
(1.广州军区广州总医院肝胆外科,广州510010;2.南方医科大学南方医院肝胆外科,广州510515;3.中山大学第三附属医院肝脏病医院实验室,广州510630;4.第二军医大学东方肝胆外科医院基因与病毒治疗实验室,上海200438)
基因治疗和病毒治疗是近年来肿瘤治疗的研究热点。但是,传统的基因治疗,如常用的非增殖型腺病毒传输治疗基因存在治疗基因表达率低、靶向性差[1];病毒治疗单用时肿瘤的杀伤效率不够高,如已进入临床的溶瘤病毒ONYX-015单独应用治疗头颈部肿瘤有效率不到10%[2]。理论上,在溶瘤腺病毒中插入具有抗癌作用的基因,在病毒选择性感染、增殖时大量表达具有抗癌作用的细胞因子,是更有前景的抗癌新策略[3]。CNHK300病毒系统是本室构建的人端粒酶逆转录酶启动子(h TERT)调控的溶瘤病毒,体外实验和荷瘤动物实验均证明比ONYX-015有更强的抗肿瘤效果[4]。为了进一步增强抗肿瘤效果,本研究将具有抗肿瘤作用的小鼠γ-干扰素基因(mIFN-γ)插 入CNHK300,构建了基因病毒治疗系统CNHK300-mIFN-γ(简 称CNHK300-Mγ)[5]。为了明确治疗基因插入是否影响溶瘤病毒的抗肿瘤作用和插入基因的表达情况,本究采用胃癌细胞株SGC-7901、大肠癌细胞株HT-29和正 常 成纤维细胞株MRC-5,以CNHK300、ONYX-015和Ad Easy-mIFN-γ(简 称AdEasy-Mγ)作为对照,进 行CNHK300-Mγ抗肿瘤实验研究。
1 材料与方法
1.1 材料 人胚胎肾293细胞株购自加拿大Microbix Biosystems公司。健康人成纤维细胞MRC-5和人大肠癌细胞HT-29购自美国American Type Culture Collection(ATCC),人胃癌细胞株SGC-7901购自中国科学院上海细胞研究所。腺病毒ONYX-015由美国加州大学Berk AJ教授惠赠。重组腺病毒CNHK300、CNHK300-Mγ和Ad Easy-Mγ由本实验室重组并保存。各细胞株培养液、培养血清及抗生素参照供应商推荐,在37℃、5%CO2条件下培养,0.25%胰酶消化细胞、传代。
1.2 方法
1.2.1 病毒的扩增与纯化 腺病毒扩增采用HEK293细胞;病毒纯化采用常规氯化铯梯度离心纯化法;采用Qbiogene公司的TCID50法测定病毒滴度。
1.2.2 病毒增殖实验 分别收集上述肿瘤及正常细胞株,计数,按5×106/孔接种6孔板。24 h后当肿瘤细胞达到对数生长期,正常细胞达到接触抑制,分别按MOI=5感染CNHK300-Mγ、CNHK300和ONYX-015。感染2 h后,将培养液替换成5%血清培养液,放置在37℃的5%CO2孵箱中培养。收集感染0、48 h细胞冻融液及上清,TCID50法测定病毒滴度,以0 h病毒滴度为参照,算出病毒的增殖倍数。
1.2.3 细胞病理效应(CPE实验,Cytopathic Effect) 将上述肿瘤及正常细胞按5×104个/孔的密度植入24孔板中,每孔加入1 mL的培养基。24 h后对细胞换用无血清培养液,按MOI=0、0.01、0.1、1、10、100分别加入病毒CNHK300-Mγ、CNHK300和ONYX-015,十字法摇匀,2 h后换用5%血清培养液,37℃,5%CO2孵箱培养7 d,每日观察细胞的生长情况。7 d后吸掉细胞培养液,每孔加入500μL结晶紫染色液(2%结晶紫溶于20%甲醇),室温染色15 min,在纯水中洗掉多余染液后拍照记录。
1.2.4 细胞杀伤实验 接种上述肿瘤及正常细胞至96孔细胞培养板(104/孔),用含10%胎牛血清的DMEM培养液在5%CO2条件下培养24 h,按梯度MOI值感染细胞,分别加入病毒CNHK300-Mγ、CNHK300和ONYX-015,7 d后弃去病毒残液,四唑盐比色试验(MTT)检测3种病毒对各种细胞的杀伤作用。用酶联免疫检测仪在570 nm波长下测定光吸收值,参考波长为650 nm。每个病毒MOI值做8个复孔,独立重复3次。MOI为病毒数量与细胞数量之比。
1.2.5 双抗体夹心法酶联免疫吸附试验(ELISA)检测mIFNγ表达量 分别收集上述肿瘤及正常细胞株,计数,按5×104/孔接种于24孔板。24 h后当肿瘤细胞达到对数生长期,正常细胞达到接触抑制,分别按MOI=1感染CNHK300-Mγ和Ad Easy-Mγ(携带mIFN-γ的非增殖病毒)。感染2 h后,将培养液替换成5%血清培养液,放置在37℃的5%CO2孵箱中培养。收集感染3、7 d细胞培养上清液,用ELISA检测其中mIFN-γ的表达量。
1.3 统计学处理 统计学软件采用Excel2003,所有定量实验均重复3次,各组数据以±s表示。
2 结 果
2.1 CNHK300-Mγ和CNHK300病毒的扩增与纯化。与野生型腺病毒比较,重组病毒CNHK300由h TERT调控E1A基因,而重组腺病毒CNHK300-Mγ,在h TERT之前插入了CMV启动子调控mIFN-γ的基因表达盒。病毒在293细胞中反复扩增到需要量,纯化后进行滴度测定,CNHK300-Mγ和CNHK300滴度测定分别为1.0×109、1.6×109pfu/mL。
2.2 携带治疗基因的溶瘤腺病毒CNHK300-Mγ选择性在胃肠道肿瘤细胞中增殖,在SGC-7901、HT-29和MRC-5中的增殖倍数分为32 536、25 150和50.2,如图1所示。在肿瘤细胞株和正常细胞株增殖差异比较中发现,SGC-7901/MRC-5和HT-29/MRC-5在CNHK300-Mγ分 别 为648和501,在CNHK300分别为450和280,在ONYX-015分别为32和16。由此可见,与CNHK300相比,mIFN-γ基因插入后,在各种细胞中的增殖能力均有所下降,但肿瘤细胞内的选择性增殖能力没有下降;与ONYX-015相比,CNHK300-Mγ显示出更为特异的肿瘤细胞内选择性增殖能力。
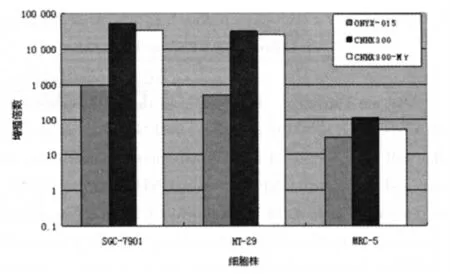
图1 3种病毒48 h增殖情况
2.3 CPE实验可以较为直观地看出3种病毒对胃肠道肿瘤细胞株和正常细胞株的杀伤能力。从图2~4中可以看出:CNHK300-Mγ对肿瘤细胞株的杀伤能力明显高于正常肝细胞株,在MOI值为1时均基本杀灭,而正常细胞株至MOI值为100时才有部分杀伤力。与ONYX-015相比,CNHK300-Mγ在肿瘤细胞株的杀伤能力明显增强而在正常细胞株中杀伤力进一步减弱。
2.4 MTT试验是一种检测细胞存活率、判定药物对细胞杀伤作用的通用方法。结果表明,CNHK300-Mγ、CNHK300和ONYX-015均表现出了对胃肠道肿瘤细胞较强的杀伤力,CNHK300-Mγ对正常细胞株杀伤力最弱。对不同细胞的半杀伤剂量IC50的结果直观地表明CNHK300-Mγ和CNHK300对肿瘤细胞的杀伤力与ONYX-015相比有明显提高。CNHK300-Mγ虽然较CNHK300对肿瘤细胞的杀伤作用有所下降,但在正常细胞中下降更明显,在MRC-5细胞中,其IC50值是CNHK300的8倍以上(表1)。
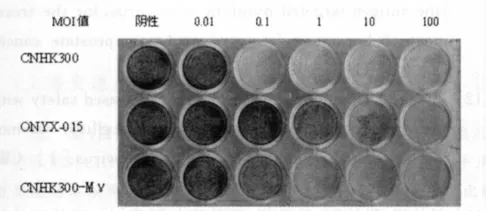
图2 3种病毒在SGC-7901细胞株中的CPE试验
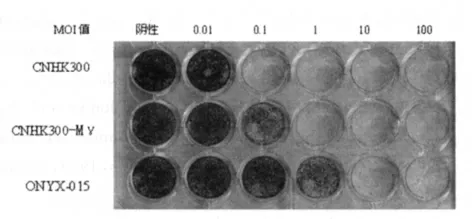
图3 3种病毒在HT-29细胞株中的CPE试验

图4 3种病毒在MRC-5细胞株中的CPE试验
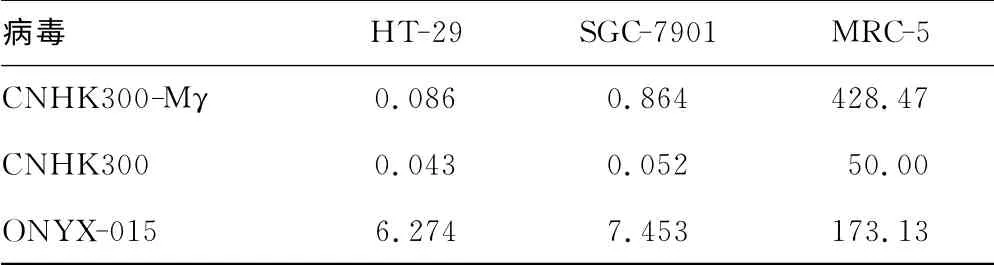
表1 3种病毒感染对不同细胞增殖的半抑制剂量IC50(MOI)(pfu/cell)
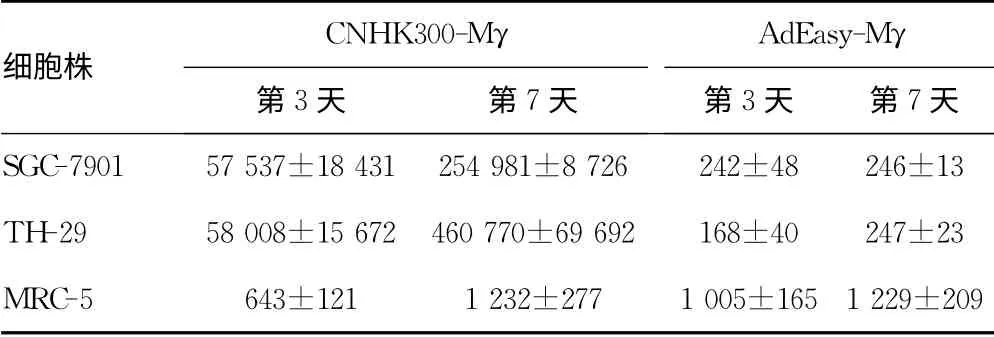
表2 2种病毒在不同细胞株上清液中mIFN-γ的表达量(pg/mL)
2.5 Ad Easy-Mγ是携带mIFN-γ的非增殖型腺病毒,感染胃肠道肿瘤细胞后只有少量mIFN-γ的表达,感染时间延长,表达量变化不大;而CNHK300-Mγ感染胃肠道肿瘤细胞后均有大量mIFN-γ的表达,感染的时间延长,表达量均成倍上升。SGC-7901细胞株受CNHK300-Mγ感染后mIFN-γ的表达量是Ad Easy-Mγ的238倍(3 d时)和1 037倍(7 d时),HT-29细胞株受CNHK300-Mγ感染后mIFN-γ的表达量是Ad Easy-Mγ的345倍(3 d时)和1 865倍(7 d时)。对于正常细胞MRC-5,2种病毒感染后,mIFN-γ的表达量相似,均不高,感染的时间延长变化也不大。上述结果提示利用增殖型腺病毒携带治疗基因能明显提高肿瘤局部治疗基因的表达。
3 讨 论
20世纪90年代初Martuza等[6]应用基因工程的方法将病毒基因组进行改造,使病毒感染、复制及溶解细胞的能力在肿瘤细胞内得到有效增强,而对正常细胞影响大为减少,肿瘤病毒治疗逐渐成为研究的热点。这种经基因工程方法改造的病毒被称为复制选择性溶瘤病毒(replication-selective oncolytic virus),简称为溶瘤病毒,其相应的治疗理念被称为病毒治疗(virotherapy)[7-8]。目前,改造腺病毒靶向机制主要有以下几个方面:(1)改造病毒表面的结合蛋白,与某些特定的肿瘤组织结合,从而使病毒只能感染特定的肿瘤组织。目前,研究主要集中于腺病毒外壳蛋白的改造,包括纤维蛋白(fiber)、五邻体(penton)及六邻体(hexon)蛋白[9]。(2)根据肿瘤生物学行为上的一些异常表现,选择性地缺失病毒在正常细胞复制所必需而在肿瘤细胞中非必需的基因,如ONYX-015是E1B-55 kD缺失的腺病毒,它依据多数人类肿瘤细胞p53功能不良而正常细胞p53阳性的特点,可以特异地杀伤p53缺失或变异的肿瘤细胞。(3)在病毒增殖必须基因的上游插入肿瘤组织特异性启动子或增强子,从而使病毒只在特定的肿瘤细胞内增殖,而在其它细胞内处于失活状态,如甲胎蛋白(AFP)启动子[10]、前列腺癌特异性抗原(PSA)启动子[11]、缺氧启动子[12]、端粒酶逆转录酶启动子(h TERT)等。其中h TERT是近年来的研究热点。在构成人端粒酶的3个亚单位中h TERT是决定其活性的主要因素[13],在原发性肿瘤和肿瘤细胞中有高表达,而在正常细胞中不表达,并且h TERT的表达与端粒酶活性高度相关[14]。h TERT基因的启动子区域已经被克隆成功,是调控的是h TERT基因转录的主要部位[15]。用h TERT启动子控制E1A表达而获得的增殖性腺病毒,具有选择性裂解端粒酶阳性肿瘤细胞的能力,而且杀伤能力与野生型腺病毒相当[16],在本室构建的溶瘤病毒CNHK300中也观察到相似的结果[4]。
为了优化溶瘤病毒的抗癌性,研究人员进一步将CNHK300携带上治疗基因,期望治疗基因在端粒酶阳性的肿瘤细胞中选择性地高表达,强化抗肿瘤效果。IFN-γ是已证实有多重抗癌作用的细胞因子,其机理主要有[17-18]:(1)影响细胞周期,诱导细胞凋亡,直接杀伤肿瘤细胞;(2)直接抑制肿瘤血管生成;(3)多重的免疫调节作用:调节MHCⅠ和MHCⅡ类分子在大多数免疫细胞(如单核巨噬细胞、内皮细胞、上皮细胞等)内的表达;诱导Th2向Th1分化,减少病毒抗体产生;增强肿瘤坏死因子的抑瘤作用;激活巨噬细胞及细胞毒细胞(CTL),增加淋巴因子激活的杀伤细胞(LAK)的抗肿瘤活性。虽然IFN-γ已应用到临床试验中[19],但是不稳定、半衰期短、活性低,需要高剂量反复注射方能取得一定的疗效,不良反应较严重,费用高,因而应用明显受限。
在作者的前期研究中将腺病毒E1A基因置于h TERT启动子控制之下,并将含mIFN-γ的外源基因表达盒插入到腺病毒的基因组中,成功地构建一种新的基因-病毒治疗系统CNHK300-Mγ[5]。本研究发现,mIFN-γ基因的插入虽然在各种细胞株中的增殖能力和杀伤能力均有所降低,但正常细胞下降更明显,与CNHK300相比肿瘤细胞内选择性增殖能力和对肿瘤细胞的选择性杀伤能力均无下降,与ONYX-015相比,在肿瘤细胞中增殖能力和杀伤能力明显增强,而在正常细胞中的毒性进一步下降,可见mIFN-γ基因的插入没有改变溶瘤病毒自身特异性杀灭肿瘤细胞的能力。与Ad Easy-Mγ相比,CNHK300-Mγ在胃肠道肿瘤细胞中能随着病毒的增殖大量表达mIFN-γ并随时间相对延长,表达量成倍上升,能有效避免传统基因治疗中治疗基因表达率低的主要缺点。
胃肠道恶性肿瘤是十分常见的重大疾病,一经确诊绝大部分为中晚期,治疗非常棘手且预后不理想。国内外文献报道端粒酶阳性率在胃肠道肿瘤中为85.0%~93.8%,端粒酶活性的表达和肿瘤浸润深度、淋巴结转移及PTNM分期显著相关[20-24]。CNHK300-Mγ既有类似CNHK300的溶瘤病毒选择性杀伤端粒酶阳性的胃肠道肿瘤细胞的作用,同时也能随着病毒大量增殖高效表达IFN-γ,具备了基因治疗和病毒治疗的双重抗瘤作用,进一步动物试验极可能显示比CNHK300更强的抗瘤效果,拥有较高的胃肠道肿瘤治疗潜力。
[1]Wu Q,Moyana T,Xiang J.Cancer gene therapy by adenovirus-mediated gene transfer[J].Curr Gene Ther,2001,1(1):101-122.
[2]Liu TC,Galanis E,Kirn D.Clinical trial results with oncolytic virotherapy:a century of promise,a decade of progress[J].Nat Clin Pract Oncol,2007,4(2):101-117.
[3]Qian QJ,Jonathan S,Che XY,et al.Gene-vial vectors:a promising way to target tumor cells and express anticancer genes simultaneously[J].Chin Med J,2002,115(8):1213-1217.
[4]Su CQ,Sham J,Xue HB,et al.Potent antitumoral efficacy of a novel replicative adenovirus CNHK300 targeting telomerase-positive cancer cells[J].Cancer Res Clin Oncol,2004,130(10):591-603.
[5]彭林辉,张柏和,张琪,等.携带治疗基因的增殖型腺病毒CNHK300-mIFN-γ的构建[J].中华实验外科杂志,2007,24(12):1483-1485.
[6]Martuza RL,Malick A,Markert JM,et al.Experimental therapy of human glioma by means of a genetically engineered virus mutant[J].Science,1991,252:854-856.
[7]Yamamoto M,Curiel DT.Current issues and future directions of oncolytic adenoviruses[J].Mol Ther,2010,18(2):243-250.
[8]Toth K,Dhar D,Wold WS.Oncolytic(replication-competent)adenoviruses as anticancer agents[J].Expert Opin Biol Ther,2010,10(3):353-368.
[9]Hernández-Alcoceba R.Recent advances in oncolytic virus design[J].Clin Transl Oncol,2011,13(4):229-239.
[10]傅强,王慧萍,韦芳,等.一种更有效的肝癌靶向性条件复制型腺病毒的构建及体外抑瘤作用[J].现代生物医学进展,2009,9(10):1801-1804.
[11]Small EJ,Carducci MA,Burke JM,et al.A phase I trial of intravenous CG7870,a replication-selective,prostate-specific antigen-targeted oncolytic adenovirus,for the treatment of hormone-refractory,metastatic prostate cancer[J].Mol Ther,2006,14(1):107-117.
[12]Zhang Q,Chen GH,Peng LH,et al.Increased safety with preserved antitumoral efficacy on hepatocellular carcinoma with dual-regulated oncolytic adenovirus[J].Clin Cancer Res,2006,12(21):6523-6527.
[13]彭林辉,张柏和,吴孟超.端粒酶与肝癌[J].国外医学肿瘤学分册,2004,31(2):138-141.
[14]Poole J,Andrews L,Tollefsbol T.Activity,function,and gene regulation of the catalytic subunit of telomerase(h TERT)[J].Gene,2001,269(1-2):1-12.
[15]Horikawa I,Cable PL,Afshari C,et al.Cloning and characterization of the promoter region of human telomerase reverse trascriptase gene[J].Cancer Res,1999,59:826-830.
[16]Wirth T,Zender L,Schulte B,et al.A telomerase-dependent conditionally replicating adenovirus for selective treatment of cancer[J].Cancer Res,2003,63(12):3181-3188.
[17]朱颖慧,朱兰才,刘然义,等.干扰素-γ治疗肿瘤的研究进展[J].肿瘤学杂志,2008,14(1):4-9.
[18]杨生海,殷宏,刘永生,等.干扰素-γ研究进展[J].生物技术通报,2010,26(8):29-34.
[19]Schmidinger M,Steger GG,Wenzel C,et al.Sequential administration of interferon gamma and interleukin-2 in metastatic renal cell carcinoma:results of a phaseⅡtrial.Austrian Renal Cell Carcinoma Study Group[J].Cancer Immunol Immunother,2000,49(7):395-400.
[20]Park KH,Rha SY,Kim CH,et al.Telomerase activity and telomere lengths in variouscell lines:changes of telomerase activity can be another method forchemosensitivity evaluation[J].Int J Oncol,1998,13(3):489-495.
[21]杨仕明,房殿春,罗元辉,等.胃癌及癌前组织中端粒酶活性的检测及其临床意义[J].中华医学杂志,1988,78(3):207-209.
[22]左明,吴俊辉,刘宝善,等.结直肠癌端粒酶活性检测及其对预后判断的意义[J].广东医学,2007,28(8):1253-1254.
[23]刘亮,陈建,刘凤军.结肠癌中h TERT的表达及其与Survivin和bcl-2表达的关系[J].中国现代普通外科进展,2010,13(3):173-176.
[24]王晓燕,陈萍,吴莺,等.端粒酶和端粒酶逆转录酶在胃癌组织中的表达及临床意义[J].临床荟萃,2010,25(4):299-301.

