酶法糖化海带及其乙醇发酵的初步研究*
李锋,徐平,黄庶冰,温顺华,刘晖,黄庶识
1(广西科学院生物物理实验室,广西 南宁,530007) 2(黔南民族师范学院化学与化工系,贵州 都匀,558000)3(广西大学商学院,广西 南宁,530004)
近10 年来,以大型海藻作为第3 代生物质能的源料用于生产生物燃料越来越受到重视。海带是常见的大型海藻,我国海带养殖产量占世界产量的70%[1]。海带生长速度快,光合效率高,总生物质产量高,碳水化合物占干重的50%以上,在乙醇发酵时不需要进行分离木质素的预处理[2-3]。海带碳水化合物成分主要有褐藻胶、褐藻糖胶、褐藻淀粉、甘露醇等。褐藻胶的主要成分是由α-L-古罗糖醛酸以及其C5 差向异构体β-D-甘露糖醛酸通过随机组合成的多聚体[4]。褐藻糖胶是类硫酸化杂多糖,主要由岩藻糖和硫酸基组成,并且还有少量的半乳糖、木糖、鼠李糖、甘露糖、葡萄糖、阿拉伯糖和葡萄糖醛酸[5]。褐藻淀粉为线体聚合体,由β-(1→3)交联葡萄糖残基组成并含少量β-(1→6)交联物作为中间或分支点残基,以少量D-甘露醇作为末端基团[6]。海藻经过物理、化学、生物等方法处理后,可以得到能被微生物转化为乙醇的糖类物质[7-10]。
本研究是以海带为原料,经过褐藻胶裂解酶和纤维素酶协同作用破坏细胞壁,使细胞内的甘露醇和海带多糖溶出,利用酵母菌和发酵细菌发酵海带水解液生产乙醇,为进一步深入研究大型海藻生物质前处理以及乙醇发酵提供依据。
1 材料与方法
1.1 材料
海带,购于市场,去除表面的泥沙和盐分,烘干后粉碎过100 目筛。褐藻胶裂解酶,美国Sigma 公司;纤维素酶(1 万U/g),南宁庞博生物工程有限公司;实验中所用其他试剂均为分析纯。
1.2 菌种
棕榈发酵细菌Zymobacter palmae(ATCC51623)、毕赤酵母Pichia angophorae (ATCC22304),均购自美国菌株保藏中心(American Type Culture Collection)。
1.3 培养基
毕赤酵母种子培养基:甘露醇10 g/L,酵母浸粉3 g/L,麦芽浸粉0.3 g/L,蛋白胨5 g/L,pH 6.2。
棕榈发酵细菌种子培养基:酵母提取物10.0 g/L,麦芽糖20.0 g/L,NaCl 5.0 g/L,KH2PO42.0 g/L,pH6.0。
海带水解液制备:用适量褐藻胶裂解酶和纤维素酶糖化海带后,过滤除去海带渣,冻干浓缩水解液后甘露醇浓度为17.8 g/L,还原糖浓度为13.1 g/L,可用于发酵总糖成分浓度为30.9 g/L。
发酵培养基配方:MgSO4·7H2O 0.5 g/L,KH2PO42.5 g/L,(NH4)2SO45 g/L,酵母粉3 g/L,海带水解液1 000 mL。
1.4 实验方法
1.4.1 海带酶糖化前的预处理
海带的组成糖类复杂多样,发酵前需水解,将多糖降解为能被微生物利用发酵产乙醇的单糖成分。
(1)采用酸提法对海带粉中的甘露醇进行提取,通过对比甘露醇含量确定海带粉粒径。分别把20目、50 目、80 目、100 目的海带粉5 g 加入100 mL 蒸馏水中,用0.1 mol/L HCl 调节pH=2,65℃水浴1 h,离心取上清液,测定甘露醇含量。
(2)海带中褐藻胶含量约占总碳水化合物的一半,褐藻胶极易与水结合生成黏性很大的胶体,为保证发酵的顺利进行,需对海带粉与水混合比例进行试验探索。把海带与水配置成浓度分别为2.5%、5%、7.5%、10%、12.5%、15% (w/v)的混合溶液,加入0.1 mg/g 干海带粉的褐藻胶裂解酶,在37℃恒温摇床,250 r/min 糖化24 h。
1.4.2 海带酶解糖化实验
1.4.2.1 褐藻胶裂解酶用量及水解时间
按褐藻胶裂解酶的最适温度(37℃)与最适pH值(pH 6.3),准确称量5.00 g 海带粉分别与0.1 mol/L 柠檬酸纳缓冲液100 mL(pH 6.3)混合于250 mL 三角瓶中中,分别加入不同剂量(0.04、0.08 0.12 0.16 0.2 mg/g 干海带粉)的褐藻胶裂解酶,置于恒温摇床中37℃水解48 h,并在12、18、24、30、36 h 分别取样;为使酶与底物充分接触,所有酶解过程都是在恒温摇床转速为250 r/min 条件下完成,每个条件做3 个平行重复。酶解后于12 000 p/min 离心10 min,用比色法测定甘露醇和还原糖含量。
1.4.2.2 纤维素酶用量及水解时间
在褐藻胶裂解酶水解彻底后,分别加入不同剂量(10、15、20、25、30 mg/g 干海带粉)的纤维素酶,摇床温度为50℃,用1 mol/L 柠檬酸调节pH 至5.0,继续水解48 h。并在6、12、18、24、48 h 分别取样,摇床转速200 r/min,酶解后12 000 r/min 离心10 min,取上清液,用DNS 比色法测定还原糖浓度。
1.4.3 海带经不同提取方法效果对比实验
本实验采取用褐藻胶裂解酶、纤维素酶共同作用破坏海带细胞壁,使细胞内的糖类物质更易溶出。
酸水解:海带粉5 g(100 目)溶于100 mL 蒸馏水中,用0.1 mol/L HCl 调节pH 为2,置于65℃的水浴锅中水解,分别在1、2、3 h 取样,测定水解液中甘露醇和还原糖的含量。
酶水解:将海带粉5 g(100 目)加入100 mL 蒸馏水,倒入250 mL 三角瓶中,同时加入褐藻胶裂解酶0.2 mg/g 和纤维素酶30 mg/g,置于37℃恒温摇床中,转速250 r/min;由于2 种酶的最适酶解温度不一样,所以先在37℃下水解24 h,再于50℃水解24 h,分别在12、24、36、48 h 时取样,测定甘露醇和还原糖含量。
1.5 海带水解液发酵
将4℃冰箱保存的菌种挑取单菌落活化6 h 后接入种子培养基,恒温摇床中150 r/min、30℃培养24 h;发酵实验在500 mL 三角瓶进行,装液量300 mL、接种量6%、初始pH6.0、恒温摇床转速150 r/min,32℃培养72 h,发酵期间为无菌条件,每隔12 h 取样1 次,将样品于12 000 r/min 离心5 min,取上清液保存于-20℃冰箱中以备后期分析。比色法测甘露醇消耗情况、DNS 测还原糖消耗情况。
1.6 分析方法
还原糖采用DNS 法测定[12]。甘露醇采用杨晓东等方法测定[13]。可溶性总糖采用苯酚-硫酸法测定[14]。乙醇采用气相色谱法测定[15]。
2 结果与讨论
2.1 海带酶解前预处理对糖类溶出的影响
2.1.1 不同粒径下甘露醇的溶出效果
海带液中甘露醇的含量随粒径的减小在不断增大,粒径为100 目,甘露醇释出量最高(图1),表明粒径越小海带中的糖类物质越容易溶出。但80 ~100目甘露醇的溶出只增加不到7%,随着粒径的减小,海带粉比表面积和吸水系数也增加,糖类物质的浸出速度也随着提高,但其过程所用能耗也越大,考虑成本和时间因素,在后续实验中选用100 目的海带粉进行发酵实验。
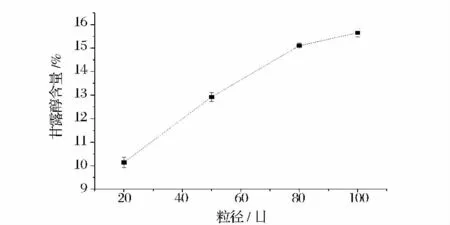
图1 不同海带粒径下甘露醇的溶出量Fig.1 The effect of different particle size on mannitol content by acidolysis
2.1.2 料液比对糖类溶出的影响
料液比对处理液的流动性有明显的影响。海带粉浓度(w/v)为12.5%和15%时,海带粉将所有水吸收后,样品还有部分成干粉状态,无流动性,无法进行酸解或酶解处理;浓度为10%时,海带粉虽然都与水充分结合,海带颗粒呈饱满状态,但几乎没有流动的液体存在;浓度为7.5%,虽然有流动液体存在,但黏度太大,不适合后处理;2.5%和5%时,海带液的黏度明显下降。综合每个浓度的黏性和酸解后可溶性糖含量,选择浓度为5%进行酶解工艺实验。
2.2 提取方法对可溶性糖溶出的影响
实验发现苯酚硫酸法不能测定甘露醇,所以不必考虑当苯酚硫酸法测可溶性总糖时,甘露醇的存在会影响总糖的测定。表3 结果显示,酸处理后海带水解液中的可溶性总糖、还原糖、甘露醇含量1 h 和3 h 相比增加量并不多。和Percival 文献中的海藻酸处理方法一致,热酸水解1 h 就已经溶出大部分糖类。
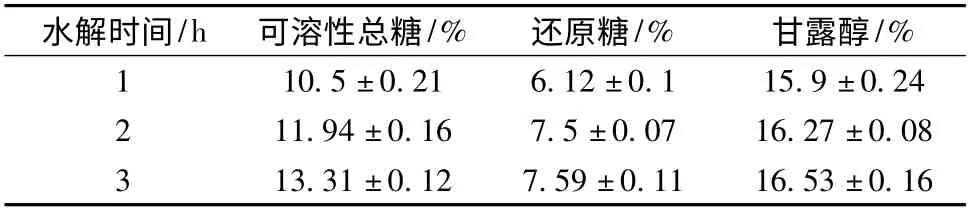
表1 酸法处理水解液中甘露醇和还原糖的含量(占海带干重)Table 1 Mannitol and reduced sugar content of the hydrolysate in different hours after acid treatment
在褐藻胶裂解酶和纤维素酶协同作用下,海带液中各种糖类含量明显高于酸法提取(表2)。水解24 h 时,甘露醇已经溶出16.75%,即使再增加纤维素酶水解24 h 后也仅增加了不到1.5%,说明仅用褐藻胶裂解酶就可以使90%以上的甘露醇溶出。可溶性总糖和还原糖在12 h 和24 h 后时,两者的含量都没有明显提高,然而加入纤维素酶后,36 h 和48 h 时测得两者的含量较仅用褐藻胶裂解酶时,提高1.5 ~2 倍左右,纤维素酶可有效降解海带中的纤维素或半纤维素,使其变为单糖或者低聚糖。酶法比酸法可以溶出的糖类明显增加,可溶性总糖提高了约52%左右,还原糖提高了将近70%,甘露醇较前两者略有增加,只增加不到8%。两种酶复合作用比用单一酶作用下得率更高,能够获得更高浓度的还原性糖,得到较多还原糖和甘露醇等单糖,更有利于乙醇发酵。
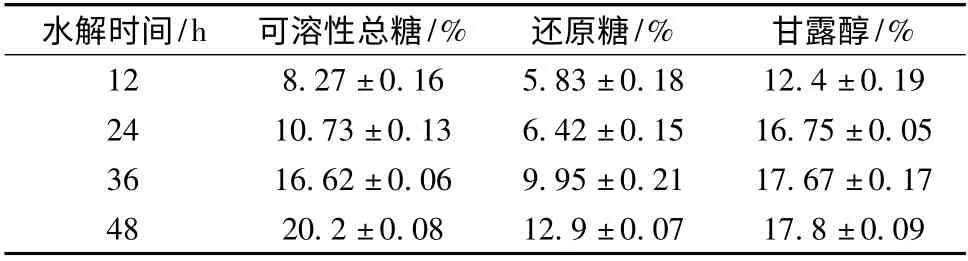
表2 酶法处理水解液中甘露醇和还原糖含量(占海带干重)Table 2 Mannitol and reduced sugar content of the hydrolysate in different hours after enzyme treatment
2.3 酶水解条件确定
2.3.1 褐藻裂解酶用量及水解时间对糖类溶出影响
褐藻胶裂解酶用量对甘露醇溶出的影响见图2。比较0.12 mg/g、0.16 mg/g、0.20 mg/g 的酶用量的产糖量,在30 h 后,三者甘露醇溶出量基本相等,但0.16 mg/g、0.20 mg/g 产糖含量在24 h 时,糖产量基本一样,随着时间的增加甘露醇含量也没有大幅度的增加。因此,选择酶用量为0.16 mg/g、水解24 h 作为后续实验条件。
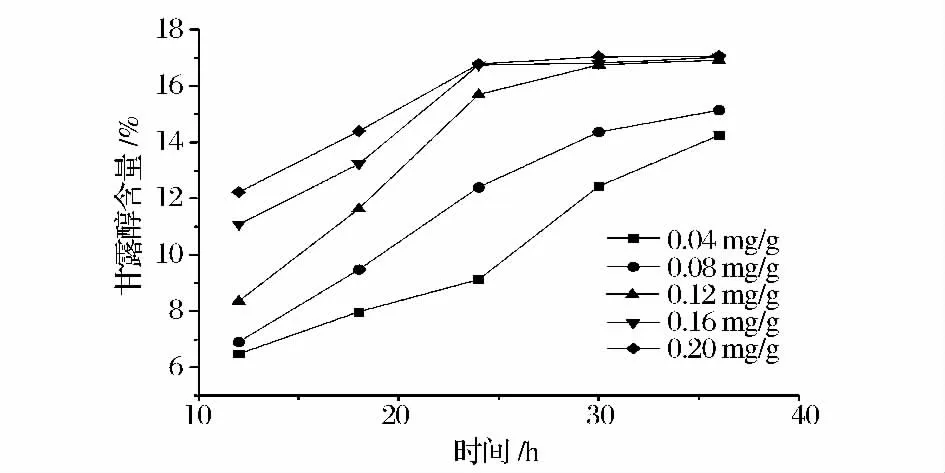
图2 褐藻胶裂解酶用量和不同水解时间对海带酶解产糖的影响Fig.2 Effect of alginate lyase enzyme loading and different time on mannitol yield of pretreated Laminaria japonica during enzymatic hydrolysis
2.3.2 纤维素酶用量及水解时间对糖类溶出的影响
前期预实验时先用褐藻胶裂解酶降低海带黏度,然后添加纤维素酶继续水解,可以得到更高浓度的还原性糖,甘露醇含量在后期纤维素酶水解过程中基本就没有增加,因此在选用纤维素酶用量时,只以还原糖含量为考察依据。图3 结果显示,纤维素酶用量越多,还原糖含量越高,酶解时间越短;酶用量为20 mg/g,酶解时间48 h 时,还原糖含量达到25 mg/g、30 mg/g 的原糖含量,基于成本和时间考虑,选择用酶量为20 mg/g、水解24 h 作为后续实验条件。
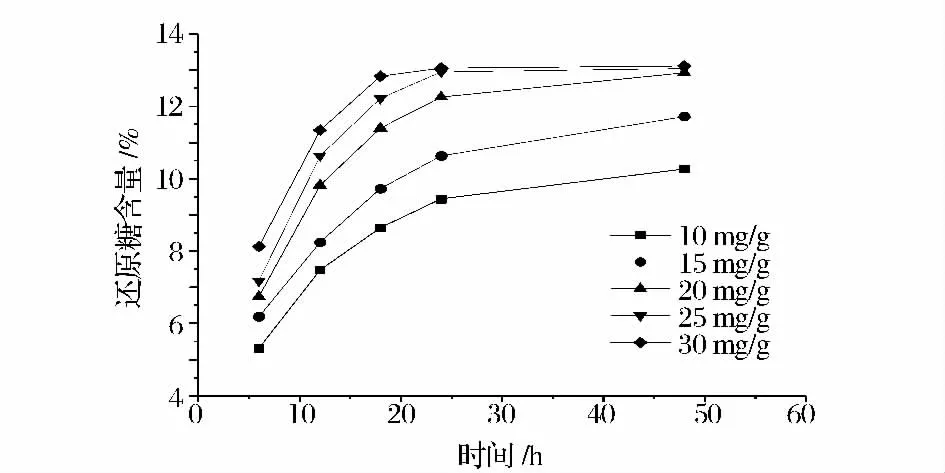
图3 纤维素酶用量和水解不同时间对海带酶解产糖的影响Fig.3 Effect of cellulase enzyme loading and different time on mannitol yield of pretreated Laminaria japonica during enzymatic hydrolysis
2.4 酶解液的乙醇发酵
图4 是毕赤酵母以海带双酶水解液为底物,利用水解液中甘露醇、还原糖产乙醇的结果。图4 结果显示乙醇浓度随着,发酵液中甘露糖和还原糖的消耗呈现逐步增加的趋势;在12 h 时毕赤酵母以利用还原糖为主,还原糖浓度由13.1 g/L 减少到5.37 g/L,甘露醇浓度由17.8 g/L 降为16.94 g/L,只减少不到1 g/L,此时没有测到乙醇,这一过程以酵母细胞增长为主,还未进入厌氧发酵产乙醇阶段;在24 h 时,还原糖浓度降为2.73 g/L,甘露醇浓度急剧下降到7.73 g/L,乙醇浓度为1.65 g/L。从36 h 至发酵结束,还原糖浓度基本维持在一个相对稳定状态,这部分糖可能是不能被毕赤酵母利用的成分;36 ~48 h,甘露醇浓度由3.17 g/L 降为0,乙醇浓度从3.79 g/L 增长到最大值4.57 g/L;之后乙醇浓度有所下降;发酵结束后,发酵液pH 从6.0 降为2.96,说明在发酵过程,除乙醇外,还有有机酸等其它产物产生,造成发酵液pH 下降,按乙醇浓度最高达到4.57 g/L 计,乙醇转化率为0.161 g/g 糖,达到理论转化率的28.99%。
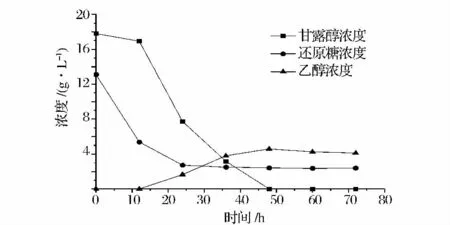
图4 毕赤酵母利用海带水解液发酵乙醇Fig.4 Ethanol production from Laminaria japonica by Pichia angophorae ATCC22304
图5 是海洋细菌Z . palmae 以海带水解液为底物发酵产乙醇及糖类消耗趋势。结果显示,发酵液发酵过程中,乙醇浓度呈缓慢增加趋势,0 ~24 h 时,甘露醇和还原糖浓度同步缓慢下降,分别由17.80 g/L、13.10 g/L 降至14.72 g/L、11.36 g/L;底物利用较缓慢,乙醇产量低,仅为0.94 g/L,说明在发酵初期阶段,碳源只是维持发酵菌的生长与增殖。24 h ~48 h,甘露醇和还原糖浓度分别急速下降到3.82 g/L 和7.35 g/L,乙醇浓度也出现较大幅度增长,由0.94 g/L 增到2.05 g/L,说明糖的消耗速率与乙醇生产速率基本一致;糖类物质消耗越快,乙醇生成的速率也越快。这一阶段细胞个数达到一定峰值后,开始进入厌氧发酵阶段,乙醇产量开始增加。从还原糖浓度消耗情况看出,在48 h 后,还原糖基本维持一个水平不再下降,表明Z. palmae 不能利用剩余的还原糖。60 h时甘露醇完全耗尽,乙醇浓度达到最大值2.68 g/L,相应乙醇转化率为0.114 g/g 糖。
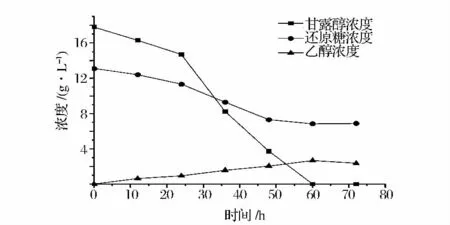
图5 棕榈发酵细菌利用海带水解液发酵乙醇Fig.5 Ethanol production from Laminaria japonica by Zymobacter palmae ATCC51623
发酵结束后,测得发酵液酸度由pH6.0 降为pH3.35,发酵过程中生成大量有机酸使其酸度降低,pH 过低影响细菌正常代谢过程。因此,后续工作实验需要发酵细菌全程参数调控优化,以便提高海带发酵效率,同时用HPLC 检测发酵产物及副产物成分。
3 结论
(1)海带中多糖类物质在酸和高温环境下,可以被降解为单糖或低聚糖;但同时六碳糖醇(甘露醇)及水解后的其他单糖,在高温酸的环境下加剧脱水生成副产物羟甲基糠醛(5-HMF)、乙酰丙酸、甲酸等物质,它们的存在会抑制微生物的生长,影响后期发酵乙醇产量。酶法水解较温和,不会有这些副产物产生,先通过褐藻胶裂解酶水解,再向酶解体系中补加纤维素酶,从而弥补酶解体系的不足,提高了酶解得率。以海带粉浓度为5%(w/v)进行酶解实验,在酶解条件分别为:①温度37℃、pH6.3、酶用量0.16 mg褐藻胶裂解酶/g 干海带粉、水解时间24 h,②温度50℃、pH5.0、酶用量20 mg 纤维素酶/g 干海带粉,水解24 h;通过双酶解,可以得到甘露醇17.8%、还原糖12.9%、可溶性总糖20.2%(占藻体干重的百分比)。酶法和酸法得到总糖(可溶性总糖和甘露醇之和)分别约占藻体干重的38%和29.84%,酶法比酸法提取的糖类提高了27.4%。
(2)海带酶解液经过浓缩后,利用毕赤酵母、棕榈发酵细菌发酵,最高乙醇浓度分别为分别4.57 g/L(5.8 mL/L)和2.68 g/L(3.4 mL/L),最大乙醇浓度达到理论转化率的28.99%;由前期实验结果研究发现,P. angophorae 可以直接利用甘露醇、岩藻糖、甘露糖、木糖、葡萄糖等单糖,以及褐藻糖胶、昆布多糖等多糖为唯一碳源发酵生产乙醇;Z. palmae 可以利用甘露醇、葡萄糖、半乳糖、岩藻糖、昆布淀粉为碳源发酵生产乙醇,但都不能利用海带的主要成分褐藻胶产乙醇。毕赤酵母与棕榈发酵细菌发酵海带水解液产乙醇的结果不够理想,主要有以下几点影响因素:海带中含有碳水化合物、脂肪、蛋白质、色素、金属离子、碘等较为复杂,通过水解后海带液中糖类物质复杂多样,主要成分不能被微生物所利用,还有没有对海带中金属离子、碘等因素进行研究,是否会影响菌株的发酵结果等;发酵是一个复杂的生化过程,其结果好坏涉及诸多因素,除了菌株的生产性能,还与培养基的配比、种子质量、发酵条件和控制过程等因素有密切关系,由于本次实验是在摇瓶中进行,发酵实验结果不够理想,后期研究工作应该用发酵罐优化发酵工艺条件来提高乙醇产率。
[1] 周志刚,毕燕会. 大型海藻能源化利用的研究与思考[J]. 海洋经济,2011,1(4):23 -27.
[2] Berndes G,Hoogwijk M.The contribution of biomass in the future global energy supply:a review of 17 studies[J]. Biomass Bioenergy,2003,25(1):1 -28.
[3] Ji-Suk Jang ,YuKyeong Cho ,Gwi-Taek Jeong. Optimization of saccharification and ethanol production by simultaneous saccharification and fermentation (SSF)from seaweed,Saccharina japonica[J]. Bioprocess Biosyst Eng,2012,35(1):11 -18.
[4] 刘万顺,王海,戴继勋. 海藻酸解壁酶研究[J]. 海洋学报,1997,(3):47 -48.
[5] 李林,罗琼,张声华. 海带中褐藻糖胶的组分分析[J].中国食品学报,2001,1(1):46 -49.
[6] Horn S,Aasen I,φ stgaard K.Production of ethanol from mannitol by Zymobacter palmae[J]. Journal of Industrial Microbiology & Biotechnology,2000,24(1):51 -57.
[7] Sung-Soo Jang,Yoshihito Shirai,Motoharu Uchida ,et al.Production of mono sugar from acid hydrolysis of seaweed[J]. African Journal of Biotechnology,2012,11(8):1953-1963.
[8] Xin Wang,Liu Xianhua,Wang Guangyi.Two-stage hydrolysis of invasive algal feedstock for ethanol fermentation[J].Journal of Integrative Plant Biology,2011,53 (3):246 -252.
[9] Ge Leilei,Wang Peng,Mou Haijin. Study on saccharification techniques of seaweed wastes for the transformation of ethanol[J]. Renew Energy,2011,36(1):84 -89.
[10] Adams MJ,Gallagher JA,Donnison IS .Fermentation study on Saccharina latissima for bioethanol production considering variable pre-treatments[J]. J Appl Phycol,2009,21:569 -574.
[11] Percival E,McDowell RH.Chemistry and Enzymology of Marine Algal Ploysaccharides [M]. London:Academic Press,1967:53 -55.
[12] 赵凯,许鹏举,谷光烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008,29(8):534 -536.
[13] 杨晓东,崔勤敏,朱妙琴,等. 发酵虫草菌粉中甘露醇含量的比色法测定[J]. 中国现代应用药学杂志,2006,23(6):504 -506.
[14] 周军明,崔艳丽,毛建卫. 褐藻糖胶测定的影响因素及其提取的优化工艺分析[J]. 科技通报,2007,23(1):37 -40.
[15] 李自达,申乃坤,赖钧灼,等. 基于96 孔板与拉曼光谱的发酵乙醇高通量快速检测[J]. 分析化学,2010,38(9):1 267 -1 271.

