海洋污染物对菲律宾蛤仔的免疫毒性
丁鉴锋 ,闫喜武,赵力强,杨 凤,王连顺,包鹏云
(1.大连海洋大学,大连 116023;2.辽宁省贝类良种繁育工程技术研究中心,大连 116023)
近年来,随着沿海城市工农业生产的快速发展,以及一些灾害性事件的发生,导致沿海海域环境污染日趋加剧。另一方面,养殖海区自身也会产生一些污染物,结果导致浅海养殖海区环境恶化,严重影响了海水养殖产业的健康可持续发展。菲律宾蛤仔是我国北方一种重要的滩涂养殖贝类,调查发现:环境污染导致贝类的免疫能力降低,加之高温季节有害菌的大量繁殖,可能是夏季养殖蛤仔大规模死亡的重要原因之一[1]。
因此,本研究旨在通过比较不同海区的污染物对蛤仔免疫能力的影响,探讨蛤仔大规模死亡的原因,为菲律宾蛤仔养殖业的绿色、健康和可持续发展提供理论依据。
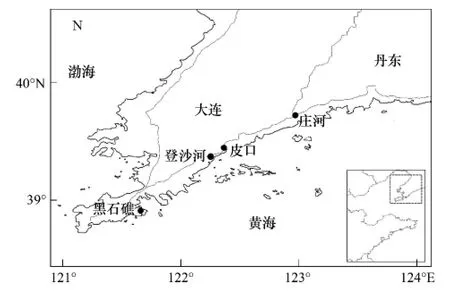
图1 采样点地图Fig.1 Map of Dalian showing the four sites where clams were collected
1 材料与方法
1.1 样品采集
测定用菲律宾蛤仔采至大连周边海区:皮口、登沙河、庄河和黑石礁海区(图1)。
1.2 蛤仔体内污染物含量的测定
蛤仔体内污染物含量委托国家海洋环境监测中心(大连)进行测定,测定结果如表1所示。
1.3 血淋巴细胞样品制备
取各采样点蛤仔样品30个,使用1mL无菌注射器从菲律宾蛤仔围心腔中分别抽取血淋巴200μL,将6个蛤仔的血淋巴混合加入1.5mL样品管作为一个测定样品,并置于冰上保存,待后续实验测定。
1.4 肥满度指数(CI)测定
记录采血后蛤仔个体壳长,并将软组织剥离放入烘箱中,60℃烘干18h,测定组织干重并计算CI值。
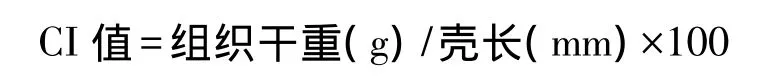
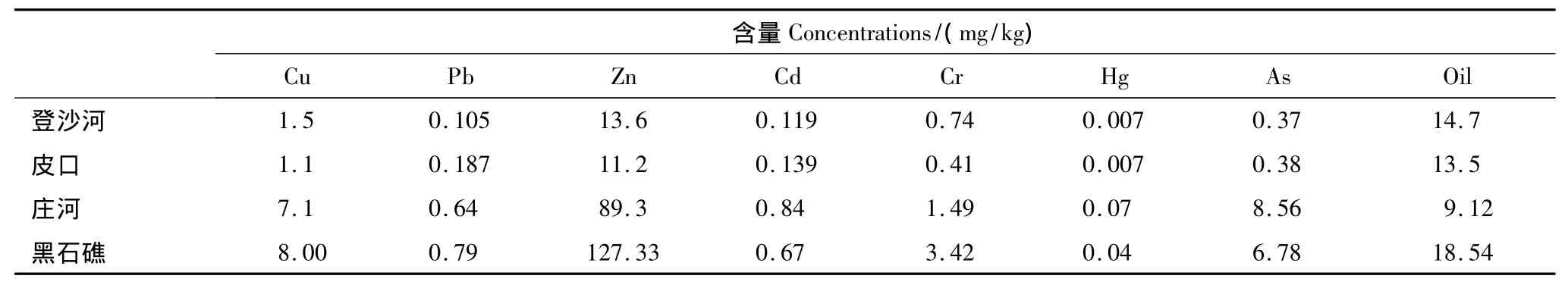
表1 各海区蛤仔体内污染物含量Table1 Contaminant concentrations in clam tissue from different sea area
1.5 血细胞总数测定(THC)
吸取30μL血淋巴细胞样品加入到等量的BFC固定液中,固定后样品加到血球计数板上,在10倍光学显微镜下观察计数。
BFC固定液:NaCl 2%,乙酸钙1%,甲醛4%。
1.6 细胞膜稳定性
取50μL血淋巴细胞样品加入酶标板中,4℃孵育45min;用生理盐水洗去未粘附血细胞(100μL×2);加入200μL 0.004%中性红20℃孵育3h;用生理盐水洗去多余染料;再分别加入200μL酸化酒精破坏细胞膜及重新溶解中性红;将酶标板放入酶标仪中OD550读取数值。表示方法:每毫克蛋白对应的吸光度值变化。
1.7 血细胞吞噬活性
血细胞吞噬活性采用Hannam等人[2]的方法,取50μL血淋巴细胞样品加入到96孔酶标板中,4℃孵育1h;用100μL贝类生理盐水洗去未粘附血细胞2次;加入50μL中性红染过的酵母悬液(50×107个/mL);20℃孵育30min后,加入100μL BFC终止反应;多余的酵母颗粒用生理盐水洗去,加入100μL酸化酒精,置于酶标仪中,使用OD550nm读取吸光度值。活性表示方法:每毫克蛋白所吞噬的酵母颗粒数。
酵母标准曲线的制备:取50μL 酵母颗粒(浓度分别为6.25、12.5、25、50、100×107个/mL),加入等量酸化酒精,OD550nm读取吸光度值,用酵母浓度与吸光度值作标准曲线。
贝类生理盐水配方:0.02mol/L HEPES,0.4mol/L NaCl,0.1mol/L MgSO4,0.01mol/L KCl,0.01mol/L CaCl2,调 pH 为 7.4。
酸化酒精配方:醋酸1%,酒精20% 。
1.8 酚氧化活性
酚氧化酶采用Zhang等人改进的方法,以L-dopa为底物,胰蛋白酶为诱导因子[3]。取50μL血淋巴细胞样品加入到96孔板中,分别加入50μL CAC缓冲液混合均匀;25℃孵育10min;加入100μL L-多巴胺(3mg/mL溶于CAC缓冲液中),混合均匀后置于酶标仪中,读取490nm处吸光度值。酶活性的定义为在实验条件下,每分钟吸光度值增加0.001为1个酶活力单位。活性表示方法:每毫克蛋白所具有的酶活力。
CAC 缓冲液配方:0.01mol/L 二甲基胂酸钠,0.45mol/L NaCl,10mmol/L CaCl2·6H2O,26mmol/L MgCl2·2H2O,调 pH 7.0。
1.9 亮氨酸氨基肽酶(LAP)活性
LAP活性测定采用Oubella等人[4]的方法,向96孔酶标板各加入100μL血淋巴细胞样品,再分别加入75 μL Tris-HCl(0.2 mol/L,pH 8.0),混合均匀后分别加入25μL 10 mmol/L L-亮氨酸-4-硝基苯胺(去离子水配制,Sigma),立即放于酶标仪上,记录20min内吸光度的变化情况(OD405nm,每5min读数1次)。酶活性以每毫克蛋白浓度改变的吸光度值0.001为一个酶活力单位。活性表示方法:每毫克蛋白所具有的酶活力。
1.10 溶菌酶活性测定
溶菌酶测定采用Allam和Paillard[5]改进后的方法,以鸡溶菌酶标准品为标准,取40μL标准品(浓度分别为0.6、1.25、2.5、5、10、20、40 mg/mL)或者血淋巴细胞样品加入96孔酶标板中;分别向各孔中加入160μL容壁微球菌溶液(细菌OD600=0.4,缓冲液为0.06mol/L磷酸盐缓冲液,pH 6.4);室温孵育1h,540nm读取吸光度值,采用标准曲线计算血淋巴细胞溶菌酶活性。活性表示方法:每毫克蛋白所具有的酶活力。
1.11 总谷胱甘肽(GSH+GSSG)的测定
总谷胱甘肽的测定采用碧云天公司的GSH和GSSG检测试剂盒进行,按照试剂盒说明书进行操作。
1.12 超氧化物歧化酶(SOD)活性测定
血淋巴超氧化物酶活性的测定采用碧云天生物技术研究所的总SOD活性检测试剂盒进行测定,按照试剂盒说明书进行操作。活性表示方法:每毫克蛋白所具有的酶活力。
1.13 脂质氧化(MDA)的测定
脂质氧化的测定采用碧云天公司的脂质氧化检测试剂盒进行,按照说明书进行相关操作。
1.14 总蛋白浓度的测定
血淋巴中总蛋白浓度的测定采用碧云天生物技术研究所Bradford蛋白浓度测定试剂盒进行测定,按照试剂盒说明进行操作。
1.15 数据统计
实验数据使用spss11.5软件分析,结果用平均值±标准差(means±SD)表 示,均采用单因素方差分析。
2 结果
2.1 不同海区蛤仔个体肥满度指数比较
不同海区蛤仔个体肥满度指数依次为:皮口(1.47±0.06)>黑石礁(1.05±0.08)>庄河(0.87±0.05)>登沙河(0.79±0.03),但是各海区之间没有显著差异(P<0.05)。
2.2 不同海区蛤仔血细胞总数比较
不同海区蛤仔血细胞总数的测定结果见图2。皮口海区蛤仔血细胞总数最高,显著高于庄河和黑石礁海区(P<0.05);登沙河海区蛤仔血细胞总数居中,庄河和黑石礁海区蛤仔血细胞总数最低,但这3个海区无显著差异。
2.3 不同海区蛤仔血细胞膜稳定性比较
不同海区蛤仔血细胞膜稳定性(ΔOD550/mg蛋白质)依次为:登沙河(0.135±0.041)>庄河(0.127±0.026)>皮口(0.091±0.017)>黑石礁(0.090±0.004),但各海区蛤仔血细胞膜稳定性没有显著差异(P<0.05)。
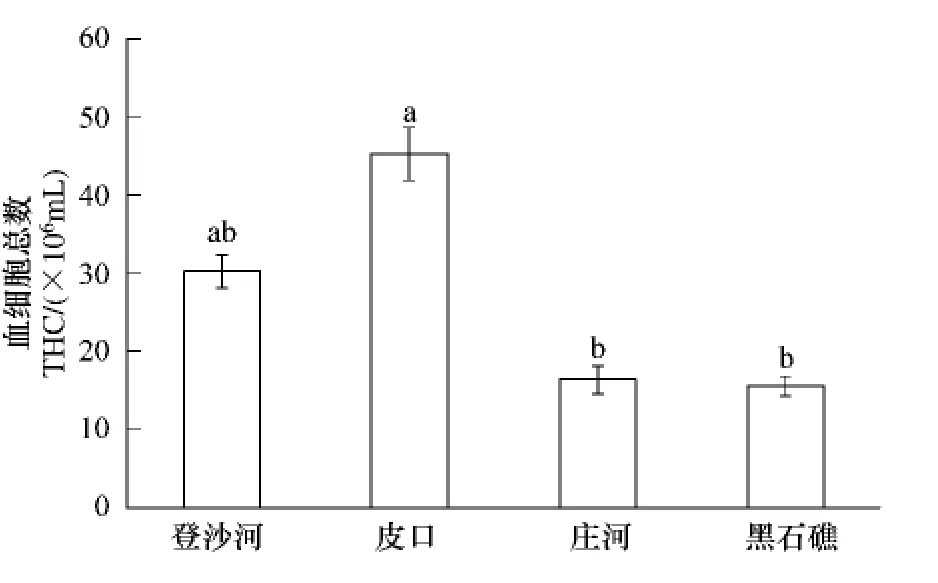
图2 不同海区蛤仔血细胞总数比较Fig.2 Comparison of the THC of clam collected from different sea areas
2.4 不同海区蛤仔血细胞吞噬活性比较
不同海区蛤仔血细胞吞噬活性(×108mg-1蛋白质)依次为:登沙河海区(7.88±2.38)>皮口海区(7.42±2.11)>庄河(5.97±1.11)>黑石礁(5.62±0.92),但各海区蛤仔血细胞吞噬活性无显著差异(P<0.05)。
2.5 不同海区蛤仔血淋巴酚氧化酶活性比较
不同海区蛤仔血淋巴酚氧化酶活性 (U/mg蛋白质)依次为:庄河(277.1±60.3)>登沙河(227.6±58.8)>皮口(217.4±39.9)>黑石礁(184.4±14.8),但各海区蛤仔血淋巴酚氧化酶活性无显著差异(P<0.05)。
2.6 不同海区蛤仔血淋巴亮氨酸氨基肽酶活性比较
不同海区蛤仔血淋巴亮氨酸氨基肽酶活性测定结果如图3。皮口海区蛤仔血淋巴LAP活性显著高于其他3个海区(P<0.05);登沙河、皮口和黑石礁海区蛤仔血淋巴LAP活性无显著差异。
2.7 不同海区蛤仔血淋巴溶菌酶活性比较
不同海区蛤仔血淋巴溶菌酶活性测定结果见图4。皮口海区蛤仔溶菌酶活性显著高于其他3个海区(P<0.05);登沙河、庄河和黑石礁海区蛤仔血淋巴溶菌酶活性无显著差异。
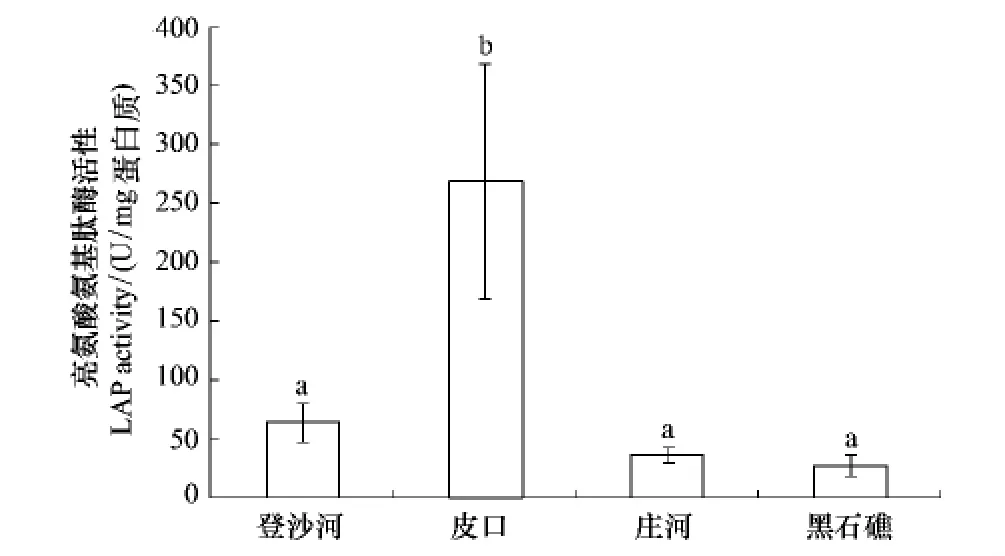
图3 不同海区蛤仔血淋巴LAP活性比较Fig.3 Comparison of the LAP activity of haemolymph in clams collected from different sea areas
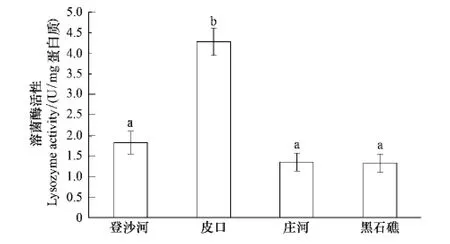
图4 不同海区蛤仔血淋巴溶菌酶活性比较Fig.4 Comparison of the LYZ activity of haemolymph in clams collected from different sea areas
2.8 不同海区蛤仔血淋巴总谷胱甘肽含量比较
不同海区蛤仔血淋巴总谷胱甘肽含量测定结果如图5。黑石礁海区蛤仔血淋巴谷胱甘肽含量显著高于其他3个海区(P<0.05);登沙河、皮口和庄河海区血淋巴谷胱甘肽含量无显著差异。
2.9 不同海区蛤仔血淋巴超氧化物歧化酶(SOD)活性比较
不同海区蛤仔血淋巴SOD活性测定结果见图6。庄河海区蛤仔血淋巴SOD活性最高,登沙河海区蛤仔最低,二者差异显著(P<0.05);皮口和黑石礁海区蛤仔血淋巴SOD活性居中,与其他两个海区蛤仔差异不显著。
2.10 不同海区蛤仔血淋巴细胞脂质氧化比较
不同海区蛤仔血淋巴细胞脂质氧化测定结果见图7。登沙河海区蛤仔血淋巴细胞脂质氧化最高,皮口海区蛤仔最低,二者差异显著(P<0.05);庄河和黑石礁海区蛤仔居中,与其他两个海区相比无显著差异。
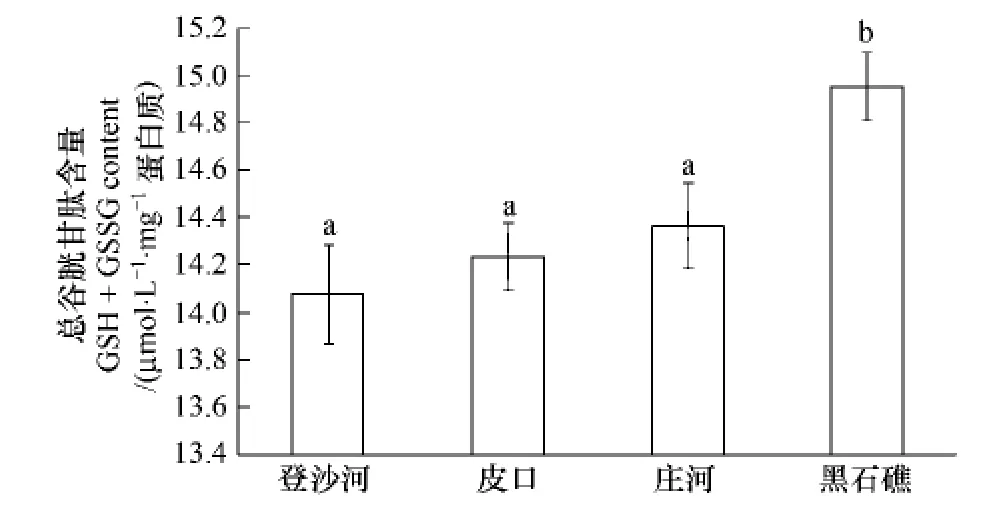
图5 不同海区蛤仔血淋巴总谷胱甘肽含量比较Fig.5 Comparison of the glutathione content of haemolymph in clams collected from different sea areas

图6 不同海区蛤仔血淋巴SOD活性比较Fig.6 Comparison of the SOD activity of haemolymph in clams collected from different sea areas
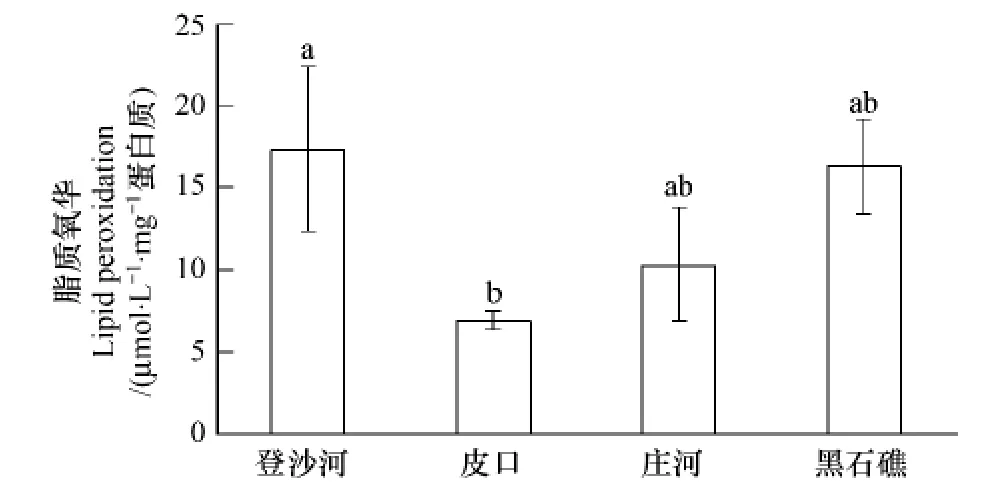
图7 不同海区蛤仔血淋巴脂质氧化比较Fig.7 Comparison of the lipid peroxidation level of haemolymph in clams collected from different sea areas
3 讨论
贝类的免疫机制主要包括细胞免疫和体液免疫两条途径,其中血细胞是贝类执行细胞免疫功能的最重要的细胞,是无脊椎动物免疫系统的第一道防线,环境因子的变化会对血细胞的免疫能力造成重要影响[6]。对牡蛎和蛤仔等贝类的研究发现,环境污染物如石油烃和重金属等长期胁迫能够引起其体内血细胞数量减少,原因可能是污染物引起贝类体内含溶酶体丰富的血细胞溶解所致[7-9]。在本研究中,皮口海区蛤仔的血细胞总数最多,而黑石礁和庄河海区蛤仔血细胞数量最少,从表1可以发现,黑石礁和庄河海区蛤仔体内的Cu等重金属含量均比皮口和登沙河海区高,因此这两个海区血细胞数量的减少可能是重金属长期胁迫的结果。不过一些研究也发现:短时间的污染物刺激可以导致贝类血细胞数量增加[10-15],对于这些贝类短期内血细胞数量增加的原因,有研究者认为是由于污染物的刺激导致组织血细胞转移进入循环系统所致,也有学者认为是动物机体对污染物引起的血细胞膜稳定性降低的一种补偿机制[11-13]。因此,环境污染物导致贝类血细胞数量增加还是减少与暴露的时间以及污染物浓度有关[13]。
通常情况下,短期或者低浓度的污染物如工业废水、农药、重金属刺激被认为具有免疫刺激作用,能够使贝类血细胞的吞噬活性增强[14-16]。而高浓度污染物或者污染物长期胁迫能够抑制贝类细胞的吞噬能力,原因主要是由于脂溶性污染物如PHA等以及重金属能够与细胞膜结合,改变细胞膜的流动性和细胞膜上离子泵,导致细胞膜稳定性降低,并且能够阻碍血细胞变形运动,降低其吞噬活性[17-18]。本研究中四个海区蛤仔的细胞膜稳定性和吞噬能力并没有显著地差异,原因可能是海区中的污染物浓度尚未达到对膜稳定性和吞噬能力产生显著影响的阈值[19],亦可能是贝类细胞对污染物刺激产生适应性的结果[20]。
当贝类损伤或者受到病原微生物感染时,能够激活体内酚氧化酶原(PPO)生成酚氧化酶(PO),将体内的苯酚氧化成苯醌并最终生成黑色素参与动物的免疫反应[21]。多种环境污染物能够通过改变贝类血细胞PO的活性而影响其免疫能力,Tujula等发现使用含有机锡(TBT)和Cu的培养基培养72h后,海鞘(Styela plicata)血细胞酚氧化酶活性显著降低[22];Bado-Nilles等人研究证实受到石油污染14d后,牡蛎(Crassostrea gigas)血细胞酚氧化酶活性受到抑制[23];Gagnaire等用Hg处理牡蛎血细胞21h后,其酚氧化酶活性降低[24]。不过研究发现使用氯化镉(CdCl2)或者Zn离子处理的鲍鱼血细胞,其酚氧化酶活性却显著升高[25-26],因此环境污染物对酚氧化酶活性的影响可能与动物及污染物的种类有关[25]。在本研究中,各海区蛤仔血细胞的酚氧化酶活性并未表现出显著差异,其原因可能是蛤仔对污染物长期刺激产生适应性的结果。
贝类血细胞溶酶体中含有各种水解酶包括溶菌酶、氨肽酶、酸性磷酸酶、碱性磷酸酶等,当外来异物进入体内或环境发生变化时,这些水解酶可以通过胞内和胞外途径,参与对异物以及病原的杀伤与清除。对牡蛎(Crassostrea gigas)和滨螺(Littorina littorea)等贝类的调查和研究发现:海水中的有机污染物和重金属等能够导致贝类血淋巴溶菌酶活性降低,并且这种活性的降低与血细胞总数之间存在相关性[13,27-28]。污染物可能通过以下两条途径导致细胞体内水解酶活性降低:一是由于污染物造成的血细胞溶解导致;另一个可能的原因是污染物改变贝类血细胞内溶酶体膜通透性,一些水解酶渗漏所致[29]。在本研究中,登沙河、庄河和黑石礁海区蛤仔血细胞的亮氨酸氨基肽酶和溶菌酶活性显著低于皮口海区,与这3个海区环境中较高的污染物浓度可能有直接的关系。
研究证实,当受到环境胁迫时,贝类能够通过呼吸爆发作用产生大量活性氧,帮助机体清除进入体内的病原,但过量的活性氧会导致动物体内细胞膜的脂质氧化程度增加,因此贝类体内抗氧化系统会被激活,避免活性氧对细胞造成损伤[28,30-32]。在本研究中,登沙河海区的蛤仔血细胞谷胱甘肽含量在4个海区中处于较低水平,并且其SOD活性最低,表明其抗氧化能力受到抑制,因此其细胞膜的脂质氧化程度最大,这一结论与上述研究的结果相一致。但人们也发现:黑石礁海区蛤仔血细胞谷胱甘肽含量最高,而庄河海区的蛤仔血细胞具有最高的SOD活性,但是这两个海区蛤仔的血细胞脂质氧化水平仍然处于较高水平。观察这两个海区蛤仔体内的污染物检测结果(表1)发现:其体内重金属含量远高于其他两个海区的蛤仔,并且黑石礁海区蛤仔体内的石油污染物水平在4个海区中也处于较高水平。谷胱甘肽除作为一种重要的细胞抗氧化成分,其本身也是体内一些催化解毒和污染物代谢反应的酶作用后的产物[33],因此这两个海区蛤仔血细胞较高的谷胱甘肽水平可能是个体对长时间较高浓度污染物刺激的一种保护性反应。此外有研究证实长期的污染物刺激能够导致贻贝(Mytilus edulis)体内活性氧如H2O2和NO等含量增加,推测可能是对其血细胞吞噬能力降低的一种补偿机制[34],因此黑石礁和庄河海区蛤仔血淋巴较高的SOD水平可能与其血细胞较低的吞噬活性有关。
综上所述,养殖水环境中的重金属和石油等有机污染物胁迫能诱导蛤仔产生免疫抑制并导致其抗病能力的降低,加之夏季高温环境细菌大量繁殖是导致蛤仔大规模死亡的重要诱因。因此,减少养殖海区环境污染,净化养殖环境,是防止蛤仔疾病爆发的有效途径。
[1] Xue C B,Wang G L,Jin S.Review on the culture environment of the marine intertidal shellfish.Ecology and Environment,2004,13(1):116-118.
[2] Hannam M L,Bamber SD,Moody JA,Galloway T S,Jones M B.Immune function in the Arctic Scallop,Chlamys islandica,following dispersed oil exposure.Aquatic Toxicology.2009,92(3):187-194.
[3] Zhang Q,Ma H,Mai K,Zhang W,Liufu Z G,Xu W.Interaction of dietary Bacillussubtilis and fructooligosaccharide on the growth performance,non-specific immunity of sea cucumber,Apostichopus japonicus.Fish & Shellfish Immunology,2010,29(2):204-211.
[4] Oubella R,Paillard C,Maes P,Auffret M.Changes in hemolymph parameters in the Manila clam Ruditapes philippinarum(Mollusca,Bivalvia)following bacterial challenge.Journal of Invertebrate Pathology,1994,64(1):33-38.
[5] Allam B,Paillard C.Defense factors in clam extrapallial fluids.Diseases of Aquatic Organisms,1998,33(2):123-128.
[6] Cheng T.Bivalves:Invertebrate Blood Cells.New York:Invertebrate Blood,1981:233-300.
[7] McCormick-Ray M G.Hemocytes of Mytilus edulis affected by Prudhoe Bay crude oil emulsion.Marine Environmental Research,1987,22(2):107-122.
[8] Jeong W G,Cho SM.Effects of polynuclear aromatic hydrocarbons on hemocyte characteristics of the Pacific oyster,Crassostrea gigas.Journal of Shellfish Research,2005,24(2):451-456.
[9] Fisher W S,Oliver L M,Winstead J T,Long E R.A survey of oysters Crassostrea virginica from Tampa Bay,Florida:associations of internal defense measurements with contaminant burdens.Aquatic Toxicology,2000,51(1):115-138.
[10] Auffret M,Duchemin M,Rousseau S,Boutet I,Tanguy A,Moraga D,Marhic A.Monitoring of immunotoxic responses in oysters reared in areas contaminated by the“Erika”oil spill.Aquatic Living Resources,2004,17(3):297-302.
[11] Auffret M.Bivalves as models for marine immunotoxicology//Tryphonas H,Fournier M,Blakley B R,Smits J E G,Brousseau P,eds.Investigative Immunotoxicology:Models and Approaches in Immunotoxicology.Boca Raton:CRCPress,2005:29-48.
[12] Pipe R K,Coles J A,Carissan F M M,Ramanathan K.Copper induced immunomodulation in the marine mussel,Mytilus edulis.Aquatic Toxicology,1999,46(1):43-54.
[13] Hannam M L,Bamber S,John Moody A,Galloway T,Jones M.Immunotoxicity and oxidative stress in the Arctic scallop Chlamys islandica:Effects of acute oil exposure.Ecotoxicology and Environmental Safety,2010,73(6):1440-1448.
[14] Hannam M L,Bamber SD,Sundt R C,Galloway T S.Immune modulation in the blue mussel Mytilus edulis exposed to North Sea produced water.Environmental Pollution,2009,157(6):1939-1944.
[15] Rickwood C J,Galloway T S.Acetylcholinesterase inhibition as a biomarker of adverse effect:a study of Mytilus edulis exposed to the priority pollutant chlorfenvinphos.Aquatic Toxicology,2004,67(1):45-56.
[16] SauvéS,Brousseau P,Pellerin J,Morin Y,Senécal L,Goudreau P,Fournier M.Phagocytic activity of marine and freshwater bivalves:in vitro exposure of hemocytes to metals(Ag,Cd,Hg and Zn).Aquatic Toxicology,2002,58(3/4):189-200.
[17] Camus L,Jones M,Børseth J,Grøsvik B,Regoli F,Depledge M.Total oxyradical scavenging capacity and cell membrane stability of haemocytes of the Arctic scallop,Chlamys islandicus,following benzo(a)pyrene exposure.Marine Environmental Research,2002,54(3):425-430.
[18] Grundy M,Moore M,Howell S,Ratcliffe N.Phagocytic reduction and effects on lysosomal membranes by polycyclic aromatic hydrocarbons,in haemocytes of Mytilus edulis.Aquatic Toxicology,1996,34(4):273-290.
[19] Ahmad I,Coelho JP,Mohmood I,Pacheco M,Santos M A,Duarte A C,Pereira E.Immunosuppression in the infaunal bivalve Scrobicularia plana environmentally exposed to mercury and association with its accumulation.Chemosphere,2011,82(11):1541-1546.
[20] Oliver L M,Fisher W S,Winstead JT,Hemmer B L,Long E R.Relationships between tissue contaminants and defense-related characteristics of oysters(Crassostrea virginica)from five Florida bays.Aquatic Toxicology,2001,55(3):203-222.
[21] Cerenius L,Söderhäll K.The prophenoloxidase-activating system in invertebrates.Immunological Reviews,2004,198(1):116-126.
[22] Tujula N,Radford J,Nair SV,Raftos D A.Effects of tributyltin and other metals on the phenoloxidase activating system of the tunicate,Styela plicata.Aquatic Toxicology,2001,55(3):191-201.
[23] Bado-Nilles A,Quentel C,Auffret M,Le Floch S,Gagnaire B,Renault T,Thomas-Guyon H.Immune effects of HFO on European sea bass,Dicentrarchus labrax,and Pacific oyster,Crassostrea gigas.Ecotoxicology and Environmental Safety,2009,72(5):1446-1454.
[24] Gagnaire B,Thomas-Guyon H,Renault T.In vitro effects of cadmium and mercury on Pacific oyster,Crassostrea gigas(Thunberg),haemocytes.Fish& Shellfish Immunology,2004,16(4):501-512.
[25] Latire T,Le Pabic C,Mottin E,Mottier A,Costil K,Koueta N,Lebel J M,Serpentini A.Responses of primary cultured haemocytes from the marine gastropod Haliotis tuberculata under 10-day exposure to cadmium chloride.Aquatic Toxicology,2011,109:213-221.
[26] Mottin E,Caplat C,Mahaut M L,Costil K,Barillier D,Lebel JM,Serpentini A.Effect of in vitro exposure to zinc on immunological parameters of haemocytes from the marine gastropod Haliotis tuberculata.Fish& Shellfish Immunology,2010,29(5):846-853.
[27] Mazon L,Gonzalez G,Vicario A,Estomba A,Aguirre A.Inhibition of esterases in the marine gastropod Littorina littorea exposed to cadmium.Ecotoxicology and Environmental Safety,1998,41(3):284-287.
[28] GagnéF,Auclair J,Turcotte P,Fournier M,Gagnon C,SauvéS,Blaise C.Ecotoxicity of CdTe quantum dots to freshwater mussels:Impacts on immune system,oxidative stress and genotoxicity.Aquatic Toxicology,2008,86(3):333-340.
[29] Lowe D,Moore M,Evans B.Contaminant impact on interactions of molecular probes with lysosomes in living hepatocytes from dab Limanda limanda.Marine Ecology Progress Series Oldendorf,1992,91(1):135-140.
[30] Koutsogiannaki S,Evangelinos N,Koliakos G,Kaloyianni M.Cytotoxic mechanisms of Zn2+and Cd2+involve Na+/H+exchanger(NHE)activation by ROS.Aquatic Toxicology,2006,78(4):315-324.
[31] Luna-Acosta A,Kanan R,Le Floch S,Huet V,Pineau P,Bustamante P,Thomas-Guyon H.Enhanced immunological and detoxification responses in Pacific oysters,Crassostrea gigas,exposed to chemically dispersed oil.Water Research,2011,45(14):4130-4118.
[32] Canesi L,Viarengo A,Leonzio C,Filippelli M,Gallo G.Heavy metals and glutathione metabolism in mussel tissues.Aquatic Toxicology,1999,46(1):67-76.
[33] Regoli F,Principato G.Glutathione,glutathione-dependent and antioxidant enzymes in mussel,Mytilusgalloprovincialis,exposed to metals under field and laboratory conditions:implications for the use of biochemical biomarkers.Aquatic Toxicology,1995,31(2):143-164.
[34] Akaishi F M,St-Jean SD,Bishay F,Clarke J,da SRabitto I,de Oliveira Ribeiro CA.Immunological responses,histopathological finding and disease resistance of blue mussel(Mytilus edulis)exposed to treated and untreated municipal wastewater.Aquatic Toxicology,2007,82(1):1-14.
参考文献:
[1] 薛超波,王国良,金珊.海洋滩涂贝类养殖环境的研究现状.生态环境,2004,13(1):116-118.

