鲍曼不动杆菌噬菌体生物学特性的研究
余静丹,史红艳,王 丹,徐 花,孙延波
(吉林大学白求恩医学院病原生物学系,吉林长春 130021)
鲍曼不动杆菌属非发酵、氧化酶阴性、触酶阳性的革兰阴性杆菌,存在于自然界的水、土壤和医院环境,是医院获得性感染的主要条件致病菌之一[1-2],可引起住院病人的呼吸道﹑泌尿道和伤口的感染,也是引起烧伤感染的病原菌。近年来随着抗生素的大量使用,鲍曼不动杆菌的耐药率不断上升。2009年中国CHINET鲍曼不动杆菌细菌耐药性监测显示[3],鲍曼不动杆菌对青霉素类和头孢类抗生素的耐药率均高于53.3%,对亚胺培南和美罗培南的耐药率分别为54.8%和57.2%,这给治疗和控制感染带来很多困难。此外,由于多重耐药和泛耐药鲍曼不动杆菌菌株的出现,在非发酵革兰阴性杆菌中鲍曼不动杆菌成为仅次于铜绿假单胞菌引起的医院内感染的重要致病菌[4-5]。最近针对细菌感染的噬菌体疗法重新受到人们的关注。噬菌体是细菌的病毒,广泛分布于自然环境中。鉴于噬菌体对细菌裂解的特异性和高效性,相关领域的科研人员和部分生物医药公司在噬菌体抗细菌性感染方面,开展了一系列的基础性研究和噬菌体生物制剂的开发[6-7]。由于噬菌体在细菌性感染(特别是多重耐药性细菌和超级细菌所致的感染)中可发挥重要作用,因此,开展噬菌体及其噬菌体疗法的研究有着重要的现实意义和潜在的应用价值。
1 材料与方法
1.1 材料
1.1.1 菌株 16株鲍曼不动杆菌由吉林大学中日联谊医院检验科提供,菌株经法国生物梅里埃公司VITEK-32全自动微生物分析鉴定系统鉴定。质控菌株:大肠埃希菌ATCC 25922,铜绿假单胞菌ATCC 27853;其他菌株:大肠埃希菌3株,铜绿假单胞菌、肺炎克雷伯菌、普通变形杆菌、阴沟肠杆菌、伤寒沙门菌和福氏痢疾杆菌各1株,由本教研室鉴定并保存。
1.1.2 主要试剂与工具酶 胰蛋白胨、酵母浸粉(北京奥博星生物技术有限责任公司);营养琼脂(青岛高科园海博生物技术有限公司);聚乙二醇8000(长春市天佳生物技术有限公司);酚∶氯仿∶异戊醇(25∶24∶1)(北京鼎国昌盛生物技术有限责任公司);TM缓冲液、DNase I和RNase A(Sigma公司);蛋白酶 K和考马斯亮蓝 R-250(Amresco公司);HindⅢ、EcoRⅠ、EcoR Ⅴ、BamH Ⅰ、NdeⅠ、AflⅠ、XbaⅠ和PstⅠ(TaKaRa公司)。
1.2 方法
1.2.1 鲍曼不动杆菌的鉴定 16株鲍曼不动杆菌的初步鉴定包括:革兰染色,需氧情况,氧化酶和触酶试验。根据GenBank查询鲍曼不动杆菌16S rRNA基因序列(Accession:Z93435),并设计引物,通过多聚酶链反应,进一步确认鲍曼不动杆菌。设计序列如下:上游引物:5'-ACTGGGCGTAAAGCGTGCGTAGG-3';下游引物:5'-TATGTCAAGGCCAGGTAAGGTTCT-3'。扩增目的基因的长度为436 bp,PCR反应条件:95℃ 5 min,94℃40 s,58 ℃ 40 s,72 ℃ 1 min,35 个循环;72 ℃ 10 min。
1.2.2 噬菌体的分离与纯化 参照文献[8],取吉林大学第三医院污水站未处理的污水1 L,加CaCl2至终浓度1 mmol/L,加入16株新鲜培养的鲍曼不动杆菌宿主菌悬液和LB培养基50 mL,置37℃过夜培养。次日离心除菌,取上清用0.22 μm过滤器滤过除菌。分别以16株鲍曼不动杆菌为宿主菌,与滤过液混合静止15 min,加入融化的0.7%LB琼脂(50℃)并均匀地铺在固体营养琼脂平板上,37℃培养16~18 h,观察噬菌斑形成情况。噬菌斑形成时,挑取单个噬菌斑接种至对应的宿主菌进行扩增,单个噬菌斑经3~5次反复纯化后可得到较纯化的噬菌体。细菌的裂解液经10 000×g离心后,取上清作连续10倍稀释,取100 μL加入0.2 mL相应的宿主菌,制备噬菌斑并测定噬菌体滴度(PFU/mL),噬菌体滴度=稀释倍数×噬菌斑数×10(PFU/mL)。
1.2.3 噬菌体的电镜观察 取噬菌体颗粒悬液20 μL滴于铜网上,待其自然沉淀15 min,用滤纸从侧面吸干多余的液体,加1滴2%磷钨酸到铜网上,染色10 min,待铜网干燥后进行电镜观察。
1.2.4 噬菌体核酸提取和酶切图谱 在噬菌体悬液中加入DNase I和RNase A(终浓度分别为5 μg/mL 和 1 μg/mL),37 ℃ 温育 1 h,加入 EDTA(pH 8.0)至终止反应。加蛋白酶K至50 μg/mL,56℃温育1 h。用等体积平衡酚(pH 8.0)抽提离心,收集水相,再用等体积氯仿抽提1次,收集水相。加入1/10 体积 NaAc(3 mol/L,pH 5.2),于两倍体积的无水乙醇沉淀核酸,干燥后溶于100 μL双蒸水中,-20℃保存。提取的噬菌体核酸进行酶切电泳分析。
1.2.5 噬菌体最佳感染复数(Multiplicity of infection,MOI)的测定 宿主菌至对数生长期,测定其OD590值约等于0.2(细菌数≈1×108cfu/mL),按照0.1、0.01、0.001 和0.000 1 的比例分别加入噬菌体,另设对照组,37℃振荡培养,分别在0、15、30、45、60、90 min 取出10 μL,用适量的0.85%生理盐水稀释,均匀涂在LB固体培养基上,37℃培养14 h,计算菌落数。重复2次,以能够产生菌落数最少的噬菌体与宿主菌的比例为该噬菌体最佳感染复数。
1.2.6 一步生长曲线的绘制 将滴度为1.5×105PFU/mL的噬菌体与宿主菌(1×107cfu/mL)混合,37℃温浴15 min,13 000×g离心1 s,弃上清,用1 mL LB洗涤沉淀2次,用5 mL预热的LB培养液重悬沉淀,迅速置于37℃摇床中振荡培养。分别在 0、10、20、30、40、50、60、70、80 min 取样200 μL,13 000 × g离心 30 s,取上清用稀释法测量噬菌体的滴度,重复实验3次,绘制一步生长曲线,计算噬菌体的潜伏期、爆发期和爆发量(PFU/cell),爆发量=爆发期末期噬菌体滴度/裂解初期宿主菌浓度。
1.2.7 噬菌体蛋白的 SDS-PAGE分析 取500 mL对数生长期的菌液,加入1 mL相应的噬菌体液,置37℃振摇至菌液澄清,离心过滤去除菌体碎片,用100 ku超滤管浓缩噬菌体颗粒,以少量生理盐水悬浮噬菌体颗粒,加入10×上样缓冲液,混匀,沸水煮5 min使蛋白充分变性,置冰上1 min,室温条件下进行SDS-PAGE电泳。
1.2.8 宿主菌的特异性和裂解谱试验 将16株鲍曼不动杆菌,3株大肠埃希菌,铜绿假单胞菌、肺炎克雷伯菌、普通变形杆菌、阴沟肠杆菌、伤寒沙门菌和福氏痢疾杆菌各1株分别接种至LB液体培养基,37℃振荡培养,当OD590值为0.2时,将细菌培养液置4℃ 2 h后,分别加入纯化的噬菌体100 μL 继续培养 30 min,测其 OD590值,重复实验3次。计算加入噬菌体前后的OD590值差值的平均值,判定噬菌体对细菌的特异性和裂解谱的范围。
2 结果与分析
2.1 鲍曼不动杆菌的鉴定
经初步鉴定后,鲍曼不动杆菌符合下列特征:革兰染色阴性、杆状、(0.9 ~1.6)μm × (1.5 ~2.5)μm(图1)、严格需氧、氧化酶阴性和触酶阳性。鲍曼不动杆菌16S rRNA基因部分序列的PCR产物,经1.0%琼脂糖凝胶电泳可见436 bp大小的特异性条带,而质控菌株大肠埃希菌和铜绿假单胞菌的PCR产物则为阴性(图2)。

图1 鲍曼不动杆菌(革兰染色1 000×)Fig.1 Acinetobacter baumannii(gram stain 1 000 × )

图2 鲍曼不动杆菌16S rRNA基因部分序列的PCR扩增Fig.2 PCR amplification of 16S rRNA of Acinetobacter baumannii
2.2 噬菌体的分离纯化和滴定
采用双层琼脂法分离出3株鲍曼不动杆菌噬菌体,分别命名为 ФAb-1、ФAb-2和 ФAb-3,噬菌体在双层琼脂平板上形成圆形透明、直径为1~2 mm的噬菌斑(图3)。单个噬菌斑经3~5次反复纯化后,测得噬菌体的滴度为3×1011~5.6×1011PFU/mL。
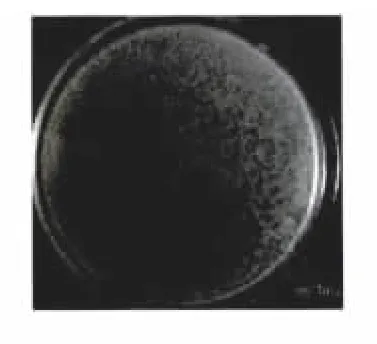
图3 噬菌斑Fig.3 Plaques of Acinetobacter baumannii phage
2.3 噬菌体电镜观察结果
纯化后的噬菌体经负染后,电镜显示噬菌体的头部呈二十面体的立体对称,头部的直径约50 nm,有一短尾长约20 nm(图4、图5和图6),根据噬菌体新的分类法[9],鲍曼不动杆菌噬菌体属于有尾病毒目,足尾噬菌体科。
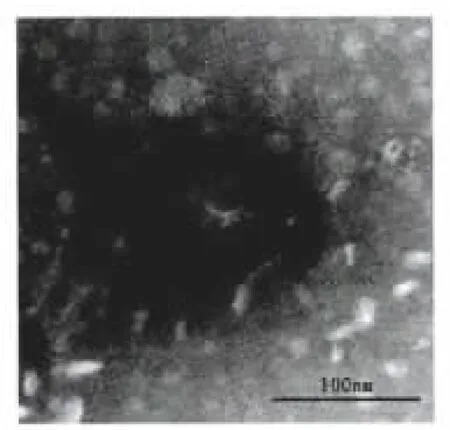
图4 噬菌体ФAb-1电镜照片Fig.4 Electron micrograph of phage ФAb-1

图5 噬菌体ФAb-2电镜照片Fig.5 Electron micrograph of phage ФAb-2
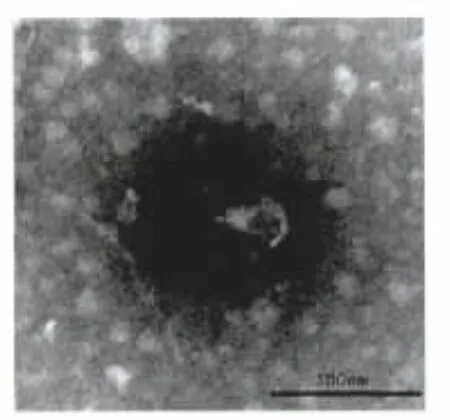
图6 噬菌体ФAb-3电镜照片Fig.6 Electron micrograph of phage ФAb-3
2.4 噬菌体基因组的酶切电泳分析
噬菌体ФAb-1基因组经8种限制性内切酶酶切后,0.8%琼脂糖凝胶电泳分析表明噬菌体ФAb-1基因组具有HindⅢ、EcoRⅤ、NdeⅠ和AflⅢ的多个酶切位点(图7)。此外,经EcoRⅤ及BamHⅠ酶切后得到不同片段的分子量相加,并根据Quantity One软件的比对分析,噬菌体ФAb-1的基因组大小约为40 kb左右。由于BamHⅠ和XbaⅠ单独酶切,分别得到3个和2个片段(图7,Lane5和Lane6),无法判断基因组是环状还是线状DNA。将经BamHⅠ酶切得到的3个片段分别再用XbaⅠ分析(图7),较大的片段酶切后形成3个片段,说明有2个XbaⅠ的切点(图8,Lane1),其余2个片段则没有XbaⅠ的切点(图8,Lane2和Lane3),提示噬菌体ФAb-1基因组含有2个XbaⅠ的切点,如果基因组是线性的用XbaⅠ单酶切后,应切出3个片段,当基因组是环形时且有2个酶切点的情况下,才会切出2个片段。
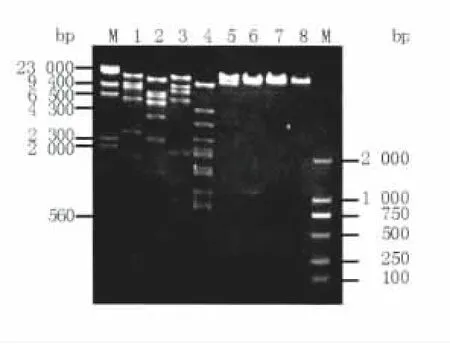
图7 鲍曼不动杆菌噬菌体ФAb-1基因组限制性酶切电泳图Fig.7 Restriction fragments of analysis of phage ФAb-1 genomic DNA
2.5 噬菌体ФAb-1最佳感染复数(MOI)
将宿主菌和噬菌体以不同的比例进行培养,选择0、15、30、45、60、75 和90 min 的时间点,观察噬菌体对细菌的裂解效应。当宿主菌和噬菌体的比例为1∶10和1∶100时,在45 min的时间点,细菌的数量下降最明显,由最初的108cfu/mL下降到106cfu/mL(图9)。在相同的时间内,以宿主菌和噬菌体的最低比例能产生最大的裂解效应,为该噬菌体的最佳感染复数,即噬菌体ФAb-1的MOI为10-2。
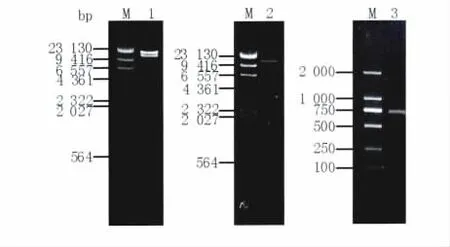
图8 鲍曼不动杆菌噬菌体ФAb-1基因组结构的初步分析Fig.8 Analysis of structure of phage ФAb-1 genome
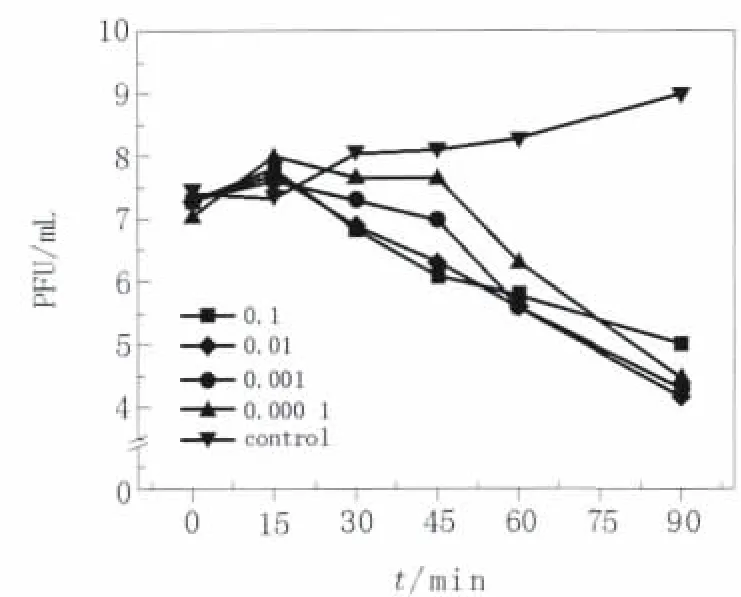
图9 鲍曼不动杆菌噬菌体ФAb-1的最佳感染复数Fig.9 In vitro lytic efficacy and multiplicity of infection of phage ФAb-1
2.6 噬菌体ФAb-1一步生长曲线
将噬菌体(1.5×105PFU/mL)和宿主菌(1×107cfu/mL)混合培养,以时间为横坐标,以log10噬菌体滴度为纵坐标作噬菌体的一步生长曲线图(图10),噬菌体感染宿主菌的潜伏期为20 min左右,爆发时间为30 min左右,爆发量为190 PFU/cell。爆发量=爆发末期噬菌体滴度(1.9×108PFU/mL)/初期宿主菌浓度(1×107cfu/mL)。
2.7 噬菌体ФAb-1蛋白的SDS-PAGE分析
噬菌体ФAb-1纯化后经变性进行SDS-PAGE电泳分析,经过考马斯蓝染色和脱色,可观察到7条带,可能包括噬菌体的结构蛋白和非结构蛋白,相对分子量在29~116 ku之间(图11)。
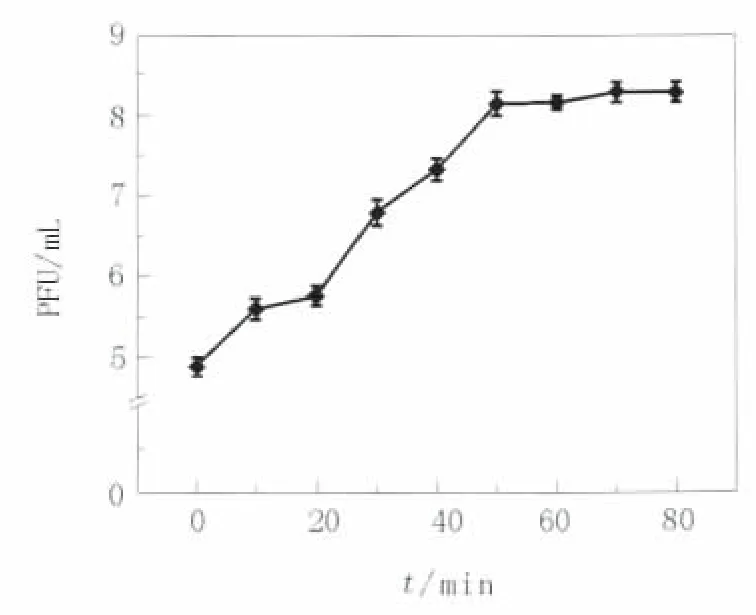
图10 噬菌体ФAb-1一步生长曲线Fig.10 One-step growth curve of phage ФAb-1

图11 噬菌体蛋白SDS-PAGE电泳Fig.11 SDS-PAGE analysis of phage proteins
2.8 宿主菌的特异性和裂解谱
为进一步确认噬菌体的特异性和裂解谱的范围,观察了不同宿主菌在与噬菌体作用前后的浓度变化。结果显示,噬菌体ФAb-1对3株鲍曼不动杆菌(鲍曼不动杆菌1、鲍曼不动杆菌3和鲍曼不动杆菌10)具有特异性的裂解作用,即加入噬菌体后,宿主菌浓度由 OD590的0.2下降至0.05左右,对其他宿主菌则无裂解作用(OD590超过0.2以上),见图12。同时也表明,噬菌体ФAb-1对所选择的致病菌如伤寒沙门菌(S.typhi)和福氏痢疾杆菌(S.flexneri)以及条件致病菌如大肠埃希菌(E.coli)、普通变形杆菌(P.vulgaris)、阴沟肠杆菌(E.cloacae)、肺炎克雷伯菌(K.pnemoniae)和铜绿假单胞菌(P.aeruginosa)无裂解作用(OD590超过0.2 以上),见图13。

图12 宿主菌的特异性和裂解谱试验Fig.12 Host cells specificity of phage

图13 非宿主菌的特异性和裂解谱试验Fig.13 Non-host cells specificity of phage
3 结论与讨论
鲍曼不动杆菌是非发酵类的革兰阴性杆菌,除广泛分布于自然界外,也可存在于医院诊室和病房中,以及人体的体表和黏膜中,在免疫缺陷的人群中可引起严重的感染如肺炎、脑膜炎、败血症和泌尿系的感染。此外,近年来随着抗生素的不合理应用,鲍曼不动杆菌的耐药率不断上升,鲍曼不动杆菌成为目前医院内感染的重要致病菌之一,在临床分离的非发酵革兰阴性杆菌中仅次于铜绿假单胞菌[10],近年来临床分离的鲍曼不动杆菌对头孢菌素类、氨基糖苷类和奎诺酮类抗生素出现多重耐药性,特别是产新型金属β-内酰胺酶(NDM-1)不动杆菌属“超级细菌”的出现[11-12]给临床治疗工作带来极大的困难。
噬菌体是能够感染细菌、真菌、放线菌和螺旋体等微生物的病毒。噬菌体有严格的宿主特异性,一种噬菌体往往只能感染一种细菌或某种细菌的某一血清型。根据噬菌体的生活周期,噬菌体分为毒性(裂解性)噬菌体和温和噬菌体2种类型。由于毒性噬菌体裂解细菌的特异性和高效性使得针对细菌性感染(特别是由耐药性细菌引起的感染)的噬菌体疗法又受到特别的关注,例如针对耐甲氧西林金黄色葡萄球菌所致的感染的噬菌体研究和疗法都取得比较令人满意的结果[13]。2006年美国FDA宣布,批准一种针对单核细胞李斯特菌的噬菌体制剂添加在肉类和禽类等一些熟食品中[14]。2009年英国医学和保健品协调署授权一家医院从事一项噬菌体治疗慢性耳炎的Ⅰ期和Ⅱ期临床研究[15]。
基于噬菌体在抗菌方面的一些独特优势,利用16株鲍曼不动杆菌的临床分离株,采用双层琼脂噬斑法从污水中分离出3株针对鲍曼不动杆菌的毒性噬菌体,分别命名为 ФAb-1、ФAb-2和ФAb-3。电镜观察表明鲍曼不动杆菌噬菌体的头部呈二十面体,立体对称、直径约为50 nm,有一短尾,属于有尾病毒目。根据噬菌体最新分类方法[9],有尾病毒目包括肌尾噬菌体科(尾部的长度与头部的直径相等),管尾噬菌体科(尾部长度是头部直径的2倍左右)和足尾噬菌体科(尾部的长度明显短于头部的直径)。本实验分离的鲍曼不动杆菌噬菌体属于有尾病毒目、足尾噬菌体科,这与Yang等[16]分离的鲍曼不动杆菌噬菌体属管尾噬菌体科有所不同,说明在不同的地域针对同种细菌的噬菌体在形态上有所差异。在所分离的3株噬菌体中,选择噬菌体ФAb-1进行了生物学特性的初步分析。最佳感染复数是研究噬菌体裂解细菌效能的重要指标之一,结果表明当噬菌体ФAb-1与宿主菌的比例为1∶100时,裂解效果最好。按照这样的比例观察噬菌体ФAb-1的一步生长曲线发现,从噬菌体吸附宿主菌到大量子代噬菌体的释放时间约为20 min。潜伏期的长短取决于多种因素,如宿主菌的生理状态、环境条件(温度、pH等)。随着宿主菌的不断裂解和新的子代噬菌体的释放,噬菌体增殖的数量达到最大,本实验测得噬菌体ФAb-1爆发时间约为30 min(即从20 min开始到50 min的时间段)。噬菌体ФAb-1的核酸酶切电泳显示,含有HindⅢ、EcoRⅤ、NdeⅠ和AflⅢ的多个酶切位点,将EcoRⅤ及Bam HⅠ酶切后得到不同片段的分子量相加,并根据 Quantity One软件的比对分析后,噬菌体ФAb-1的基因组大小约为40 kb左右,与相关文献的报道相同[17]。将BamHⅠ酶切的3个片段,再分别经XbaⅠ酶切,最终确认噬菌体ФAb-1的基因组为双股环状DNA。SDS-PAGE初步分析提示,噬菌体ФAb-1蛋白包括2个主要蛋白和5个次要蛋白带,相对分子量在29~116 ku之间。特异性和裂解谱试验显示,噬菌体ФAb-1能裂解3株鲍曼不动杆菌,对其他致病菌和条件致病菌无裂解作用,说明鲍曼不动杆菌噬菌体ФAb-1具有高度特异性,另一方面相对16株鲍曼不动杆菌来说,噬菌体ФAb-1的裂解谱较窄。噬菌体生物学特性的研究是研制和开发噬菌体抗菌生物制剂的前提,虽然噬菌体裂解细菌具有专一性,但筛选宽噬菌谱的噬菌体技术以及采用多种噬菌体混合的“鸡尾酒”噬菌体制剂是未来噬菌体应用的趋势[18]。另一方面,深入研究噬菌体裂解细菌的机制,可筛选新型药物靶标,为研发新型抗菌药物提供了可能。
[1] Perez F,Hujer AM,Hujer KM,et al.Global challenge of multidrug-resistant Acinetobacter baumannii[J].Antimicrobial A-gents and Chemotherapy,2007,51(10):3471-3484.
[2] 张虎,王照峰,吴楠,等.重症监护病房鲍曼不动杆菌医院感染的调查分析[J].微生物学杂志,2012,32(5):104-106.
[3] 张小江,徐春英,俞允松,等.2009年中国CHINET鲍曼不动杆菌细菌耐药性监测[J].中国感染与化疗杂志,2010,10(6):441-446.
[4] Dijkshoorn L,Nemec A,Seifert H.An increasing threat in hospitals:multidrug-resistant Acinetobacter baumannii[J].Nature Reviews Microbiology,2007,5(12):939-951.
[5] Barbolla RE,Centron D,Maimone S,et al.Molecular epidemiology of Acinetobacter baumannii spread in an adult intensive care unit under an endemic setting[J].American Journal of Infection Control,2008,36(6):444-452.
[6] Hagens S,Loessner MJ.Application of bacteriophages for detection and control of food-borne pathogens[J].Applied Microbiology and Biotechnology,2007,76(3):513-519.
[7] Mann NH.The potential of phages to prevent MRSA infections[J].Research in Microbiology,2008,159(4):400-405.
[8] Synnott AJ,Kuang Y,Kurimoto M,et al.Isolation from sewage influent and characterization of novel Staphylococcus aureus bacteriophages with wide host range and potent lytic capabilities[J].Applied and Environmental Microbiology,2009,75(13):4483-4490.
[9] Matsuzaki S,Rashel M,Uchiyama J,et al.Bacteriophages therapy:a revitalized therapy against bacterial infectious diseases[J].Journal of Infection and Chemotherapy,2005,11(5):211-219.
[10]吴长生,伍严安,胡辛兰,等.鲍曼不动杆菌整合子与耐药性的相关性研究[J].实验与检验医学,2011,29(5):474-476.
[11]Zhou Z,Guan R,Yang Y,et al.Identification of New Delhi metallo-β-lactamase gene(NDM-1)from a clinical isolate of Acinetobacter junii in China[J].Canadian Journal of Microbiology,2012,58(1):112-115.
[12]Kasse M,Nordmann P,Wichelhaus TA,et al.NDM-2 carbapenemase in Acinetobacter baumannii from Egypt[J].Journal of Antimicrobial Chemotherapy,2011,66(6):1260-1262.
[13]O'Flaherty S,Ross RP,Edwards R,et al.Potential of the polyvalent anti-Staphylococcus bacteriophage K for control of antibiotic-resistant staphylococci from hospitals[J].Applied and Environmental Microbiology,2005,71(4):1836-1842.
[14]Lanq LH.FDA approves use of bacteriophages to be added to meat and poultry products[J].Gastroenterology,2006,131(5):1370.
[15]Wright A,Hawkins CH,Anggad EE,et al.A controlled clinical trial of a therapeutic bacteriophages preparation in chronic otittis due to antibiotic-resistant Pseudomonas aeruginosa;a preliminary report of efficacy[J].Clinical Otolaryngology,2009,34(4):349-357.
[16]Yang H,Liang L,Lin S,et al.Isolation and characterization of a virulent bacteriophage AB 1 of Acinetobacter baumannii[J].BMC Microbiology,2010,10(4):131-141.
[17]Lin NT,Chiou PY,Chang LK,et al.Isolation and characterization of ФAB2:a novel bacteriophage of Acinetobacter baumannii[J].Research in Microbiology,2010,161(4):308-314.
[18]马翔宇,熊鸿燕,朱才众,等.新型多价大肠埃希菌噬菌体285P生物学特性研究[J].微生物学杂志,2008,28(5):12-15.