蛋氨酸脑啡肽单独或联合IL-2、IFN-γ对小鼠CD4+T细胞作用的研究
夏燕杰,孙立群,李荣辉,单风平
(1.牡丹江医学院红旗医院检验科,黑龙江牡丹江 157000;2.中国医科大学基础医学院免疫教研室,辽宁沈阳 110001)
蛋氨酸脑啡肽(Methionine Enkephalin,MENK),是由肾上腺产生的前激素和前脑啡肽衍生而来,是一种由5个氨基酸残基组成的内源性阿片肽[1]。近年来研究表明,MENK不但具有神经内分泌免疫系统调节活性等多种生理功能,也是一类重要的细胞因子,阿片肽与细胞表面不同的受体结合后可以产生不同的生物学效应。蛋氨酸脑啡肽受体又称阿片生长因子受体(Opioid growth factor receptor,OGFr),经典 OGFr受体可分为 μ(mu)、δ(delta)、κ(kappa)等几种亚型[2]。机体免疫细胞表面广泛存在着这些受体,如T淋巴细胞,巨噬细胞等。MENK通过与这些受体的相互作用而起到免疫调节作用,包括增加免疫系统T淋巴细胞、NK细胞、巨噬细胞活性,增加细胞因子 IL-2、γ-干扰素释放等[3],MENK 还抑制肿瘤细胞生长。在过去的研究中,证明了MENK单独或与其他细胞因子(IFN-γ或IL-2)联合应用能增强机体免疫细胞的功能,但是作用机制尚不清楚,特别是对CD4+T细胞的作用机理,经MENK刺激后CD4+T细胞数量和活性的变化,细胞因子产生情况,至今未见报道。CD4+T细胞是体内特异性细胞免疫的重要细胞亚群,本实验通过体内外MENK 单独或联合 IL-2、IFN-γ 对 C57BL/6小鼠CD4+T细胞数量,CD4+T细胞mRNA表达量以及细胞因子产生量的变化,来阐明MENK对CD4+T细胞的免疫效应,为MENK的潜在临床应用提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄健康♀C57BL/6小鼠,购自上海斯莱克实验动物有限责任公司,SPF级。
1.1.2 试剂 蛋氨酸脑啡肽样品(Penta Biotech Inc.公司,美国);Recombinant Murine IL-2,Recombinant Murine IFN-γ(PEPROTECH,英国);RTPCR试剂盒,琼脂糖(TaKaRa公司,日本);Trizol试剂(Invitrogen公司,美国);CD4+T细胞分选试剂盒,FITC-CD4 流式抗体(B.D.公司,美国)。
1.2 方法
1.2.1 体内实验动物分组及腹腔注射 C57BL/6小鼠,18~20 g,雌性,随机分为7组,每组5只,分别为对照组(生理盐水)、MENK(20 mg/kg)、IL-2(104U/kg)、IFN-γ(105U/kg)、MENK+IL-2组(20 mg/kg+104U/kg)、MENK+IFN-γ 组(20 mg/kg+105U/kg)和 MENK+NX[3](20 mg/kg+10 mg/kg)。腹腔注射,每24 h给药1次,连续给药7 d。给药剂量依据:在预实验中发现,当按上述剂量给药时,小鼠开始出现明显的免疫反应(以脾脏T淋巴细胞的增殖反应作为考察指标)。颈椎脱位处死小鼠进行半定量RT-PCR、流式细胞术、ELISA等相关检测。
1.2.2 体外CD4+T细胞培养与处理 每批标本需要2~3只小鼠,颈椎脱位处死75%的乙醇中浸泡1~2 min,无菌取出小鼠脾脏,用10%FBSRPMI 1640培养液制成细胞悬液,1 000 g离心10 min,用红细胞裂解液裂解红细胞,RPMI 1640洗涤2次,以含10%FBS-RPMI 1640调整细胞终浓度为107个/mL。一部分随机进行如下分组:空白对照组(不加处理因素),实验组MENK(10-12mol/L)、IL-2(200 U/mL)、IFN-γ(500 U/mL)、MENK+IL-2(10-12mol/L+200 U/mL)、MENK+IFN-γ(10-12mol/L+500 U/mL)和 MENK+NX[4](10-12mol/L+50 ng/L)。每组设3个复孔于24孔板,37℃、5%CO2孵箱培养48 h后,流式细胞术检测CD4+T数量;一部分磁珠负选试剂盒分离纯化CD4+T细胞,流式细胞术检测CD4+T细胞纯度>89%。计数纯化后的 CD4+T细胞,用10%FBS-RPMI 1640悬浮细胞沉淀于24孔板,调整细胞数为3×106个/mL,经 PHA(终浓度20 μg/mL)进行常规刺激48 h后随机进行如下分组:空白对照组(不加处理因素),实验组MENK(10-12mol/L)、IL-2(200 U/mL)、IFN-γ(500 U/mL)、MENK+IL-2(10-12mol/L+200 U/mL)、MENK+IFN-γ (10-12mol/L+500 U/mL)和MENK+NX[4](10-12mol/L+50 ng/L)。每组设3个复孔,于37℃、5%CO2孵箱继续培养。刺激48 h后收集上清冻存于-70℃,用于ELISA检测IL-2、IFN-γ 含量;细胞沉淀计数后冻存于 Trizol中,用于提取RNA,RT-PCR半定量检测。
1.2.3 流式细胞术检测CD4+T细胞数量 体内处理组小鼠颈椎脱位处死,浸入75%的乙醇中浸泡1 ~2 min,无菌取出小鼠脾脏,用 10%FBS-RPMI 1640培养液制成细胞悬液,1 000 g离心10 min,用红细胞裂解液裂解红细胞,RPMI 1640洗涤2次。以含10%FBS-RPMI 1640调整细胞终浓度为107个/mL。取0.1ml细胞悬液至流式管中,106个细胞加1 μL FITC标记的CD4抗体,涡旋振荡10 s,4 ℃避光30 min。2%FBS-PBS 洗液洗涤2次,1 000 r/min,离心10 min,弃上清,向细胞沉淀中加 2%FBS-PBS 0.5 mL,上机检测。
1.2.4 半定量 RT-PCR CD4+T细胞沉淀中加入Trizol试剂,按说明书提取RNA,所提RNA于紫外分光光度计下检测其纯度(OD260nm/OD280nm=1.8~2.0)并进行定量。根据GenBank中公布的基因序列,用Primer5.0软件设计PCR特异性引物。引物序列如下:
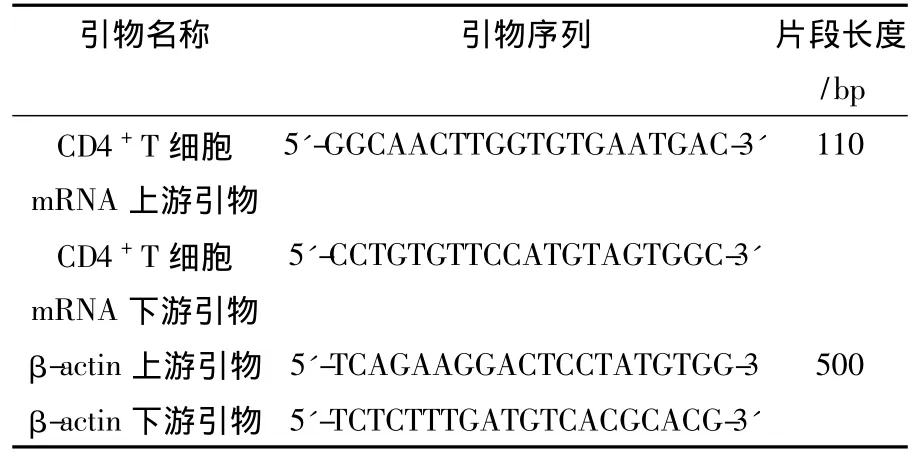
引物名称 引物序列 片段长度/bp CD4+T细胞5'-GGCAACTTGGTGTGAATGAC-3' 110 mRNA上游引物CD4+T 细胞 5'-CCTGTGTTCCATGTAGTGGC-3'mRNA下游引物β-actin 上游引物 5'-TCAGAAGGACTCCTATGTGG-3 500 β-actin 下游引物5'-TCTCTTTGATGTCACGCACG-3'
按TaKaRa反转录试剂盒将RNA转为cDNA后-20℃贮存备用。PCR扩增产物在1%琼脂糖凝胶上电泳,以β-actin作为内参,以靶基因/βactin灰度比值作为mRNA的相对表达丰度进行半定量检测。
1.2.5 ELISA 法检测 CD4+T 细胞上清中 IL-2、IFN-γ水平 用双抗体夹心法酶联免疫吸附试验检测细胞培养液上清中IL-2、IFN-γ的含量,试验按照购买的ELISA试剂盒的步骤来操作。反应终止后用酶标仪检测450 nm吸光度值,再根据标准曲线确定所测细胞因子的浓度。应用SoftMax Pro4.3.1 LS软件分析,绘制标准曲线,计算细胞因子含量(pg/mL)。
1.2.6 统计学方法 采用SPSS17.0软件包进行统计学分析,实验结果以±s表示,组间比较采用单因素方差分析,P<0.05为差异显著。用Excel软件对所获得数据进行分析、处理图表。
2 结果与分析
2.1 流式细胞术检测CD4+T细胞数量结果
体内外MENK组小鼠脾CD4+T细胞的数量与对照组相比,差异具有统计学意义(P<0.05);体内组 MENK 联合 IL-2、IFN-γ 与 MENK 单独作用时比CD4+T细胞的数量差异具有统计学意义(P <0.05);体外组 MENK 联合 IL-2、IFN-γ 与MENK单独作用时比CD4+T细胞的数量差异无统计学意义(P>0.05);体内外纳洛酮封闭组CD4+T细胞数量与MENK相比差异具有统计学意义(P <0.05),见图1。

图1 体内外实验组小鼠脾CD4+T细胞数量Fig.1 The percent of CD4+T cells in splenocyte of mice
2.2 体内外实验组小鼠脾CD4+T细胞mRNA水平表达
体内外实验组小鼠脾CD4+T细胞mRNA的表达,各组与对照组相比,差异具有统计学意义(P <0.05);体内 MENK+IL-2 组、MENK+IFN-γ组与MENK组相比,CD4+T细胞mRNA的表达量差异具有统计学意义(P<0.05);体外MENK+IL-2 组、MENK+IFN-γ 组与 MENK 组相比,CD4+T细胞mRNA的表达量差异无统计学意义(P>0.05);纳洛酮封闭组CD4+T细胞mRNA表达量与MENK相比差异具有统计学意义(P<0.05),见图2。

图2 体内外实验组小鼠脾细胞CD4+T细胞RT-PCR扩增结果Fig.2 RT-PCR confirmation of mRNA expression of CD4+T cell in murine splenocytes
2.3 ELISA检测CD4+T细胞上清液中IFN-γ的分泌水平
体内外不同药物处理组作用48 h后CD4+T细胞上清液中IFN-γ的分泌水平见图3,MENK组与对照组相比差异具有统计学意义(P<0.05)。体内实验中,MENK+IL-2组与MENK组相比差异具有统计学意义(P<0.05);体外实验中,MENK+IL-2组与MENK组相比差异无统计学意义(P>0.05)。纳洛酮组与MENK组比IFN-γ水平差异具有统计学意义(P<0.05),显示MENK作用可以被纳洛酮阻断。
2.4 ELISA检测CD4+T细胞上清液中IL-2的分泌水平
体内外不同药物处理组作用48 h后CD4+T细胞上清液中IL-2的分泌水平结果见图4。各实验组与对照组相比差异具有统计学意义(P<0.05);体内实验中,MENK+IFN-γ 组与 MENK组相比差异具有统计学意义(P<0.05);体外实验中,MENK+IFN-γ组与MENK组相比差异无统计学意义(P>0.05)。纳洛酮封闭组与MENK组比IL-2水平差异具有统计学意义(P<0.05),显示MENK作用可以被纳洛酮阻断。

图3 体内外不同实验组小鼠IFN-γ分泌水平检测结果Fig.3 IFN-γproduction post treatment in vitro and in vitro

图4 体内外不同实验组小鼠IL-2分泌水平检测结果Fig.4 IL-2 production post treatment in vitro and in vitro
3 讨论
MENK是一种内源性阿片肽,大量的实验已经表明MENK对机体多种细胞功能有调节作用,近年来MENK已经被认为是一种新型细胞因子,现已人工合成。机体免疫细胞表面广泛存在着阿片受体,MENK通过与这些受体的相互作用而起到免疫调节作用。MENK主要与表达上述受体的免疫细胞结合后,可双向调控胞内cAMP、钙离子、蛋白激酶K以及蛋白激酶A的水平,通过影响第二信号通路而发挥免疫调节效应。特别是当机体受到感染时,这种免疫调节作用更加明显。与MENK结合的该种受体也被发现表达在肿瘤细胞上,表现对肿瘤的生长有抑制作用[4-7]。
IL-2是免疫调节中起重要作用的T细胞因子,有多种生物学功能。它能激活多种免疫细胞,特别是诱导T淋巴细胞增殖,发挥免疫效应;同时能促进MØ和NK细胞等的增殖,还具有诱生分泌多种细胞因子等免疫活性物质。通过复杂的免疫调节使机体表现出抗肿瘤、抗感染、改善免疫功能和状态等。另外,有研究发现,MENK能促进人 T 细胞 IL-2 分泌和 IL-2 受体表达[8]。
IFN-γ是一种具有免疫调节作用的干扰素,主要由活化的Th细胞和NK细胞产生。其生物学功能主要是免疫调节,诱导多种抗原提呈细胞表达MHC-Ⅰ/Ⅱ类分子,活化单核-巨噬细胞、中性粒细胞、NK细胞,促进Th1细胞发育和抑制Th2细胞活化与增殖,刺激B细胞产生的抗体类型向调理素方向转变。此外,IFN-γ可以激活机体的免疫细胞,如T淋巴细胞、NK细胞和巨噬细胞等杀死肿瘤细胞。
Elka Gabrilovac等[9]研究表明,MENK 可诱导小鼠T细胞的增殖能力。Foris等证实低剂量(10-9~10-12mol/L)MENK 可以增强 ADCC 作用,而高剂量 MENK(10-5~10-6mol/L)可以抑制ADCC作用[10]。本实验用低剂量MENK单独或联合 IL-2、IFN-γ 对 C57BL/6 小鼠进行体内外刺激,实验中CD4+T细胞的数量与CD4分子mRNA表达量及细胞因子的分泌量一致,体内MENK单独或联合 IL-2、IFN-γ 不仅能增加小鼠脾CD4+T细胞的数量及CD4分子mRNA表达量,并且能促进细胞因子 IL-2、IFN-γ 的分泌。MENK对CD4+T细胞免疫效应的上调作用不仅是直接增加其数量,同时也可能通过增加其表面阿片受体的含量来间接调节。体内外加入纳洛酮封闭组,CD4+T细胞数量及细胞因子含量与MENK组相比明显减少,说明MENK的这种作用可被纳洛酮完全阻断。另外,本研究中在体内组MENK联合IL-2或IFN-γ对CD4+T细胞作用比单独作用时显著增强,而体外组当MENK联合IL-2或IFN-γ对CD4+T细胞作用时无明显增强,体内外并未得到完全相同的结果,说明在体内MENK联合IL-2或IFN-γ对CD4+T细胞有协同作用,同时表明体内环境因素可能对MENK作用于CD4+T细胞起到影响作用。体内环境下免疫系统甚至包括内分泌系统形成的调节网络,MENK除了作用于CD4+T细胞之外,还同时作用于其他免疫细胞如NK、CD8+T、中性粒细胞、巨噬细胞等,这些细胞激活后都能释放大量细胞因子,如 IL-12、IL-2、IL-6、IFN-γ。IFN-γ 可激活巨噬细胞从而具有更强的提呈抗原和激活CD4+T细胞的能力有关,从而对CD4+T细胞形成综合调节。本研究不仅为进一步研究MENK在免疫调节方面的影响提供重要的理论依据,而且为今后研究MENK在免疫细胞的作用机制提供适宜的研究模型,为临床应用MENK治疗肿瘤和感染性疾病提供了部分实验依据。
[1] 倪鑫,林葆,路长林.神经肽基础与临床(第2版)[M].上海:第二军医大学出版社,2000,104-105.
[2] Cahill CM,Melellan KA,Morinville A,et al.Immunohistochemical distribution of opioid receptor in the rat central nervous system:evidence for sonatodendritic labeling and antigenspecific cellular compartmentalization[J].Comp.Neurol,2001,44(9):65-84.
[3] Kowalski J,Makowskiecka K,Belowski D,et al.Augmenting effect of methionine enkephalin on interleukin-6 pro-duction by cytokine-stimulated murine macrophages[J].Ne-ropeptides,2000,34(3):187-192.
[4] 章旭,夏燕杰,王宁,等.细胞生物活性肽-蛋氨酸脑啡肽对小鼠CD4+T细胞mRNA的影响[J].微生物学杂志,2010,30(1):106-109.
[5] Martin-Kleier I.Augmenting effect of methioine-enkephalin Interleukin-6 production by cytokine-stimulated murine macrophages[J].Neuro peptides,2000,34(3-4):187-192.
[6] Plotnikoff NP.Methionine Enkephalin:a new cytokine-human studies[J].Clin Immunol Immunopathol,1997,82(2):93-101.
[7] Burger RA.Effect of methionine enkephalin on natural killer cell and cytotoxic T lymphocyte activity in mice infected with influenza A virus[J].Immunopathocol Immunotoxicol,2005,17(2):323-324.
[8] Plotnikoff NP,Miller GC,Solomon SKT,et al.Methionine enkephalin:Imphonuclear munomodulatory in normal volunteers[J].Psychopharmacol.Bull,1986,22(4):1097-1100.
[9] Elka Gabrilovac,Tanja Marotti.Gender-related differences in murine T-and B-lymphocyte proliferative ability in response to in vivo Met5-enkephalin administration[J].European Journal of Pharmacology,2010,39(2):101-110.
[10]Fengping Shan,Yanjie Xia.Functional modulation of the pathway between dendritic cells(DCs)and CD4+T cell by the neuropeptide:Methionine enkephalin(MENK)[J].Peptides,2011,5(32):929-937.