鸭瘟强毒与疫苗毒的囊膜糖蛋白序列比较
姜甜甜,张大丙
(中国农业大学动物医学院 农业部动物流行病学与人畜共患病重点实验室,北京 海淀100193)
鸭瘟(Duck plague)又称为鸭病毒性肠炎(Duck viral enterits,DVE),是鸭、鹅、天鹅等的一种急性、接触传染性疾病,以血管损伤、组织出血、消化道黏膜糜烂、淋巴器官受损和实质器官退行性病变为主要特征[1]。人们习惯将本病病原称为鸭瘟病毒(Duck plague virus,DPV)或鸭肠炎病毒(Duck enteritis virus,DEV)[1],但国际病毒分类委员会2011年第11次分类报告已将该病原种名改称为鸭疱疹病毒1型(Anatid herpesvirus 1,AnHV1)[2],分类上归属于疱疹病毒科、α-疱疹病毒亚科、马立克氏病毒属(http://ictvonline.org)。AnHV1基因组长约160kb,约含78个 ORF[3-4],在已测序的强毒株和弱毒疫苗株之间,5个ORF(UL2、UL12、US10、UL47和 UL41)表现出明显的序列差异(插入/缺失和碱基置换),提示这5个ORF可能与毒力有关,相对于弱毒疫苗株,强毒株的UL2含有一个528-bp的插入序列[4]。
为有效防制鸭瘟,20世纪60年代国内外研究者即已研制了鸭瘟弱毒疫苗和灭活疫苗并应用于生产实践[1,5],我国使用鸭瘟鸡胚化弱毒疫苗和鸡胚成纤维细胞苗防制本病[6],多年来的实践证明,其效果良好。据文献报道,不同的AnHV1毒株毒力有所不同,但免疫学特性和抗原相关性似乎相同[1]。
2011年8月和10月,某地区免疫过鸭瘟疫苗的14周龄樱桃谷北京鸭后备种鸭群和1个50周龄的樱桃谷北京鸭种鸭群发病,剖检可见食道黏膜纵褶和泄殖腔黏膜有鸭瘟的典型出血病变,其他病变包括心外膜有出血点,脾脏发黑,肠黏膜充血、出血和炎症,肝脏隐约可见不明显的出血斑点,从大体病变判断,颇似鸭瘟。为获得准确诊断结果,并了解免疫鸭群发病是否因AnHV1变异所致,本文采用PCR方法对4份肝脏样品进行了分子检测,在此基础上,比较了1株分离株和3个疫苗株的UL2和糖蛋白编码基因序列,以期为寻找可能的发病原因提供信息。
1 材料与方法
1.1 临床样品 采集4只病(死)鸭的肝脏,加入磷酸盐缓冲液研磨成匀浆,12 000r/min离心10min,取上清,用于PCR检测和病毒分离。
1.2 参考毒株和参考序列 以3个不同生产厂家的鸭瘟鸡胚化弱毒疫苗或鸡胚成纤维细胞苗冻干制品作为AnHV1参考毒株,分别称为A株、B株和C株。用灭菌生理盐水将冻干苗重悬,离心取上清备用。从GenBank下载AnHV1德国强毒株2085株[4]和中国弱毒疫苗株VAC株[3]的基因组序列用于引物设计和序列比较,序列登录号分别为JF999965和EU082088。
1.3 DNA提取 用酚∶氯仿∶异戊醇(25∶24∶1)法提取DNA,用无水乙醇沉淀DNA,随后将DNA溶解于双蒸水。
1.4 临床样品的PCR检测 为检测临床样品是否含鸭瘟病毒,用3株疫苗株作为阳性对照,按文献[7]合成引物P1和P2,经PCR检测 AnHV1的UL6基因,预期扩增长度为416bp。PCR反应体系为25μL,包括12.5μL 2×NI-TaqPCR Master-Mix(加拿大新产业公司)、5μL DNA模板、上下游引物(20μmol/L)各1μL和5.5μL ddH2O。PCR反应条件为:94℃预变性2min,35个循环(94℃50s、54℃90s、72℃ 2min)后,72℃延伸5min。PCR产物用1%琼脂糖凝胶电泳进行检测。
1.5 病毒分离 选1份PCR阳性样品进行病毒分离。将处理获得的上清液经绒毛尿囊膜接种9日龄鸭胚5枚,每胚接种0.2mL,置37℃温箱培养,收获死亡的鸭胚尿囊液、绒毛尿囊膜和胚体,制成匀浆,离心取上清。
1.6 UL2序列的扩增 为了解分离株的分子特性,基于AnHV1 2085株和VAC株的基因组序列设计引物对UL2f/UL2r(表1),扩增 W1株的UL2及其两侧序列,用3株疫苗作为弱毒株对照,W1株和疫苗株的预期扩增长度分别为1 311bp和783 bp。PCR反应体系见1.4,PCR反应条件为:94℃预变性5min,35个循环(94℃30s、58℃30s、72℃1min)后,72℃延伸5min。PCR产物用1%琼脂糖凝胶电泳进行检测。
1.7 糖蛋白编码基因的扩增 为比较W1株与3株疫苗的糖蛋白编码基因序列,基于AnHV1 2085株和VAC株的基因组序列合成13对引物,用于扩增W1株与3株疫苗11个糖蛋白编码基因,因其中5对引物扩增疫苗株的结果为阴性,故另外设计5对引物(表1)。PCR体系见1.4,PCR反应条件为:94℃预变性5min,35个循环(94℃30s、51~60℃30s、72℃2min)后,72℃延伸5min。PCR产物用1%琼脂糖凝胶电泳进行检测。
1.8 测序和序列分析 用胶回收试剂盒(北京全式金生物技术有限公司)回收PCR产物,连接于pGEM-T载体(Promega),转化大肠杆菌 DH5α(北京博迈德生物技术有限公司),鉴定后,由北京擎科公司测序。
用DNAMAN软件进行序列编辑和ORF预测,用BLASTP在GenBank中进行序列相似性检索,用CLUSTALW比较序列同源性。
2 结果
2.1 PCR检测 用引物对P1和P2经PCR检测了4份肝脏组织样品,均扩增出预期长度的条带,从3株弱毒疫苗株亦扩增出预期长度的条带(图1)。测序和序列分析结果显示,4份样品的扩增产物为AnHV1的416bp UL6基因序列,4份样品的UL6序列与AnHV1 2085株对应序列的同源性为100%,与AnHV1VAC株对应序列的同源性为99%。
2.2 病毒分离 用1份病料接种9日龄鸭胚后7 d,有4枚鸭胚死亡,胚体出血(图2),收获接种后72 h死亡的鸭胚,将分离株称为W1株。
2.3 UL2序列分析 用引物对UL2F和UL2R经PCR从W1株和3株疫苗中均扩增出预期长度的条带,如图3所示,W1株的扩增产物长度为1 311 bp,该序列与AnHV1 2085株基因组对应区域的核苷酸序列同源性为100%;而3株疫苗的产物长度均为783bp,与AnHV1弱毒疫苗株VAC株基因组对应区域之间的核苷酸序列同源性皆为99%。
去掉扩增产物5′端的157bp序列(79bp UL3和78bp的非编码区),获得 W1株792bp UL2(1~792位)、70bp非编码区(793~862位)和292bp UL1(863~1154位)序列以及3株疫苗株的348bp UL2(1~348位)和292bp UL1(335~626位)序列。由此可见,W1株和德国强毒株2085株的UL2与UL1之间均存在一个长度为70bp的非编码区,而所测3株疫苗株与文献报道的疫苗VAC株相同,即UL2基因与其下游的UL1基因重叠14个碱基。

表1 扩增AnHV1UL2和糖蛋白编码基因所用引物
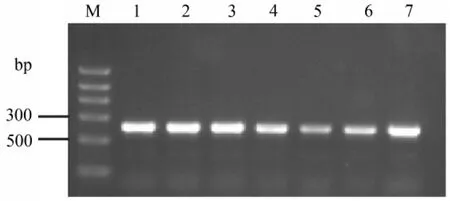
图1 AnHV1临床样品的PCR检测
序列比对结果显示,在该区域,W1株和德国强毒株2085株均比3株疫苗株长528bp;疫苗株所缺失的部分对应于 W1株UL2的3′部分(282~792位)和UL2~UL1非编码区的5′端(793~809位)。
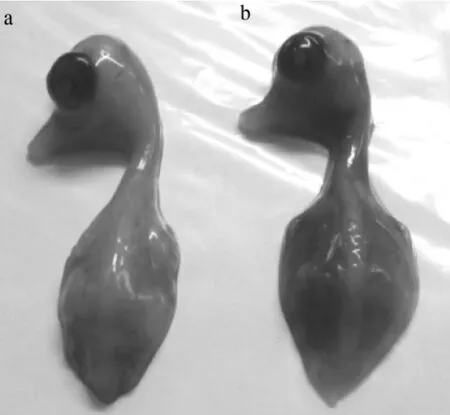
图2 ANHV1感染的11日龄死亡鸭胚
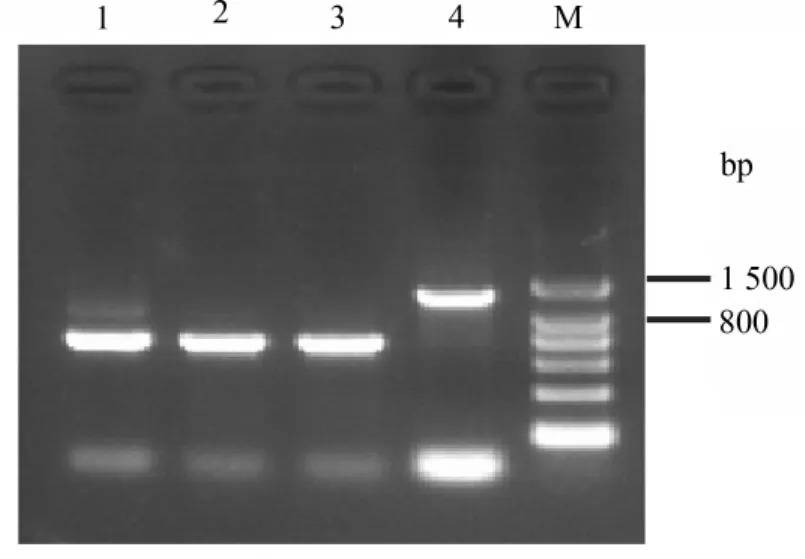
图3 UL2序列的PCR扩增
2.4 糖蛋白序列分析 序列分析结果表明,分离株W1株与疫苗株A株、B株和C株之间gB、gC、gD、gG、gH、gM、gN和gL蛋白的氨基酸序列完全相同,而gE、gI、gK的氨基酸序列同源性为99%(表2);W1与3株疫苗株之间gE、gI和gK蛋白分别存在2个(T48I、S451P)、3个(I168N、S301R、G338D)和1个(V84A)氨基酸置换。
W1株与文献报道的弱毒疫苗株(VAC株)之间糖蛋白gB、gC、gD、gG、gH 和gN的氨基酸序列同源性为100%,gE、gK、gL和gM的氨基酸序列同源性为99%株(Vac株和其他毒株的gI蛋白存在长度差异)(表2);W1株与 VAC株之间gE、gK、gL和gM 蛋白分别存在2个 (T48I、S451P)、1个(V84A)、1个(G231V)和1个(V170I)氨基酸置换。
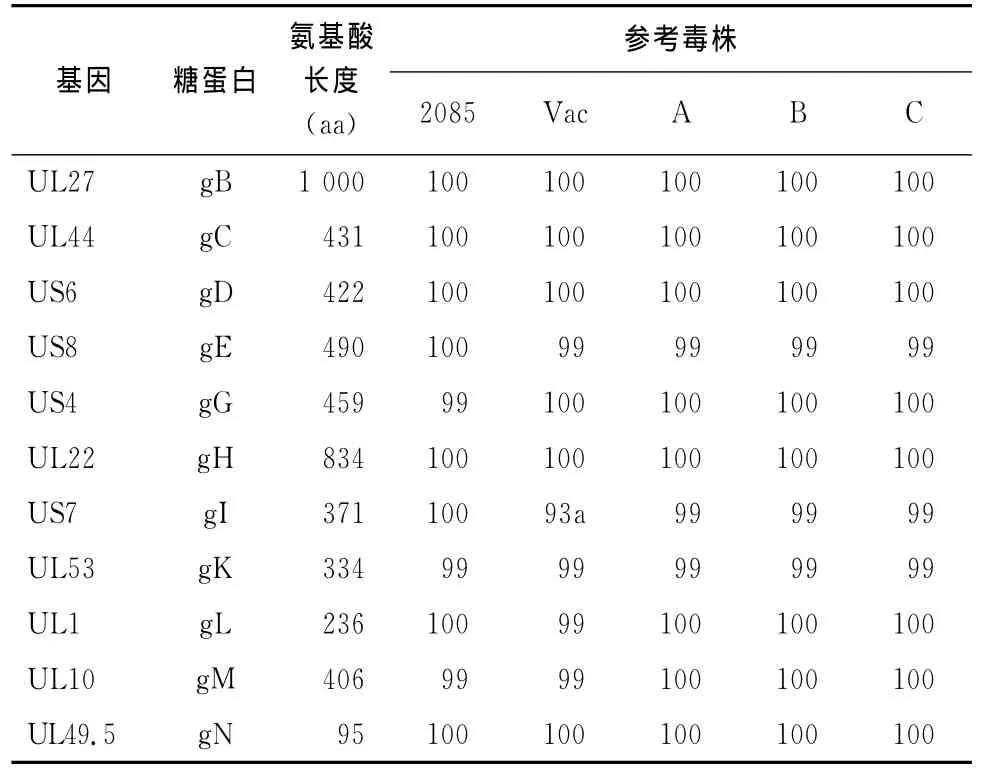
表2 W1株与参考毒株11个糖蛋白的氨基酸序列同源性 (%)
分离株W1株与德国强毒株8025株之间gB、gC、gD、gE、gH、gI、gL和gN蛋白的氨基酸序列完全相同,gG、gK和gM蛋白的氨基酸序列同源性为99%(表2)。分离株 W1株与德国强毒株8025株之间gG、gK和gM蛋白分别存在1个(C14R)、1个(V84A)和2个氨基酸(L23S和H126R)的置换。
3 讨论
本次的病例具有鸭瘟的部分典型病变,如食道黏膜纵褶条带状出血和泄殖腔黏膜环状出血,但还缺乏鸭瘟的其他一些特征性病变,如腺胃和肌胃交界处的灰黄色坏死带或出血带、肝脏出血或坏死病变以及肠道的环状出血带等[1],出现这种相对不典型的病变可能与进行过疫苗免疫有关。用PCR可从4份临床样品中检出AnHV1的特异性UL6序列,表明临床样品中含有AnHV1;相对于弱毒疫苗株,分离株W1株的UL2含有一个528-bp的插入序列,符合AnHV1强毒株的分子特征[4]。据此可做出诊断,即本次发病与AnHV1感染有关。
我国生产的鸭瘟疫苗具有良好的免疫效果,在防控鸭瘟的过程中曾发挥了至关重要的作用。一般认为,不同的AnHV1毒株毒力不同,但具有共同的免疫学特性[1]。然而,近年来,我国养鸭生产中不时出现免疫过鸭瘟弱毒疫苗的鸭群仍发生鸭瘟的现象,本研究涉及的两个鸭群即是如此,是否存在An-HV1流行毒株抗原性变异的情况也是需要考虑的因素。用疫苗进行免疫攻毒试验或用中和试验比较野毒与疫苗毒之间的血清学相关性无疑有助于了解免疫鸭群发生鸭瘟的原因所在,但免疫攻毒试验存在生物安全问题,而中和试验则需制备相应的抗血清。由于疱疹病毒的囊膜糖蛋白是宿主免疫系统识别的主要抗原[8],因此,测定并比较野外分离株与弱毒疫苗株的囊膜糖蛋白序列亦可提供有用的线索。
研究结果表明,AnHV1共编码11种囊膜糖蛋白,即 gB、gC、gD、gE、gG、gH、gI、gK、gL、gM 和gN[3-4]。测序和序列分析显示,W1株与弱毒疫苗株A株、B株和C株之间共有8个囊膜糖蛋白(gB、gC、gD、gG、gH、gM、gN和gL)的氨基酸序列完全相同,另外3个囊膜糖蛋白(gE、gI和gK)的氨基酸序列同源性为99%,这一结果说明,相对于我国养鸭生产中常用的弱毒疫苗株,分离株W1株的囊膜糖蛋白序列未发生明显的变异。比较W1株和德国强毒株2085株[4]以及文献报道的弱毒疫苗株[3]之间的囊膜糖蛋白序列,亦可看出,不同AnHV1毒株的囊膜糖蛋白序列具有高度的保守性。
对伪狂犬病病毒、马立克氏病病毒和单纯疱疹病毒的研究表明,gB、gD和gC蛋白可诱导机体产生保护性中和抗体,单纯疱疹病毒的gC蛋白还可诱导宿主产生细胞免疫反应[9-13]。因此,根据 W1株与弱毒疫苗株(A株、B株、C株以及VAC株)之间gB、gC和gD等糖蛋白的氨基酸序列同源性为100%的结果,可以初步认为,本次鸭瘟的发生与病原的变异无关。开展更多毒株的监测分析工作将有利于阐明免疫鸭群的发病原因,而做好鸭瘟疫苗的生产、运输和保存工作并合理使用鸭瘟疫苗对于发挥鸭瘟疫苗的免疫效果至关重要。
[1] Saif Y M.禽病学[M].11版.高福,苏敬良,索勋,译.北京:中国农业出版社,2004:520-528.
[2] Davison A J,Eberle R,Ehlers B,etal.The order Herpesvirales.Archives of Virology[J].2009,154:171-177.
[3] Li Y,Huang B,Ma X,etal.Molecular characterization of the genome of duck enteritis virus[J].Virology,2009,391,151-161.
[4] Wang J,Höper D,Beer M,etal.Complete genome sequence of virulent duck enteritis virus(DEV)strain 2085and comparison with genome sequences of virulent and attenuated DEV strains[J].Virus Research,2011,160,316-325.
[5] 黄引贤,欧守杼,邝荣禄,等.鸭瘟病毒的研究 [J].华南农学院学报,1980,1,21-36.
[6] 中国兽药典委员会.中华人民共和国兽药典[M].2005年版.三部.北京:中国农业出版社,2006.
[7] Plummer P J,Alefantis T,Kaplan S,etal.Detection of duck enteritis virus by polymerase chain reaction[J].Avian Diseases,1998,42,554-564.
[8] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1051-1066.
[9] Brockmeier S L,Lager K M,Tartaglia J,etal.Vaccination of pigs against pseudorabies with highly attenuated vaccinia(NYVAC)recombinant viruses [J].Veterinary Microbiology,1993,38,41-58.
[10]Riviere M,Tartaglia J,Perkus M E,etal.Protection of mice and swine from pseudorabies virus conferred by vaccinia virusbased recombinants[J].Journal of Virology,1992,66,3424-3434.
[11]Nazarian K,Lee L F,Yanagida N,etal.Protection against Marek's disease by a fowlpox virus recombinant expressing the glycoprotein B of Marek′s disease virus[J].Journal of Virology,1992,66,1409-1413.
[12]NauwynekK H J.Functional aspects of Aujeszky′s disease(pseudorabies)viral proteins with relation to invasion,virulence and immunogenicity[J].Veterinary Microbiology,1997,55,3-11.
[13]Mettenleiter T C.Immunobiology of pseudorabies(Aujeszky′s Disease)[J].Veterinary Immunology and Immunopathology,1996,54,221-229.

