加味四逆散对身心应激模型大鼠胃肠功能及胃组织中GASR和空肠组织中VIPR2mRNA表达的影响
谢慧臣,刘 芬,杨 强,熊常初,田春曼
(湖北民族学院医学院中医教研室,湖北 恩施 445000)
随着人们生活节奏越来越快,各种社会问题不断出现,应激性心理、生理反应因人们心理情感上的种种变化而不断积累,导致各种身心疾病的发生,其中与胃肠道疾病的发生发展关系尤为密切[1],而应激致病和中医病因学中的情志所伤内在涵义是一致的。文献[2]报道:中医疏肝理气法的治病机理与该方法对胃肠激素水平施加了有益的影响有关,而胃肠激素的作用效果又与表达受体的数目关系密切,即受体水平的高低可很好地反映该激素的作用强度,但目前有关身心应激致胃动力障碍、神经内分泌改变的文献报道尚不多见。加味四逆散(Jiaweisinisan,JWSNS)来源于中医疏肝理气法之经典方四逆散,前期大量临床观察[3-4]及实验研究已证明其有调节患者胃肠功能和修复应激模型大鼠受损胃黏膜及改善黏膜下血流量的作用。本文作者从实验角度进一步探索该方对慢性身心应激模型大鼠胃肠激素受体表达和胃肠动力及下丘脑-垂体-肾上腺(HPA)轴的影响,以期从脑肠肽受体角度探讨JWSNS调治身心应激相关性胃肠疾病的作用机制。
1 材料与方法
1.1 实验动物及分组雄性清洁级健康Wistar大鼠60只,10~12周龄,体质量为(200±20)g,购于湖北中医药大学动物实验中心,动物使用许可证号:SRST(鄂)20110018。大鼠平衡喂养1周后随机分为正常组,模型组,西沙比利组和小、中、大剂量JWSNS组,每组均为10只。
1.2 药物、试剂及实验仪器 JWSNS(柴胡8g、枳实15g、白芍15g、郁金6g、白芨6g、砂仁12g、炙甘草6g)购于湖北中医药大学附属医院中药房,按标准方法制成水剂(含生药1g·mL-1),4℃保存。西沙比利片(5mg/片),山东齐鲁药业有限公司生产,批号:110603,蒸馏水配制药液(浓度0.4g·L-1)。半固体营养糊配制参考文献[5]:蒸馏水100mL配羟甲基纤维素6g、糖5g、碳素墨水3mL、奶粉9g、淀粉5g,充分搅拌成糊状,4℃保存。cAMP、cGMP药盒,南京建成生物有限公司生产,批号:101120。GASR mRNA、VIPR2mRNA实时荧光定量PCR试剂盒、引物(Invitrogen Biotechnology Co.,LTD中国公司),PCR引物序列、产物长度和退火温度见表1。SLAN荧光定量PCR检测系统(上海宏石医疗科技有限公司);SN-695型放免γ计数器(上海日环光电仪器有限公司)。
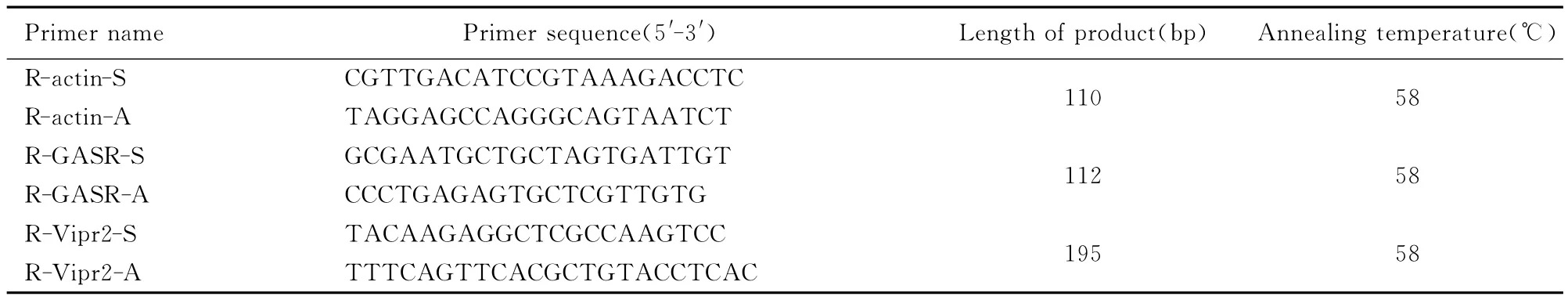
表1 PCR引物序列、产物长度和退火温度Tab.1 Primer sequences of PCR,length of products and annealing temperature
1.3 模型制备 按文献[6]取10种不可预知因素刺激大鼠。①潮湿垫料加倾斜饲养:鼠笼倾斜30°,持续24h。②热水泳:受试大鼠于水温48℃、水深35cm热水中放置10min。③禁食24h。④电击:电流0.1mA,每分钟3次,刺激15min。⑤行为束缚2h。⑥陌生物品:随机选择发声的收音机、铁丝网等,放入鼠笼24h。⑦昼夜交替:白昼以黑布罩着鼠笼持续12h,天黑后拿掉并用白炽灯持续照射12h。⑧陌生气味:医用棉花蘸取冰醋酸放入玻璃瓶,瓶口开放,放入鼠笼24h。⑨冰水泳:受试大鼠于水温4℃、水深35cm冰水中放置10min。⑩禁水24h。每日随机取1种,相邻2d不重复;持续4周。
1.4 配制剂量与给药方法 小、中、大剂量JWSNS组及西沙比利组大鼠每日用药浓度按等效临床剂量和体表面积公式计算分别设定为0.25、0.50、1.00g·mL-1和0.40g·L-1,以上药物均用蒸馏水配制,每日将配置好的中药煎剂和西沙比利混悬液2mL灌胃大鼠。空白组及模型组大鼠用生理盐水2mL灌胃,均为每日1次,从造模第3周开始灌胃,共2周。
1.5 检测下丘脑中cAMP和cGMP含量 大鼠最后一次给药后禁食不禁水,24h后灌胃半固体糊,记录灌胃总质量,30min后脱颈椎处死大鼠剥离下丘脑,放射免疫法检测下丘脑中cAMP和cGMP含量。
1.6 测定胃排空率和小肠推进比 取大鼠胃及小肠组织,直尺测量小肠总长及肠内糊状物推进距离,小肠推进比为肠内糊状物推进距离/小肠总长×100%。称量全胃,蒸馏水洗净胃内容物,蘸干后再称质量,胃排空率=[1-(第1次称重-第2次称重)/半固体糊总灌胃量]×100%[5]。
1.7 检测GASR mRNA和VIPR2mRNA相对表达量 胃窦及空肠区取适量组织,RT-PCR法测定胃组织中GASR和空肠组织中VIPR2mRNA的表达并定量分析。PCR反应体系为:2×qPCR Mix 12.5μL,2.5μmol·L-1基因引物2.0μL,反转录产物2.0μL。具体操作按试剂盒说明书进行。结果处理:ΔΔCT法:A=CT(目的基因,待测样本)-CT(内标基因,待测样本);B=CT(目的基因,对照样本)-CT(内标基因,对照样本);K=A-B,胃组织中GASR和空肠组织中VIPR2 mRNA的相对表达量以表达倍数2-K表示。
1.8 统计学分析 采用SPSS 17.0统计软件对数据进行分析处理,大鼠下丘脑中cAMP和cGMP含量、胃排空率、小肠推进比以及胃肠GASR mRNA和VIPR2mRNA相对表达量均以表示,组间比较均采用单因素方差分析。
2 结 果
2.1 JWSNS作用下模型大鼠下丘脑中cAMP和cGMP含量变化 与正常组比较,模型组大鼠下丘脑中cAMP和cGMP含量明显升高(P<0.01);与模型组比较,JWSNS各治疗组大鼠下丘脑中cAMP和cGMP含量明显降低(P<0.05或P<0.01);与西沙比利组比较,大剂量JWSNS组cAMP和cGMP含量明显降低(P<0.05或P<0.01);与小剂量JWSNS组比较,中和大剂量JWSNS组cAMP和cGMP含量均明显降低(P<0.05或P<0.01)。见表2。
2.2 JWSNS作用下模型大鼠胃排空率和小肠推进比变化 与正常组比较,模型组大鼠胃排空率和小肠推进比明显降低(P<0.01);与模型组比较,各治疗组大鼠胃排空率均明显升高(P<0.05或P<0.01);与西沙比利组比较,大剂量JWSNS组胃排空率变化不明显(P>0.05);与小剂量JWSNS组比较,中和大剂量JWSNS组大鼠胃排空率明显升高(P<0.05或P<0.01)。与模型组比较,各治疗组大鼠小肠推进比均显著升高(P<0.01);与西沙比利组比较,大剂量JWSNS组大鼠小肠推进比明显升高(P<0.05),而小和中剂量JWSNS组差异不明显(P>0.05);与小剂量JWSNS组比较,中和大剂量JWSNS组大鼠小肠推进比明显升高(P<0.05或P<0.01)。见表3。
表2 JWSNS作用下模型大鼠下丘脑cAMP和cGMP含量Tab.2 The contents of hypothalamus cAMP and CGMP in model rats after treated with JWSNS[n=10,,mB/(μmol·g-1)]
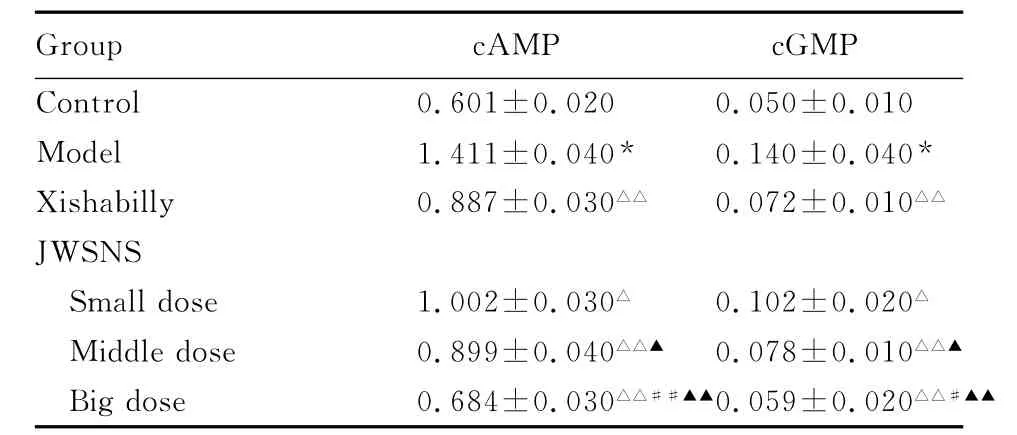
表2 JWSNS作用下模型大鼠下丘脑cAMP和cGMP含量Tab.2 The contents of hypothalamus cAMP and CGMP in model rats after treated with JWSNS[n=10,,mB/(μmol·g-1)]
*P<0.01 vs control group;△P<0.05,△△P<0.01 vs model group;#P<0.05,##P<0.01 vs Xishabilly group;▲P<0.05,▲▲P<0.01 vs small dose of JWSNS group.
Group cAMP cGMP Control 0.601±0.020 0.050±0.010 Model 1.411±0.040* 0.140±0.040*Xishabilly 0.887±0.030△△ 0.072±0.010△△JWSNS Small dose 1.002±0.030△ 0.102±0.020△Middle dose 0.899±0.040△△▲0.078±0.010△△▲Big dose 0.684±0.030△△##▲▲0.059±0.020△△#▲▲
表3 JWSNS作用下模型大鼠胃排空率和小肠推进比Tab.3 The gastric emptying rates and small intestinal propulsion ratios in model rats after treated with JWSNS(n=10,,η/%)
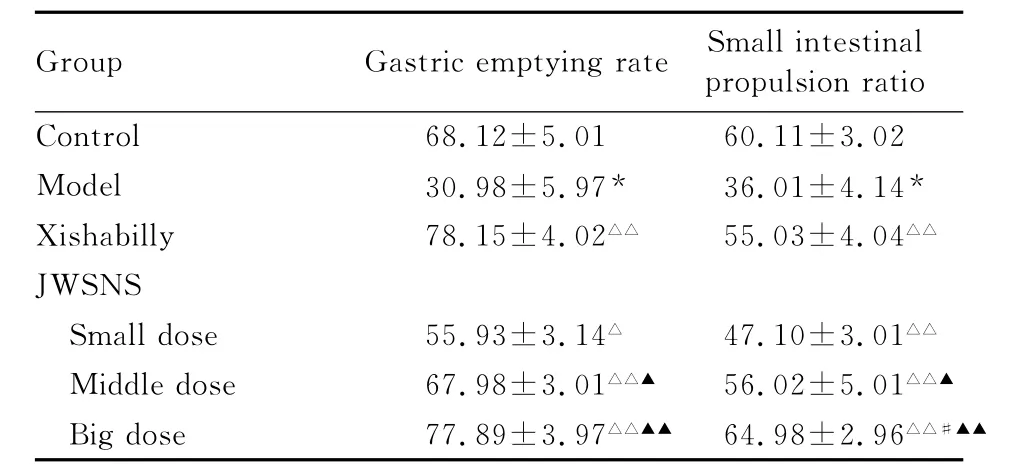
表3 JWSNS作用下模型大鼠胃排空率和小肠推进比Tab.3 The gastric emptying rates and small intestinal propulsion ratios in model rats after treated with JWSNS(n=10,,η/%)
*P<0.01 vs control group;△P<0.05,△△P<0.01 vs model group;#P<0.05,##P<0.01 vs Xishabilly group;▲P<0.05,▲▲P<0.01 vs small dose of JWSNS group.
Group Gastric emptying rateSmall intestinal propulsion ratio Control 68.12±5.01 60.11±3.02 Model 30.98±5.97* 36.01±4.14*Xishabilly 78.15±4.02△△ 55.03±4.04△△JWSNS Small dose 55.93±3.14△ 47.10±3.01△△Middle dose 67.98±3.01△△▲ 56.02±5.01△△▲Big dose 77.89±3.97△△▲▲64.98±2.96△△#▲▲
2.3 JWSNS作用下模型大鼠胃组织中GASR mRNA和空肠组织中VIPR2mRNA相对表达量变化 与正常组比较,模型组大鼠胃组织中GASR mRNA明显降低(P<0.01),空肠组织中VIPR2 mRNA明显升高(P<0.01);与模型组比较,各治疗组大鼠胃组织中GASR mRNA相对表达量明显升 高(P<0.05 或 P<0.01),空 肠组织中VIPR2mRNA相对表达量明显降低(P<0.05或P<0.01);与西沙比利组比较,中和大剂量JWSNS组大鼠胃组织中GASR mRNA相对表达量明 显升高(P<0.05 或 P<0.01),大剂量JWSNS组大鼠空肠组织中VIPR2mRNA相对表达量明显降低(P<0.01);与小剂量JWSNS组大鼠比较,中和大剂量JWSNS组大鼠胃组织中GASR mRNA相对表达量明显升高(P<0.05或P<0.01),空肠组织中VIPR2mRNA相对表达量明显降低(P<0.05或P<0.01)。见表4。
表4 JWSNS作用下模型大鼠胃组织中GASR mRNA和空肠组织中VIPR2mRNA相对表达量Tab.4 The relative expression quantities of GASR mRNA in stomach tissue and VIPR2mRNA in jejunal tissue in model rats after treated with JWSNS (n=10,)

表4 JWSNS作用下模型大鼠胃组织中GASR mRNA和空肠组织中VIPR2mRNA相对表达量Tab.4 The relative expression quantities of GASR mRNA in stomach tissue and VIPR2mRNA in jejunal tissue in model rats after treated with JWSNS (n=10,)
*P<0.01 vs control group;△P<0.05,△△P<0.01 vs model group;#P<0.05,##P<0.01 vs Xishabilly group;▲P<0.05,▲▲P<0.01 vs small dose of JWSNS group.
Group GASR mRNA VIPR2mRNA Control 1.00±0.10 1.00±0.20 Model 0.19±0.05* 3.40±0.57*Xishabilly 0.43±0.03△△ 1.79±0.35△△JWSNS Small dose 0.25±0.02△ 2.39±0.36△Middle dose 0.53±0.03△△#▲ 1.83±0.30△△▲Big dose 0.62±0.05△△##▲▲ 1.15±0.33△△##▲▲
3 讨 论
心理应激引发机体产生的生理学效应包括神经内分泌激活和炎症反应等[7],最常见的是消化性溃疡。而动物应激模型在应激研究领域发挥着越来越重要的作用,对临床药物的筛选和评价,临床疾病的发生、发展机制以及预后评估都有不可替代的作用[8]。有报道[9]指出:可预知应激会造成动物适应应激反应从而影响造模的效果,身心刺激的不可预知性是造模过程中避免动物产生适应性的关键环节。本文作者将多种应激方法通过慢性不可预知的方式随机组合,相邻2d不重复,可更逼真地模拟现实生活中情志因素引发心身疾病的过程,以此制作大鼠慢性心理性应激胃溃疡模型更为合理。本实验结果显示:应激对胃肠动力产生了明显的抑制,使胃排空和肠推进受阻。说明应激原对消化系统的影响确切,同时也说明应激模型制备成功。有资料[10]显示:随着应激时间的延长,胃排空的抑制程度也不断增强。本实验结果显示:经JWSNS干预后,大鼠胃肠动力得到明显改善,全方表现出较好的促胃肠动力及镇痛等药效学作用。
文献[11]表明:应激性胃溃疡发病机制与神经递质调节有关。cAMP和cGMP是中枢神经系统内重要的神经递质,同时也是神经细胞功能的重要调节物质,在细胞代谢及多种生理效应中起到了关键的作用。胃溃疡患者胃肠动力改变往往与神经递质含量改变有关,应激导致机体发生身心反应的重要原因是激活了下丘脑-垂体-肾上腺(HPA)轴[12],而环核苷酸系统(cAMP、cGMP)作为激活过程中的第二信使,具有激素样的作用,其在应激状态下的表达增强从分子水平上体现了机体神经内分泌系统的异常改变及脑神经系统的损害程度,对慢性身心应激反应机制的阐明具有重要意义。本实验结果显示:大鼠慢性身心应激胃溃疡模型下丘脑cAMP和cGMP含量增加显著,提示慢性身心应激可导致神经元的损害。JWSNS通过调节环核苷酸系统而抑制了应激对神经元的损害进而改善了胃肠功能。脑肠肽存在于中枢及肠道神经系统,具有调节胃肠运动、分泌吸收等复杂的功能,并受情绪影响[13]。GAS可直接收缩胃平滑肌细胞,但要通过受体介导;VIP2是调节胃肠运动的重要物质,但需与受体结合才可产生偶联放大效应作用于平滑肌使之舒张[14]。本文作者选择GASR和VIPR2为代表进行实验,发现模型大鼠GASR减少,而VIP2受体增加明显,说明应激时胃肠平滑机细胞存在促进2种受体异常表达的机制,但这与组织内的胃肠激素表达似乎并不一致[15],提示激素的升高和降低并不一定是矛盾的主要方面,而是取决于表达受体的数目。JWSNS对脑肠肽受体具有较好的调节作用,提示其在胃肠道运动中起重要调节和多靶点的整体调治作用。
JWSNS源于张仲景的经典名方四逆散,在原方调畅气机法的基础上辅以祛湿活血之药组成加味四逆散。方中以疏肝理气之柴胡、枳实为君,臣以白芍,砂仁,白芨柔肝健脾和胃、行气调中祛湿、兼以收敛,佐以郁金行气活血解郁,使以炙甘草调和诸药、补脾益气。全方体现了中医身心兼顾、标本同治的理念。
[1]王朝辉,王富春.针灸防治应激性胃溃疡神经-内分泌调控机制研究进展[J].长春中医药大学学报,2012,28(4):725-726.
[2]唐洪梅,廖小红,房财富.肝郁脾虚型大鼠肠易激综合征模型的建立及评价[J].中国实验方剂学杂志,2012,18(6):138-140.
[3]余 欣,邱明义.妙用四逆散临床经验举隅[J].湖北中医杂志,2008,30(9):18-19.
[4]方吉华.四逆散加减治疗慢性胃炎的临床疗效[J].中医临床研究,2012,4(12):69-70.
[5]魏宜霖,汤 洁,李镇楠.血管加压素对心理性应激大鼠胃排空的影响[J].南京医科大学学报:自然科学版,2008,28(4):484-487.
[6]王 寅.慢性心理应激大鼠模型的建立及评价研究进展[J].蚌埠医学院学报,2010,35(2):206-208.
[7]王 瑜,钱令嘉,赵 云.郁心效的抗抑郁作用及其机制研究[J].中国实验方剂学杂志,2012,18(6):129-132.
[8]张 丽,朱熊兆,白 玫.不同应激方式引发的抑郁大鼠行为特征比较[J].中华行为医学与脑科学杂志,2012,21(3):212-215.
[9]梁 军,胡 敏,刘 敏.慢性不可预知性应激刺激后大鼠行为学改变[J].中国医药指南,2012,10(21):20-21.
[10]唐洪梅,廖小红,房财富.肝郁脾虚型大鼠肠易激综合征模型的建立及评价[J].中国实验方剂学杂志,2012,18(6):138-140.
[11]雷龙鸣,庞 军,伦轼芳.经皮循经推拿手法对慢性应激模型大鼠行为学及下丘脑单氨类神经递质的影响[J].按摩与康复医学,2012,3(1):3-5.
[12]佟海英,莲 花,高玉峰.槟榔十三味丸对慢性应激抑郁模型大鼠行为学及下丘脑-垂体-肾上腺轴的影响[J].中南民族大学学报:自然科学版,2012,31(1):42-46.
[13]肖爱娇,邹宏昌.艾灸对抑郁症模型大鼠色氨酸羟化酶2基因表达与单胺氧化酶活性的影响[J].中华行为医学与脑科学杂志,2012,21(2):126-128.
[14]肖哲曼,姚丽华,郭青山.慢性不可预见性温和应激对大鼠行为及下丘脑胃泌素释放肽mRNA表达的影响[J].神经损伤与功能重建,2012,7(1):28-31.
[15]陈 英,杨春敏,韩全利.模拟失重对大鼠血浆ghrelin、VIP和胃肠动力的影响[J].胃肠病学和肝病学杂志,2012,21(1):55-58.

