洞头海域网采浮游植物的月际变化
朱旭宇,黄 伟,曾江宁,江志兵,杜 萍,廖一波,张 鹏,陈全震,*
(1.国家海洋局第二海洋研究所,国家海洋局海洋生态系统与生物地球化学重点实验室,杭州 310012;2.国家海洋局南通海洋环境监测中心站,南通 226005;3.浙江省海洋水产养殖研究所,温州 325000)
浮游植物是海洋生态系统中最主要的初级生产者,其在海洋生态系统的能量流动和物质循环中起至关重要的作用。水动力[1]、温度[2]、盐度[3]、营养盐[4-5]、竞争[6]和摄食[7]等对浮游植物群落具有重要的调控作用,而浮游植物又可通过食物链最终影响生态系统的稳定,具有较好的环境指示意义。
洞头列岛(121°10′E,27°50′N)位于瓯江口外约50 km的浙江省东南海域。因其受台湾暖流、闽浙沿岸流和瓯江径流的影响[8-10],营养盐输入丰富,是浙江沿海主要渔场之一[11]。近20年来,浙江沿岸区域和本岛经济的快速发展,生活污水、水产养殖、农业施肥和工业生产等人类活动造成氮、磷营养盐入海通量急剧增加,最终导致该海域频繁爆发东海原甲藻(Prorocentrum donghaiense)和微小原甲藻(P.minimum)等有害赤潮[12]。因此,研究洞头海域浮游植物群落对环境变化的响应具有重要科学意义,但目前鲜有该海域浮游植物及其环境因子影响的报道[13-14]。本研究根据在洞头岛邻近海域进行的周年(月际)连续监测结果,并结合历史资料,分析了浮游植物群落的物种组成、优势种和多样性指数与主要环境因子的关系。研究结果可为深入了解环境变化对该海域浮游植物群落的影响提供基础资料。
1 研究区域和方法
1.1 研究区域
洞头海区是我国强潮区之一,潮汐属正规半日潮,该海区潮流主要为往复流[15],因此,可以认为该海区水体混合较均匀。于2010年8月至翌年7月每月中旬对洞头海域进行一次理化因子与浮游植物的现场调查,共设7个平行采样点(图1)。
1.2 样品采集与分析
按照《海洋调查规范》[16],浮游植物样品用浅III浮游生物网(网口直径37 cm,网口面积0.1 m2,网目为77 μm)自底至表作垂直拖网采集,并用Hydro-bios流量计记录滤水量。样品用中性甲醛固定,经浓缩后用Nikon E200显微镜观察、鉴定和计数。同时采集表层(0.5 m)水样,黑暗冷藏条件下带回实验室,硝酸盐、亚硝酸盐、铵盐、活性磷酸盐和硅酸盐的分析方法按《海洋监测规范》[17]进行。其中采用锌-镉还原法采用重氮-偶氮法,采用次溴酸钠氧化法,采用硅钼黄法采用磷钼蓝法。
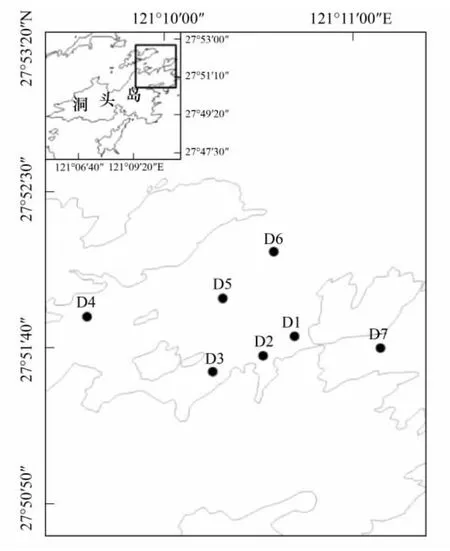
图1 洞头海域调查站位Fig.1 Sample stations in Dongtou Island
1.3 数据处理
采用以下公式[18-19]分别计算:

式中,S为样品中的种类总数,N为样品中的总个体数,ni为样品中第i种的个体数,fi为该种在各样品中出现的频率,a、b分别为A、B月份所具有的物种数,c为两月共有的物种数。
文中除种类数外的其他数据以平均值±标准差(Mean±S.D.)表示。用CANOCO软件分析浮游植物与环境因子的关系,为简化分析数据,避免种类检出的偶然性,本文用于排序的物种为每月出现的优势种。物种矩阵和环境矩阵的各项参数(除pH值外)都经过log(x+1)转换,将物种数据进行去趋势对应分析(DCA)后,发现轴长>4,故选择典范对应分析(CCA)进行物种-环境分析[20],绘图采用SigmaPlot 9.0软件进行。
2 结果
2.1 理化因子
2.1.1 盐度、温度和pH
调查期间盐度和水温月变化较明显(图2)。盐度在7月最高,为30.3,12月最低,为26.8;从季节来看,夏季(30.1)>春季(28.3)>秋季(28.0)>冬季(26.8)。水温变化趋势与盐度类似,8月最高,为29.9℃,2月最低,为7.0℃;从季节来看,夏季(28.2℃)>秋季(21.1℃)>春季(15.9℃)>冬季(9.9℃)。pH全年变化不大,从季节来看,夏季(8.19)>冬季(8.16)>春季(8.14)>秋季(8.13)。
2.1.2 营养盐
调查期间磷酸盐浓度全年变化幅度较大(图3),12月浓度最高,为1.43 μmol/L,5—9月较低,最低值出现在8 月,仅 0.58 μmol/L;从季节来看,冬季(1.31 μmol/L)>秋季(1.07 μmol/L)>春季(1.00 μmol/L)>夏季(0.61 μmol/L)。硅酸盐浓度在大多月份较高,其中10月最高,为55.05 μmol/L,8月最低,为20.57 μmol/L(图3b);从季节来看,冬季(42.06 μmol/L)>秋季(41.18 μmol/L)>春季(33.22 μmol/L)>夏季(24.81 μmol/L)。亚硝酸盐和铵盐浓度全年均较低(图3),亚硝酸盐夏季(1.73 μmol/L)>春季(1.38 μmol/L)>秋季(0.58 μmol/L)>冬季(0.14 μmol/L),铵盐夏季(2.26 μmol/L)>秋季(2.19 μmol/L)>春季(0.90 μmol/L)>冬季(0.87 μmol/L)。硝酸盐浓度在本海域较高(图3),仅在7—9月稍低,8月最低,为11.32 μmol/L;从季节来看,冬季(88.81 μmol/L)>春季(86.23 μmol/L)>秋季(55.69 μmol/L)>夏季(27.77 μmol/L)。溶解无机氮(DIN)变化趋势与硝酸盐一致(图3),8月最低,为15.02 μmol/L;从季节来看,冬季(89.82 μmol/L)>春季(88.51 μmol/L)>秋季(58.46 μmol/L)>夏季(31.76 μmol/L)。
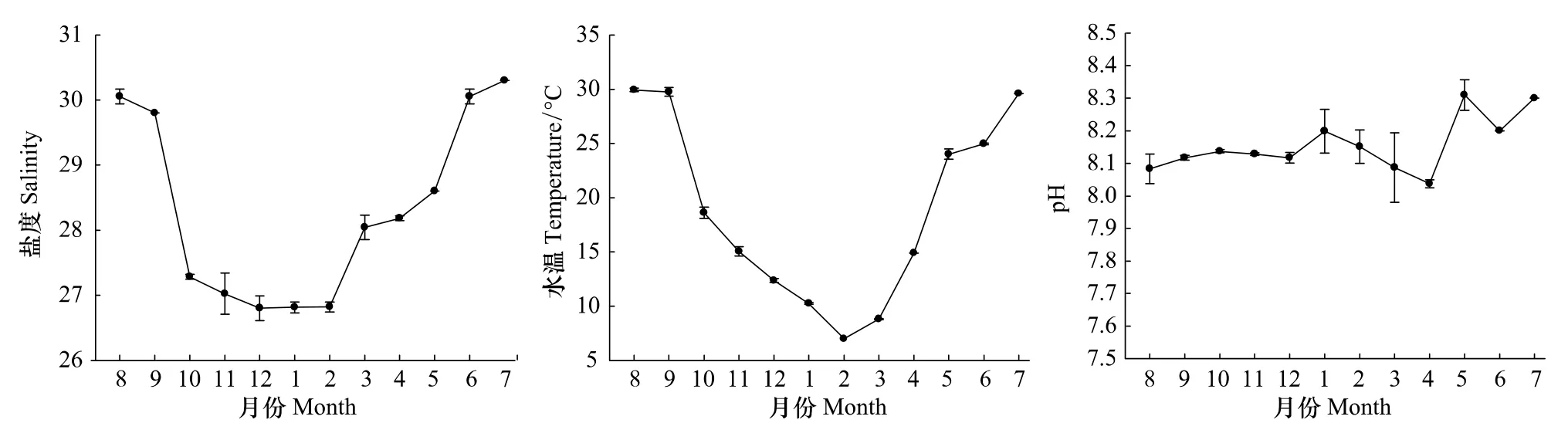
图2 2010—2011年洞头海域表层海水盐度、温度和pH月变化(平均值±标准差)Fig.2 Monthly variation of salinity,temperature and pH of surface waters in Dongtou Island during 2010—2011(Mean±S.D.)
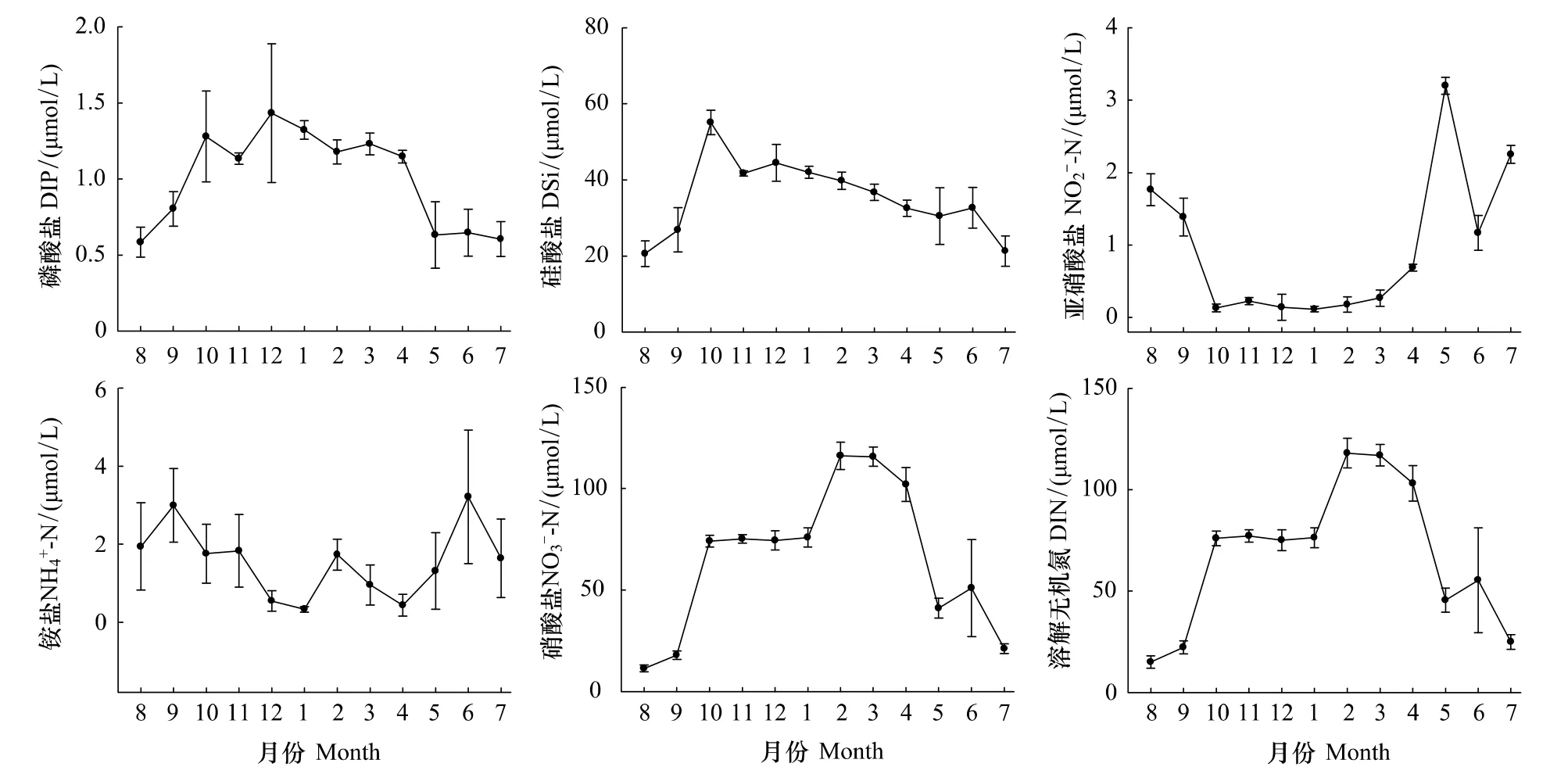
图3 2010—2011年洞头海域表层海水营养盐浓度月变化Fig.3 Monthly variation of nutrient concentration of surface waters in Dongtou Island during 2010—2011
调查海域营养盐比例月变化也较明显(图4)。N∶P除8和9月较低外,其他各月均较高,其中8月最低,为 25.7∶1,2 月最高,为 100.2∶1;从季节来看,春季(85.6∶1)>冬季(70.1∶1)>秋季(51.7∶1)>夏季(50.1∶1)。Si∶P范围在28.3—50.4之间,其中4月最低,6月最高;从季节来看,夏季(40.3∶1)>秋季(37.7∶1)>春季(35.4∶1)>冬季(32.2∶1)。Si∶N变化范围在0.3—1.4之间,其中8月最高,3和4月较低;从季节来看,夏季(0.9∶1)>秋季(0.8∶1)>冬季(0.5∶1)>春季(0.4∶1)(图 4)。
2.2 浮游植物群落结构
2.2.1 种类组成
网采浮游植物共鉴定出187种,隶属于硅藻(143种,占76.5%)、甲藻(40种,占21.4%)、金藻(2种,占1.1%)、蓝藻(1种,占0.5%)和绿藻(1种,占0.5%)等5个门类。硅藻中角毛藻属Chaetoceros的种类数最高,有26种;圆筛藻属Coscinodiscus次之,有16种。甲藻中原多甲藻属Protoperidinium的种类最多,有14种;角藻属Ceratium次之,有10种。共发现72种赤潮种,占浮游植物种类数的38.5%,其中硅藻44种,甲藻25种,蓝藻1种,金藻2种。各月浮游植物门类分布如图5所示,9月种类数最高,有97种,6月最低,仅38种;从季节来看,秋季(78种)>夏季(72种)>冬季(69种)>春季(59种)。
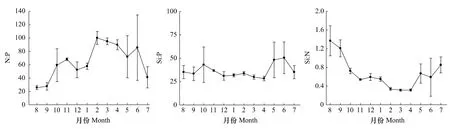
图4 2010—2011年洞头海域表层海水营养盐比例月变化Fig.4 Monthly variation of nutrient ratios of surface waters in Dongtou Island during 2010—2011
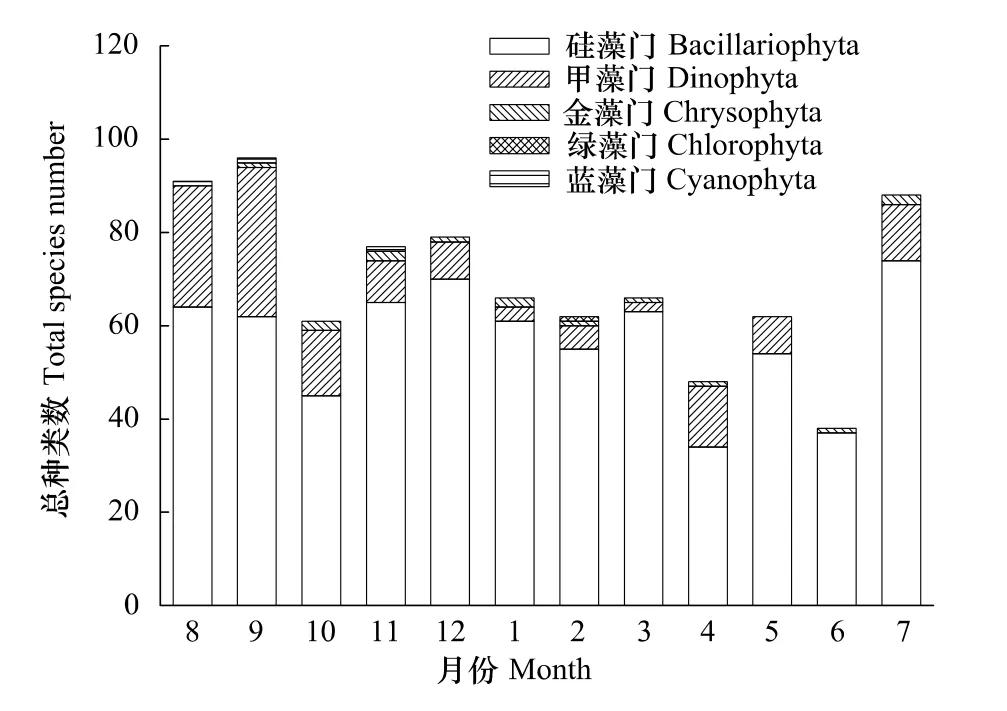
图5 2010—2011年洞头海域浮游植物种类组成月变化Fig.5 Monthly variation of phytoplankton species composition in Dongtou Island during 2010—2011
浮游植物种类在每相邻两月之间的相似性系数(JS)变幅为25.60—44.92%(表1),可以看出调查海域浮游植物月与月之间约50%以上的种类组成不相同,表明时间差异较明显,浮游植物种类演替比较快。
2.2.2 生态类群
根据洞头海域浮游植物的适温范围,可以将观察到的浮游植物分为三类:(1)广温类群,该类群对温度适应范围较广,是调查海域的优势类群,代表性种类有尖刺伪菱形藻(Pseudo-nitzschia pungens)、翼鼻状藻纤细变型(Proboscia alata f.gracillima)和尖叶原甲藻(Prorocentrum triestinum)等;(2)暖水类群,该类群适宜水温较高的季节和水域,在调查海域夏、秋季出现较多,代表性种类有劳氏角毛藻(C.lorenzianus)、透明辐杆藻(Bacteriastrum hyalinum)和琼氏圆筛藻(C.jonesianus)等;(3)暖温类群,该类群在本海域出现频率和丰度均较低,代表性种类有柔弱几内亚藻(Guinardia delicatula)、短孢角毛藻(C.brevis)、扭链角毛藻(C.tortissimus)、笔尖形根管藻(Rhizosolenia styliformis)和皇冠角毛藻(C.diadema)等。

表1 2010—2011年洞头海域浮游植物种类组成月相似性系数(JS,%)Table 1 Variation of species similarity index of phytoplankton in Dongtou Island during 2010—2011
2.2.3 细胞丰度
调查海域浮游植物细胞丰度时间变化较明显(图6),细胞丰度在7—9月较高,其它各月均维持在相对低的水平;从季节来看,夏季(128.83×106个/m3)>秋季(13.19×106个/m3)>冬季(10.81×106个/m3)>春季(3.98×106个/m3)。本海域硅藻细胞丰度全年变化趋势与总细胞丰度趋势一致,3月最低,为2.32×106个/m3,7—9月出现高值(图6)。甲藻细胞丰度维持在较低水平,全年均值变化范围为0—3.97×106个/m3,1月甲藻细胞丰度最高,此时尖叶原甲藻占优势。金藻几乎全年都出现,但细胞丰度较低,在104—105个/m3水平之间。蓝藻全年细胞丰度也较低,在8月达最高值,而绿藻仅在个别月份出现。可以看出,硅藻作为浮游植物的主体,对浮游植物丰度的变化起支配作用。
2.2.4 优势种
调查期间各月网采浮游植物优势种不同(表2)。其中,1月优势种最多,有7种,11月最少,仅1种,为骨条藻(Skeletonema spp.)。除6—8月外的其他各月,骨条藻均为主要优势种。具槽帕拉藻(Paralia sulcata)在6月占主要优势,优势度(Y)为0.401。拟旋链角毛藻(C.pseudocurvisetus)在温度较高的7和8月占一定优势,且在7月Y高达0.659,细胞丰度为159.22×106个/m3。柔弱伪菱形藻(P.delicatissima)和尖刺伪菱形藻在8月占主要优势,其Y分别为0.497和0.118。此外,优势种多数为硅藻,甲藻较少,仅3种,分别为双刺原多甲藻(P.bipes)、尖叶原甲藻和透镜翼藻(Diplopsalis lenticula)。束毛藻(Trichodesmium spp.)在8和9月占一定优势。

图6 2010—2011洞头海域浮游植物总丰度和各门类细胞丰度的月变化Fig.6 Monthly variation of total cells abundance and cell abundance of every phyla in Dongtou Island during 2010—2011

表2 2010—2011洞头海域浮游植物优势种组成及优势度Table 2 Dominant phytoplankton species and their dominance in Dongtou Island during 2010—2011
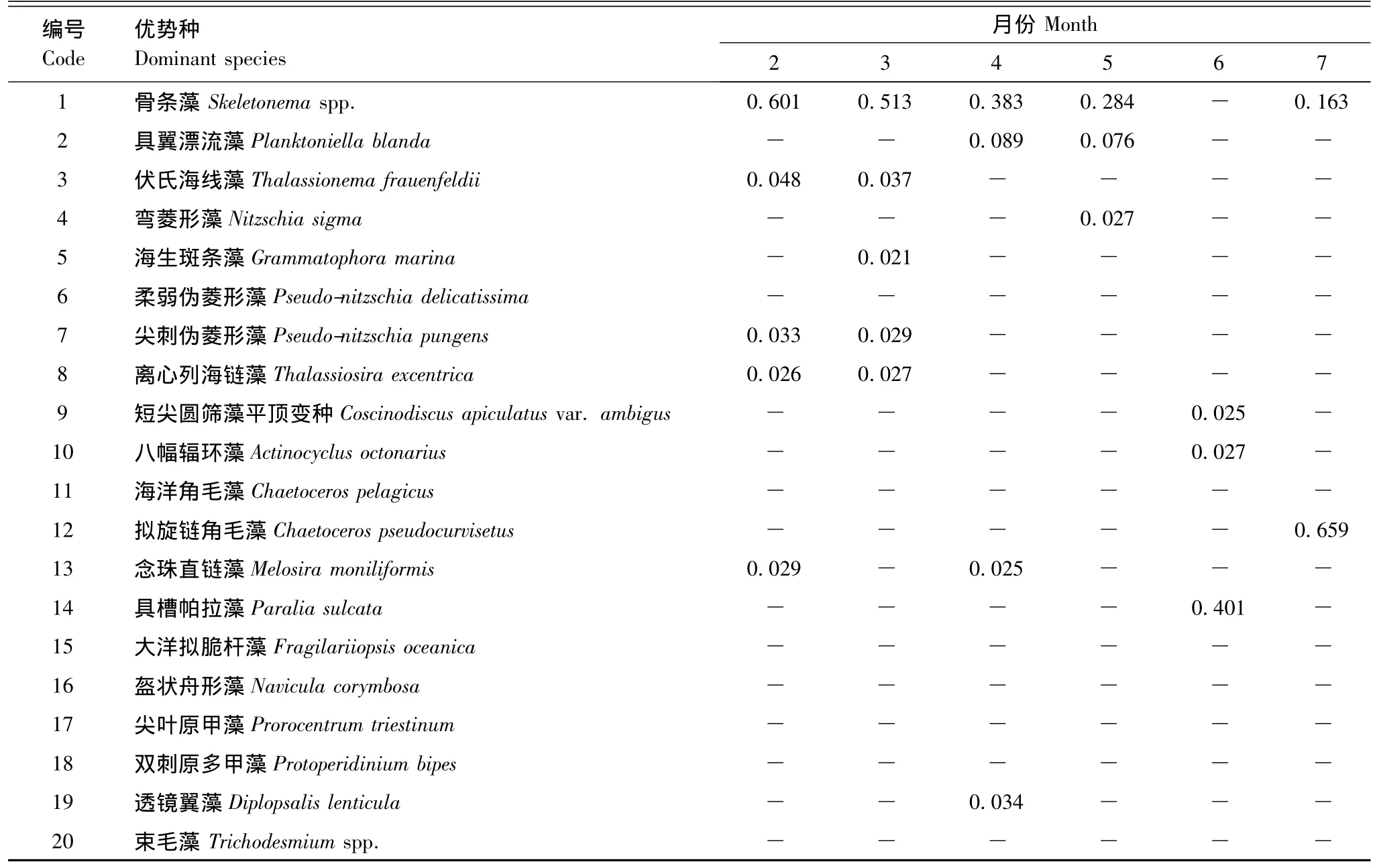
续表
2.2.5 群落多样性指数
调查海域浮游植物群落多样性指数年均值的变化如图7所示。Shannon-Wiener指数(H′)和均匀度指数(J)周年变化趋势大体一致。H′值9月最低,仅为0.73,4月最高,为2.10。J值9月最低,仅为0.22,4月最高,为0.74。从季节来看,H′值春季(2.08)>冬季(1.79)>夏季(1.73)>秋季(1.20),J值春季(0.70)>冬季(0.56)>夏季(0.52)>秋季(0.38)。
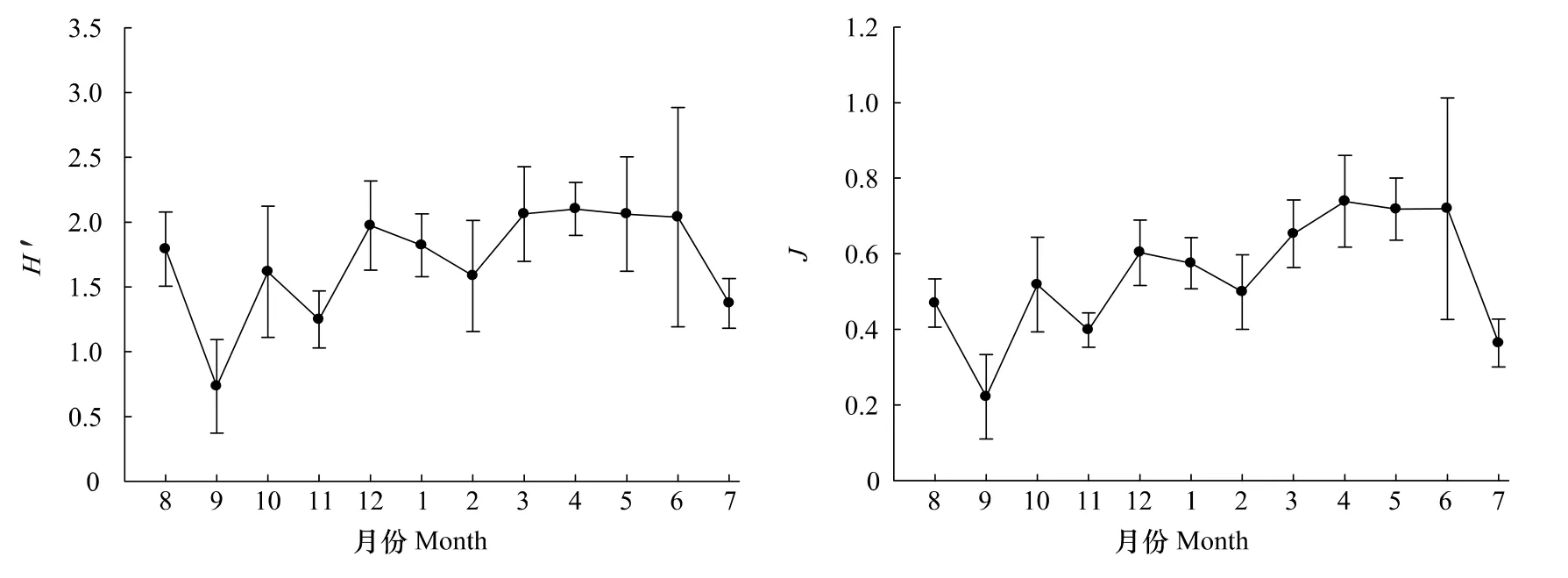
图7 2010—2011洞头海域浮游植物Shannon-Wiener指数(H′)和均匀度指数(J)月变化Fig.7 Monthly variation of H′and J of phytoplankton in Dongtou Island during 2010—2011
2.3 浮游植物群落与理化因子的关系
选择各月优势种(20种)用于CCA分析,浮游植物代码见表2。在CCA排序图中,箭头表示环境因子,箭头连线的长短表示物种分布与环境因子相关性的大小。蒙特卡罗检验(Monte Carlo test)表明,第1轴和全部轴P<0.05,故CCA分析的排序结果是可信的。CCA分析中的9个环境因子可解释浮游植物群落总变量的90.9%。第1轴和第2轴的特征值分别为0.605和0.293,并各自解释了35.7%和17.3%的物种变量。第1轴和第2轴的物种—环境相关系数分别为0.998和0.997,表明这9个环境因子与20种主要浮游植物种类相关性较好。营养盐结构、盐度和温度是影响浮游植物群落的主要环境因子(图8)。组Ⅰ (暖水高盐种)与Si∶N、温度和盐度密切正相关,而与营养盐浓度和N∶P呈负相关;组Ⅱ (近岸广温种)与组I刚好相反;组Ⅲ(附生种或底栖种)和具槽帕拉藻(14)对环境变化的耐受性较强,故与温度、盐度及营养盐浓度和结构等基本无相关性;而骨条藻(1)属相对广温广盐种,在该海域除夏季外均为优势种,故位于坐标原点附近,受环境因子的影响较小。
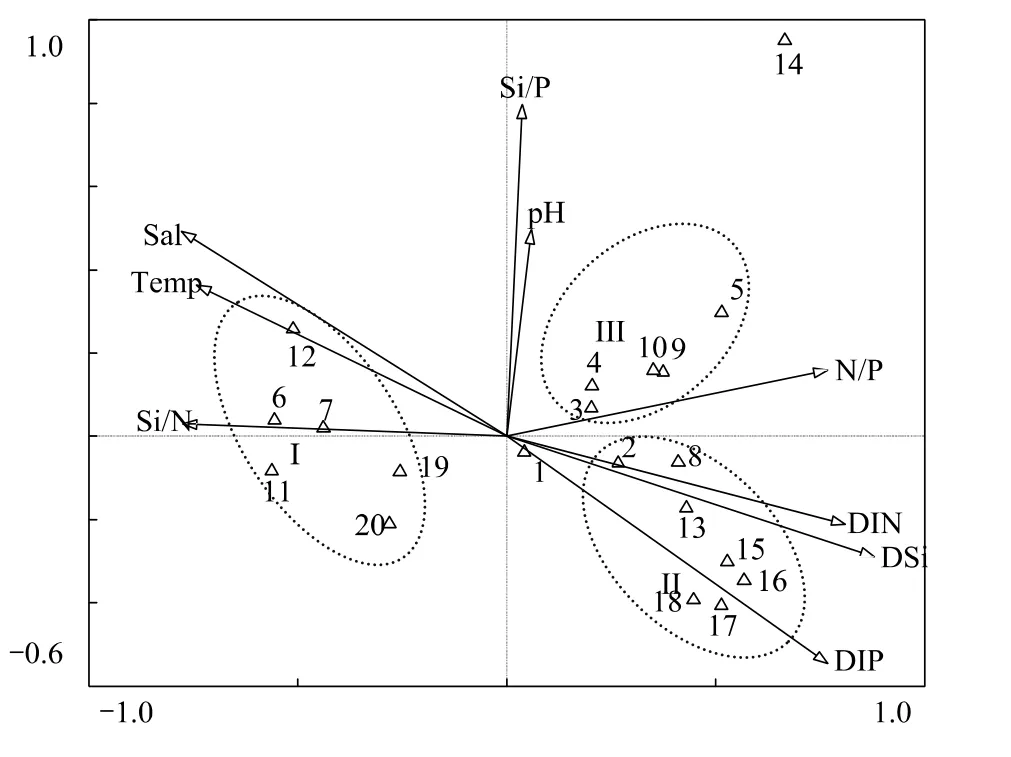
图8 主要浮游植物种类与环境因子间的CCA排序图Fig.8 CCA ordination of main phytoplankton species with environmental variables
3 讨论
3.1 浮游植物群落与水团的关系
洞头海域主要受台湾暖流、闽浙沿岸流和瓯江北口淡水径流的影响。夏、秋季台湾暖流影响较大[8-9],调查海域外海(盐度29.8—30.1)暖水性种类增多,如海洋角管藻(Cerataulina pelagic)、远距角毛藻(C.distans)和拟旋链角毛藻等硅藻类,及透镜翼藻和马西里亚角藻(C.massiliense)等甲藻类。其中,6月浮游植物种类数较低,这可能是由于采样前发生过裸甲藻(Gymnodinium sp.)赤潮,导致海区种类数降低;9月浮游植物种类数高达97种,此时甲藻种类最多(32种)。冬、春季,受闽浙沿岸流与淡水径流影响[8,10],调查海域既有相对低盐(盐度26.8—28.6)种类(琼氏圆筛藻、布氏双尾藻Ditylum brightwellii和尖叶原甲藻等),也有淡水种类和半咸水种类(二角盘星藻具刺变种Pediastrum duplex var.echinatum和针杆藻Synedra sp.等)。
浮游植物细胞丰度大部分月份处于较低水平,但在7和8月急剧增加,这分别与拟旋链角毛藻和伪菱形藻的大量生长有关。拟旋链角毛藻为暖水种类,有研究表明角毛藻适宜高温条件下生长[22]。王艳等[23]研究也发现,拟旋链角毛藻在湛江海域的夏季大量繁殖,细胞丰度高达2289.87×106个/m3,是当地较重要的赤潮种。伪菱形藻也是重要的赤潮种类,且部分种类如P.multiseries可产生多莫酸(DA)毒素[24]。在本海区发现的伪菱形藻主要为尖刺伪菱形藻和柔弱伪菱形藻,该藻是典型的广温种,但在调查海区只在8月丰度较高,为128.16×106个/m3,此时海区温度为29.9℃,盐度为30.1,N∶P范围为20.8—29.4。这与陈菊芳等[25]对大亚湾伪菱形藻的研究成果相似,他们认为大亚湾高密度的伪菱形藻出现的温度、盐度和N∶P范围分别为25.0—30.0℃、28.9—31.3和6.2—32.9。另外,盔状舟形藻(Navicula corymbosa)等附生性藻类在温度较低的冬、春季丰度也较高,这主要由于本海域羊栖菜(Sargasum fusiforme)养殖的原因。
浮游植物多样性可以表示群落的稳定性,当多样性较高时,即优势种种类较多,无优势性特别突出的种类时,该群落结构是稳定的[26]。秋季H′值和J值均较低(图7),分别为1.20和0.38,这是由于此时优势种较单一,骨条藻占绝对优势(表2);其他季节H′值和J值均较高。这表明本海域浮游植物群落结构尚属稳定。
3.2 营养盐对浮游植物的影响
CCA结果表明营养盐也是影响本海域浮游植物群落的主要因素。Redfield[27]曾提出,浮游植物生长较合适的 Si∶N ∶P 值为16∶16∶1,当 N ∶P>16∶1 时,属于磷限制,N ∶P<16∶1 时,属于氮限制;当 Si∶N>1∶1 时,属于氮限制,Si∶N<1∶1时,属于硅限制。本海域全年N∶P均较高(>25∶1),因此浮游植物的生长受磷限制。一般而言,甲藻如原甲藻、鳍藻Dinophysis等对磷的需求较高[28],因此,磷限制了本海域甲藻的生长。从图8也可以看出,甲藻优势种丰度与磷酸盐浓度密切正相关,1月磷酸盐浓度较高(1.30 μmol/L),此时甲藻丰度较高,当磷酸盐浓度降低时,甲藻丰度降低。柔弱伪菱形藻和尖刺伪菱形藻与Si∶N密切正相关,当Si∶N升高时,其丰度升高,而Hlaili等[28]认为伪菱形藻对氮的需求较高,氮浓度升高对伪菱形藻生长有利。这可能是因为伪菱形藻大量增殖消耗了水体中的氮,导致Si∶N升高,从而呈现出伪菱形藻丰度与Si∶N密切正相关的现象。拟旋链角毛藻在温度较高而营养盐浓度较低的夏季有较高的丰度,故它与温度密切正相关,与磷酸盐、硅酸盐和硝酸盐密切负相关。一些广布种如具槽帕拉藻等生态幅较大,故其对环境因子的变化不敏感,受环境影响较小。
近30年来,洞头海域浮游植物优势种构成变化较明显(表3)。圆筛藻在20世纪80年代初是较常见的优势种,常在秋、冬季占主要优势,主要种类为有棘圆筛藻(C.spinosus);进入90年代后,圆筛藻仍然为浮游植物群落的主要组成部分,但主要种类为琼氏圆筛藻和虹彩圆筛藻(C.oculus-iridis),而且1990年春季其优势地位被夜光藻(Noctiluca scientillans)取代;至今,本海域圆筛藻种类虽较多(16种),但丰度较低,已不再成为优势种群。骨条藻在20世纪80和90年代细胞丰度较低,仅在个别季节占优势,而在本研究调查期间,已成为本海域最重要的赤潮种。此外,甲藻优势种也有较大变化,角藻在80年代占一定优势,主要为梭角藻(C.fusus)和叉状角藻(C.furca),随后优势度有所下降。本次调查期间,角藻种类虽也较多(10种),但不再占优势,近几年,本海域甲藻赤潮主要由东海原甲藻引起[12]。
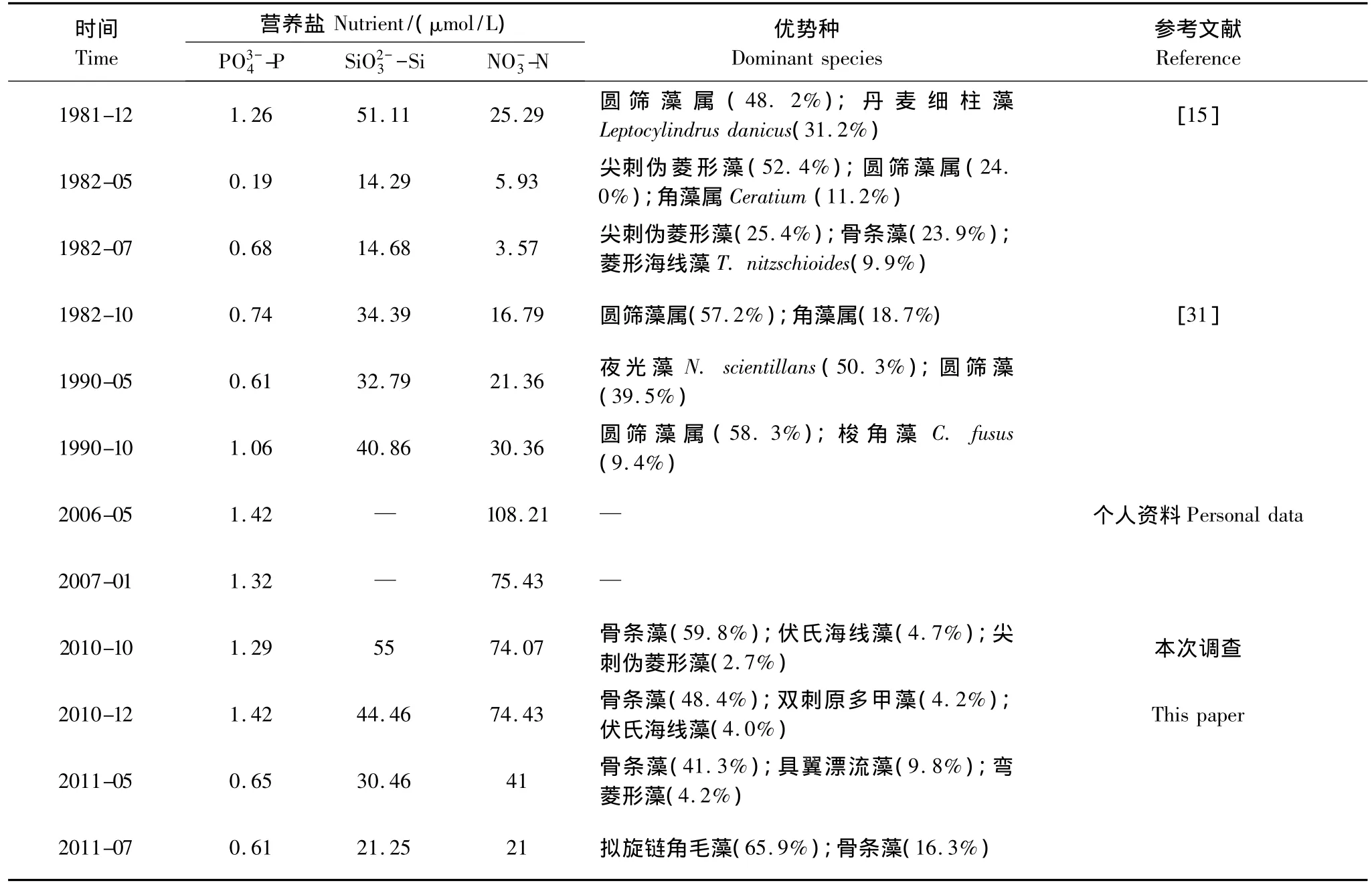
表3 不同调查年份洞头海域营养盐数据和网采浮游植物的群落参数Table 3 Nutrient concentration and community parameters of net-phytoplankton at different years in Dongtou Island
上述改变与洞头海域环境因子的改变有关,如Zhou等[29]的研究认为,近50年来营养盐结构(浓度及比例)的改变是长江口海域浮游植物丰度升高和优势种组成改变的主要原因。从表3中可以看出,近30年来,磷酸盐和硅酸盐浓度变化不大,而硝酸盐浓度急剧增加,80年代初期,其平均浓度仅为12.89 μmol/L,在本次调查中,其平均浓度高达52.63 μmol/L。同期,浮游植物优势种也由圆筛藻向骨条藻等演替,Wang等[30]的研究也认为,营养盐浓度升高会导致优势种由大型硅藻(如根管藻等)向链状硅藻(中肋骨条藻和伪菱形藻等)演替。另外,富营养化也是本海域东海原甲藻频繁旺发的重要原因之一[12,29]。
致谢:感谢浙江省海洋水产养殖所谢起浪、柴雪良、李尚鲁、林少珍、吴洪喜、王铁杆、李磊和张立宁等的帮助。感谢冉莉华老师对英文摘要进行润色。
[1] Zhou M J,Yan T,Zou J Z.Preliminary analysis of the characteristics of red tide areas in Changjiang River estuary and its adjacent sea.Chinese Journal of Applied Ecology,2003,14(7):1031-1038.
[2] Lassen M K,Nielsen K D,Richardson K,Garde K,Schlüter L.The effects of temperature increases on a temperate phytoplankton community——a mesocosm climate change scenario.Journal of Experimental Marine Biology and Ecology,2010,383(1):79-88.
[3] Alkawri A A S,Ramaiah N.Spatio-temporal variability of dinoflagellate assemblages in different salinity regimes in the west coast of India.Harmful Algae,2010,9(2):153-162.
[4] Sun J,Liu D Y,Yang S M,Guo J,Qian S B.The preliminary study on phytoplankton community structure in the central Bohai Sea and the Bohai strait and its adjacent area.Oceanologia et Limnologia Sinica,2002,33(3):461-471.
[5] Lie A A Y,Wong C K,Lam J Y C,Liu J H,Yung Y K.Changes in the nutrient ratios and phytoplankton community after declines in nutrient concentrations in a semi-enclosed bay in Hong Kong.Marine Environmental Research,2011,71(3):178-188.
[6] Granéli E,Weberg M,Salomon P S.Harmful algal blooms of allelopathic microalgal species:the role of eutrophication.Harmful Algae,2008,8(1):94-102.
[7] Han X F,Wang R.The grazing impact and regulation effects of zooplankton on phytoplankton bloom.Marine Sciences,2001,25(10):31-33.
[8] Su J L,Yuan L Y.Hydrology in China offshore.Beijing:Ocean Press,2005:207-246.
[9] Gao Q,Xu Z L.Species composition and diversity of zooplankton in Oujiang River estuary in summer and autumn.Chinese Journal of Ecology,2009,28(10):2048-2055.
[10] Zhang F.Seasonal variation features of chlorophyll a content in Taiwan Strait.Journal of Oceanography in Taiwan Strait,2001,20(3):314-318.
[11] Wang Y N,Zhang Y P,Wang X H.Ecologic investigation of mollusca on the intertidal zone of Dongtou island,Zhejiang.Journal of Zhejiang College of Fisheries,1994,13(3):179-182.
[12] Yao W M,Zheng A R,Qiu J K.Eutrophication in Dongtou islands,Zhejiang and the relationships between eutrophication and red tide.Marine Environmental Science,2007,26(5):466-469.
[13] Chen L,Xu Z L,Yao W M,Zhang Z,Chen S,Cai S W,Bao X P.The distribution of nutrients,phytoplankton and zooplankton in spring of the Oujiang River estuary.Acta Ecologica Sinica,2009,29(3):1571-1577.
[14] Li Y,Li H,Lü S H,Jiang T J,Xiao Y P,Chen S.Species diversity and distribution of phytoplankton in Nanji islands national nature reserve.Acta Hydrobiologica Sinica,2010,34(3):618-628.
[15] The Committee of Investigation of Symposium for Coastal and Intertidal Resources in Zhejiang Province.The report of coastal and intertidal resources of Zhejiang Province.Beijing:Ocean Press,1988.
[16] Standardization Administration of China.The Specification for Marine Monitoring(GB/T 17378.4—2007).Beijing:China Standards Press,2007.
[17] Standardization Administration of China.The Specification for Oceanographic Survey(GB/T 12763.6—2007).Beijing:China Standards Press,2007.
[18] Pielou,E C.An introduction to mathematical ecology.New York:Wiley-Interscience,1969.
[19] Magurran A E.Ecological diversity and its measurement.New Jersey:Princeton University Press,1988:1-179.
[20] Lepš J,Šmilauer P.Multivariate analysis of ecological data using CANOCO.London:Cambridge University Press,2003:1-280.
[21] Sun J,Liu D Y.The preliminary notion on nomenclature of common phytoplankton in China seas waters.Oceanologia et Limnologia Sinica,2002,33(3):271-286.
[22] Wang Z H,Qi Y Z,Chen J F,Xu N.Population dynamics of Chaetoceros spp.and multivariate analysis of its relationship with environmental factors in Daya Bay,South China Sea.Acta Ecologica Sinica,2006,26(4):1096-1102.
[23] Wang Y,Nie R,Li Y,Lü S H.Species diversity and geographical distribution of Chaetoceros in Guangdong coastal waters.Advances in Marine Science,2010,28(3):342-352.
[24] Hagström J A,Granéli E,Moreira M O P,Odebrecht C.Domoic acid production and elemental composition of two Pseudo-nitzschia multiseries strains,from the NW and SW Atlantic Ocean,growing in phosphorus-or nitrogen-limited chemostat cultures.Journal of Plankton Research,2011,33(2):297-308.
[25] Chen J F,Xu N,Wang Z H,Huang W J,Xie L C,Jiang T J,Qi Y Z.Dynamics of Pseudo-nitzschia spp.and environmental factors in Daya Bay,the south China Sea.Acta Scientiae Circumstantiae,2002,22(6):743-748.
[26] Aktan Y.Large-scale patterns in summer surface water phytoplankton(except picophytoplankton)in the Eastern Mediterranean.Estuarine,Coastal and Shelf Science,2011,91(4):551-558.
[27] Redfield A C.The biological control of chemical factors in the environment.American Science,1958,46(3):205-221.
[28] Hlaili A S,Chikhaoui M A,Grami B E,Mabrouk H H.Effects of N and P supply on phytoplankton in Bizerte Lagoon(western Mediterranean).Journal of Experimental Marine Biology and Ecology,2006,333(1):79-96.
[29] Zhou M J,Shen Z L,Yu R C.Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang(Yangtze)River.Continental Shelf Research,2008,28(12):1483-1489.
[30] Wang Z H,Zhao J G,Zhang Y J,Cao Y.Phytoplankton community structure and environmental parameters in aquaculture areas of Daya Bay,South China Sea.Journal of Environmental Sciences,2009,21(9):1268-1275.
[31] The Second Institute of Oceanography.The report of marine biological resources of islands in Zhejiang Province.Hangzhou,1993.
参考文献:
[1] 周名江,颜天,邹景忠.长江口邻近海域赤潮发生区基本特征初探.应用生态学报,2003,14(7):1031-1038.
[4] 孙军,刘冬艳,杨世民,郭健,钱树本.渤海中部和渤海海峡及邻近海域浮游植物群落结构的初步研究.海洋与湖沼,2002,33(5):461-471.
[7] 韩希福,王荣.海洋浮游动物对浮游植物水华的摄食与控制作用.海洋科学,2001,25(10):31-33.
[8] 苏纪兰,袁业立.中国近海水文.北京:海洋出版社,2005:207-246.
[9] 高倩,徐兆礼.瓯江口夏、秋季浮游动物种类组成及其多样性.生态学杂志,2009,28(10):2048-2055.
[10] 张钒.台湾海峡叶绿素a含量的季节变化特征.台湾海峡,2001,20(3):314-318.
[11] 王一农,张永普,王旭华.浙江洞头岛潮间带软体动物的生态调查.浙江水产学院学报,1994,13(3):179-182.
[12] 姚炜民,郑爱榕,邱进坤.浙江洞头列岛海域水体富营养化及其与赤潮的关系.海洋环境科学,2007,26(5):466-469.
[13] 陈雷,徐兆礼,姚炜民,张钊,陈胜,蔡圣伟,鲍旭平.瓯江口春季营养盐、浮游植物和浮游动物的分布.生态学报,2009,29(3):1571-1577.
[14] 李扬,李欢,吕颂辉,江天久,萧云朴,陈舜.南麂列岛海洋自然保护区浮游植物的种类多样性及其生态分布.水生生物学报,2010,34(3):618-628.
[15] 浙江省海岸带和海涂资源综合调查报告编写委员会.浙江省海岸带和海涂资源综合调查报告.北京:海洋出版社,1988.
[16] 国家标准化管理委员会.海洋监测规范(GB/T17378.4—2007).北京:中国标准出版社,2007.
[17] 国家标准化管理委员会.海洋调查规范(GB/T 12763.6—2007).北京:中国标准出版社,2007.
[21] 孙军,刘东艳.中国海区常见浮游植物种名更改初步意见.海洋与湖沼,2002,33(3):271-286.
[22] 王朝晖,齐雨藻,陈菊芳,徐宁.大亚湾角毛藻细胞数量波动及其与环境因子关系的多元分析.生态学报,2006,26(4):1096-1102.
[23] 王艳,聂锐,李扬,吕颂辉.广东沿海角毛藻(Chaetoceros)的种类多样性及其地理分布.海洋科学进展,2010,28(3):342-352.
[25] 陈菊芳,徐宁,王朝晖,黄伟健,谢隆初,江天久,齐雨藻.大亚湾拟菱形藻(Pseudo-nitzschia spp.)种群的季节变化与环境因子的关系.环境科学学报,2002,22(6):743-748.
[31] 国家海洋局第二海洋研究所.浙江省海岛海域生物资源综合调查报告.杭州,1993.

