水/乙醇溶剂中阿奇霉素的热力学及多晶型研究
陈晓春,黄小权,2,陈长保,2,付天松,2
(1.南京工业大学生物与制药工程学院,南京211800; 2.南阳同凯生物技术有限公司,南阳473000)
水/乙醇溶剂中阿奇霉素的热力学及多晶型研究
陈晓春1,黄小权1,2,陈长保1,2,付天松1,2
(1.南京工业大学生物与制药工程学院,南京211800; 2.南阳同凯生物技术有限公司,南阳473000)
在278.2~308.2 K温度范围内,测定阿奇霉素在水/乙醇混合溶剂中的溶解度,根据固液平衡理论建立了该体系的溶解度修正模型。采用X线粉末衍射法和差示扫描量热法,对阿奇霉素在不同温度、不同体积比的水/乙醇混合溶剂中得到的晶体进行鉴别。同时利用溶解度数据估算了阿奇霉素在水/乙醇体系中的溶解热(-25.26~-16.11 kJ/mol)、混合热(-9.94~-3.25 kJ/mol)。通过溶液化学理论推导了阿奇霉素溶剂化平衡常数K与活度系数γ2的方程:γ2=1/(1+K),建立了溶剂化焓与温度、水/乙醇两者体积比(φ)之间的关系式,为ΔH=RTln(17.86exp(3.4φ)-1)。采用溶析结晶方法得到的6种阿奇霉素晶体,均属单斜晶系,但具有不同的晶胞参数且其密度和熔点也不同。同时发现温度越高,水/乙醇体积比越大,得到的晶体稳定性越差(晶体的熔点和密度降低)。在水/乙醇混合溶剂的溶析结晶体系中,产生阿齐霉素多晶型的现象与溶剂化作用的强弱有关。
阿奇霉素;溶解度;多晶型;混合热;溶剂化平衡常数;溶剂化焓
近年来,随着药物多晶型在改善生物利用度及药效作用方面的发现,药物的多晶型研究受到了国内外的高度重视。阿奇霉素是第一个半合成氮杂15元环大环内酯类抗生素,由于具有半衰期长、给药次数少、疗程较短和不良反应发生率低等优势[1-2],在抗感染药物市场上一直是炙手可热的品种。目前,国内外关于阿奇霉素多晶型的研究仅局限于晶型的鉴别[3-6],对阿奇霉素指定晶型的定向制备过程以及不同晶型对药物溶出度、生物利用度影响的研究鲜有报道,因此对阿奇霉素多晶型制备过程的研究已迫在眉睫。
本文着手于阿奇霉素相平衡数据的测定及热力学研究,从溶剂化角度解释了水/乙醇混合溶剂中产生多晶型的可能原因,为阿奇霉素指定晶型的定向制备提供了理论依据,同时为阿奇霉素多晶型对药物生物利用度及药效的研究奠定基础。
1 实验方法
1.1 实验药品
阿奇霉素原料,上海现代制药股份有限公司;其他试剂均为市售分析纯。
1.2 实验仪器
X线粉末衍射仪,日本理学公司;DSC204差热分析仪,德国耐驰公司;JSM-5900型扫描电镜,日本电子公司。
1.3 实验方法
1.3.1 溶解度的测定方法
采用静态法测定溶解度,即在恒定温度、水/乙醇体积比等条件下将溶剂和过量溶质搅拌混合,经长时间溶解趋于平衡后,采用高效液相色谱法测定了278.2~308.2 K范围内,阿奇霉素在不同温度、不同比例下的水/乙醇混合溶剂中的溶解度。
1.3.2 阿奇霉素多晶型的制备
以热力学为基础,在相同的溶液浓度、pH、搅拌速度等条件下,溶析结晶得到6种不同温度和水/乙醇两者体积比(φ)下的阿奇霉素晶体,并采用X线粉末衍射法及差示扫描量热法对其进行了鉴定。
1.3.3 X线粉末衍射分析
在工作条件为2.2 kW铜靶Kα(λ=1.540 56)、固体探测器、扫描范围5°~80°、扫描速度10 (°)/min时。分别测定不同溶剂结晶得到的阿奇霉素多晶型的X线粉末衍射图。
1.3.4 差热和热重分析
分别称取不同溶剂结晶得到的阿奇霉素多晶型9~37 mg装入铝坩埚,保护气N2的气速为30 mL/min,升温范围为17~200 ℃,升温速率为10.0 K/min。分别测定DSC差示扫描量热曲线和TGA热重曲线。
1.3.5 扫描电镜表征
采用JSM-5900型扫描电镜观察不同溶剂结晶得到的阿奇霉素多晶型200~8 000倍的放大图并用数码相机拍下显微照片,观察比较。
1.4 检测方法
以pH=6.0的磷酸盐缓冲溶液为溶出介质,采用紫外-可见分光光度法测定,检测波长为482 nm。
2 结果与讨论
2.1 溶解度
在278.2~308.2 K范围内,测定阿奇霉素在不同温度、不同比例下的水/乙醇混合溶剂中的溶解度曲线,结果分别见图1和图2(图1中的B为初始结晶体积的倍数)。
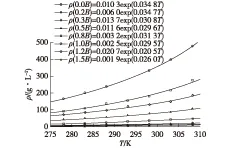
图1 阿奇霉素溶解度随温度的变化曲线Fig.1 Variation of solubility of azithromycin with different temperature
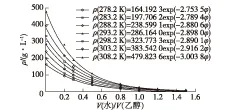
图2 阿奇霉素溶解度随水/乙醇体积比的变化曲线Fig.2 Variation of solubility of azithromycin with the ratio between water and ethanol
由图1和2可知:阿奇霉素在水/乙醇混合溶剂中的溶解度随温度升高而缓慢增大,这与阿奇霉素在溶液中的溶解为吸热过程相一致;另一方面,溶解度随水/乙醇体积比的增大而显著减小,其原因可能是混合溶剂的极性随纯水含量的增加而增加,根据相似相溶原理,弱极性物质阿奇霉素的溶解度也随之降低。对比可以发现,不同体积比的水/乙醇混合溶剂对阿奇霉素的溶解度影响较温度显著,所以在结晶体系的选择上优先考虑溶析结晶。
2.2 溶解度模型的建立
根据流体相平衡分子热力学理论[7-11],对固液二相共存物系,有普遍化的描述固液平衡溶解度方程
(1)
式中:γ2为溶质活度系数;x2为溶质摩尔分率;ΔHtp为融化焓(J/mol);ΔCp为定压比热容变化(KJ/(mol·K)));Ttp为熔点(K);p为压强(Pa);R为常数。当忽略压力和热容的影响,三相点温度用熔点替代时,方程可简化为
(2)
式中:ΔHmel为熔化焓(J/mol);Tmel为溶质的熔点(K)。
结合阿奇霉素溶解特性,推导出适合三元体系中溶质摩尔组分的计算公式,建立了适合该体系的溶解度模型,并计算相关结晶热力学数据。
在三元体系中,溶质的摩尔分数可表达为
(3)
式中:c为单位体积饱和溶液中各组分的物质的量(mol/L);下标1、2和3分别表示乙醇、溶质和水,其中
(4)
(5)
式中:ρ1、M1和ρ3、M3分别为无水乙醇、纯水的密度(g/cm)和摩尔质量(g/mol);V1和V3分别为乙醇和纯水混合前的体积(mL);f(T)为温度函数。
实验数据表明,在溶液体系中,溶质的摩尔浓度相对较低,因此式(3)可变形为
(6)
式中F(T,φ)为温度和水/乙醇体积比的函数。
在三元体系中,溶质的溶解必然会引起溶液体积的变化,特别是溶解度因溶液状态的差异而变化显著的物质,溶解过程中体积的变化是不可忽视的。一般来说,溶液体积的变化与溶液的状态有很大的关系,可表达为
(7)
式中:ΔV为溶质溶解过程中引起的体积变化量;V为溶液的总体积。
假设V3=V1φ,而V1+ΔV+V3=V,可得到:
(8)
(9)
式中φ为水/乙醇的体积比。
采用本实验自行设计的结晶器装置测得乙醇与纯水[12]在278.2~308.2 K下的密度ρ1、ρ3与 1/T的函数关系为:
ρ1=8.855×104/T+490.3
(10)
ρ3=3. 570×104/T+876.5
(11)
在278.2 ~308.2 K下,溶质引起的溶液体积变化程度由实验数据关联得到
(12)
综上所述,修正式F(T,φ)可表达为
(13)
根据固液平衡溶解度方程,建立了溶解度修正模型
(14)
采用非线性最小二乘法回归模型参数,回归结果如表1所示。
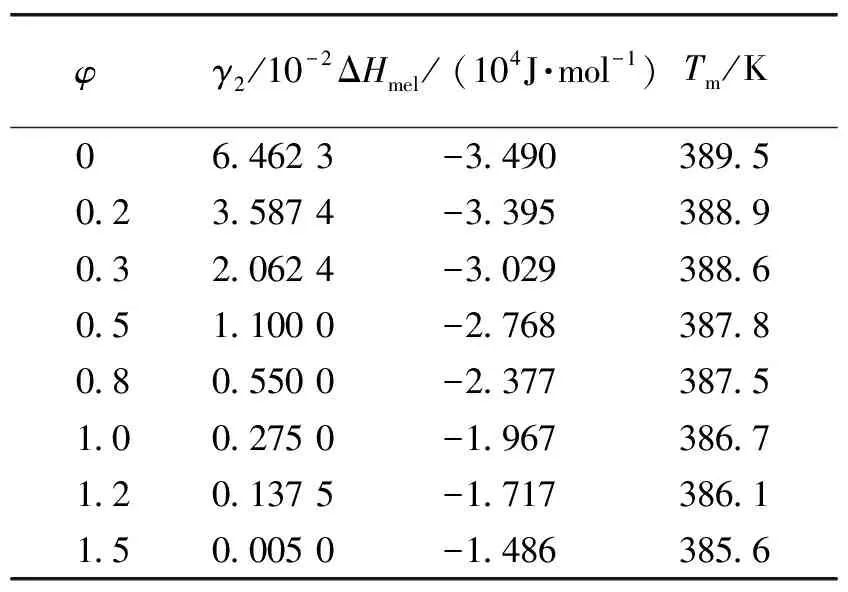
表1 模型参数回归结果表
由表1可知,模型回归得到的熔点范围为385.6~389.5 K,此范围与化工词典中的数据基本吻合(385.2~388.2 K)。采用溶质摩尔浓度为目标函数对模型进行评价,误差采用式(15)表示的平均百分比形式。
(15)
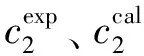
阿奇霉素在不同体积比的水/乙醇混合溶剂中溶解度回归结果误差分析及模型回归系数如表2所示。由表2中的模型回归系数(R2)可以看出,此修正模型适合该溶液体系,对溶解度数据关联效果较好。
2.3 阿奇霉素的多晶型现象及鉴别
众所周知,多晶型特征上的差异源于它们晶胞结构的不同。按照有机分子在形成晶胞时的不同方式,主要有以下2种形成机制[13]:填充多晶型和构象多晶型。此外,溶剂分子和溶质分子之间的相互作用而形成的溶剂化晶体,称为假多晶型现象。假多晶型现象在医药结晶中很常见[14-15],研究表明[16-19],药物的多晶型产生与药物分子结构有关,亦与结晶过程所用溶剂种类及组成、溶液浓度、温度及工艺条件等有密切的关系。同时晶型表现在晶体结构、密度、溶解度、熔点等方面的差异可用作为晶型的鉴别的依据。
国内外专利研究报道[3-6],阿奇霉素在不同水/有机溶剂体系中可以形成多晶型,并通过核磁共振分析,其光谱中具有相应的溶剂峰,目前对其结晶过程中操作条件对晶型的影响及机制研究未见报道。本论文实验得到6种的阿奇霉素晶体X线粉末衍射结果如图3所示。
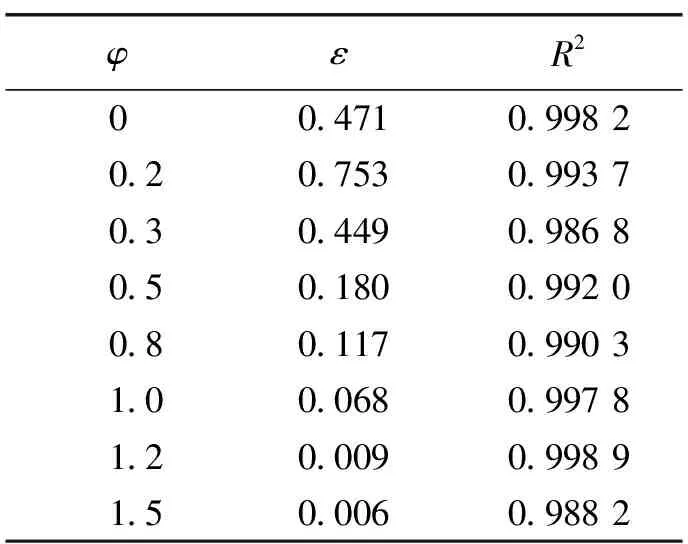
表2 阿奇霉素在不同溶剂溶解度回归结果误差分析
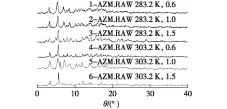
图3 阿奇霉素6种晶体X线粉末衍射对照图谱Fig.3 XRD patterns of six azihromycin crystals
从图3可知:6种晶体的主峰位置基本重合,衍射数据存在的差别,通过计算得到6种晶体均属单斜晶系,但具有不同的晶胞参数。
从图4阿奇霉素晶体差示扫描量热分析对照图可以看出,6种晶体在120.0~143.7℃有不同的熔点,且熔点差别明显,可作为专属性鉴别方法。
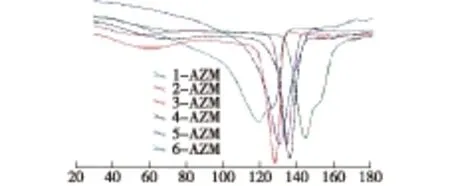
n-AZM表示在相同的外界条件下,温度和纯水/乙醇比分别为283.2 K、0.6;283.2 K、1.0;283.2 K、1.5;303.2 K、0.6;303.2 K、1.0和303.2 K、1.5时结晶得到的阿奇霉素晶体(下同)。图4 阿奇霉素6种晶体热分析(DSC)对照图Fig.4 DSC results of six azihromycin crystals
从表3可以看出,6种晶体均属单斜晶系,但具有不同的晶胞参数,且其密度和熔点也不同。同时发现温度越高,水与乙醇体积比越大,得到的晶体熔点和密度,稳定性越差。
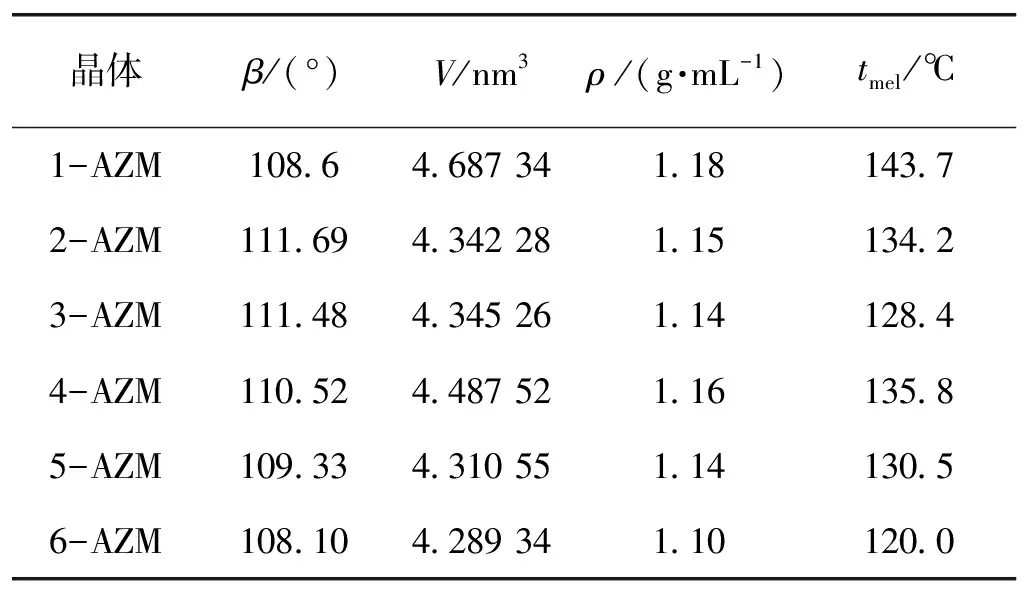
表3 6种晶体的结构和物化性质差别
注:β为晶胞的夹角;V为晶胞体积;ρ为晶胞密度;tmel表示晶体的熔点。
2.4 水/乙醇混合溶剂中多晶型形成机制初探
2.4.1 溶剂化与混合热
在固液平衡过程中,溶解度与溶解热ΔHsol(J/mol)的近似关系为
(16)
式中c2ti表示ti时刻溶质的摩尔浓度。而溶解热、混合热及熔化热存在以下关系:
(17)
式中下标sol和mix分别表示溶解和混合。
应用溶解度数据估算阿奇霉素的溶解热,比较模型回归得到的熔化热,可得阿奇霉素在不同体积比的水/乙醇混合溶剂中的混合热,结果见表4。
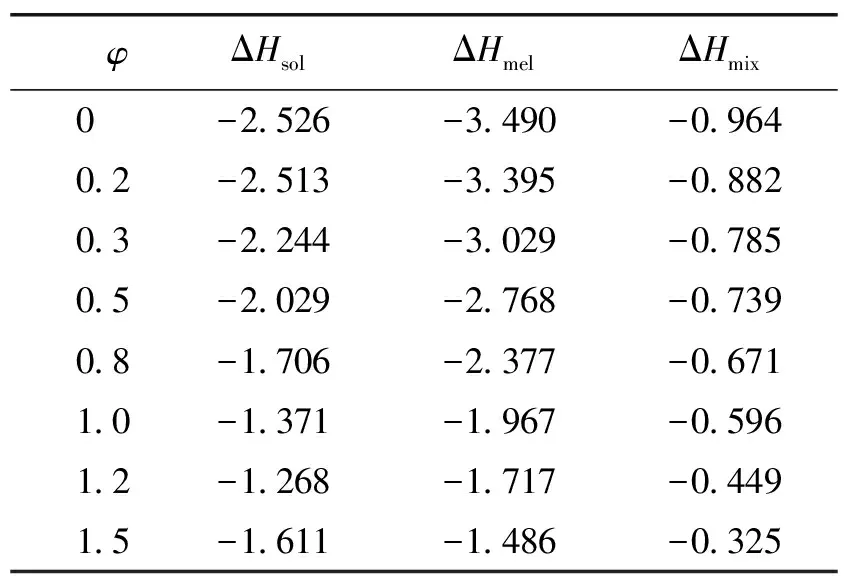
表4 阿奇霉素在水/乙醇混合溶剂中的混合热
由表4可知混合热为负值,表明阿奇霉素在水/乙醇混合溶剂呈负偏差,发生了溶剂化作用,并且随着水/乙醇体积比的升高其溶剂化作用相应减弱。
2.4.2 溶剂化常数与活度系数
在水/乙醇混合溶剂中,根据溶液化学理论[10],阿奇霉素溶剂化作用示意图如下:
AZM+nB=(AZM)Bn
(18)
式中:B和(AZM)Bn分别为混合溶剂和阿奇霉素溶剂化物;n为系数。
由实验数据可得,阿奇霉素摩尔分数很小(x2<0.01),混合溶剂摩尔分数近似为1,故溶剂化过程中的平衡常数K为
(19)
存在溶剂化作用的溶液中:
(20)
(21)
式中ysolv、y((AZM)Bn)、y2分别表示水/乙醇混合溶剂、(AZM)Bn、溶质真实摩尔分数。
根据式(19)~ 式(21)可得到如下活度系数与溶剂化平衡常数K之间关系式:
(22)
实验条件下的阿奇霉素摩尔分数很小,式(22)可简化为
(23)
2.4.3 溶剂化焓
溶剂化过程中,溶剂化平衡常数K与温度的关系为
ΔH=RTlnK
(24)
式中ΔH为溶剂化焓(J/mol)。
将拟合出的γ2值,采用指数函数关联φ得到
(25)
由式(23)~式(25)可得溶剂化焓与温度和纯水含量的关系如图5所示,关系式为
ΔH=RTln(17.86exp(3.4φ)-1)
(26)
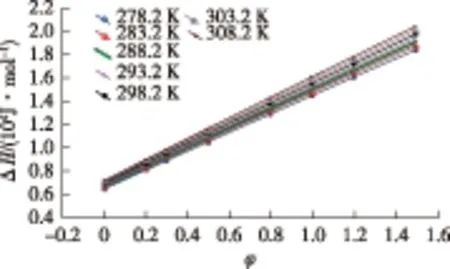
图5 阿奇霉素溶剂化焓随水/乙醇体积比 和温度的变化图Fig.5 Solvability of azithromycin vs.the volume ratio of ethanol to water and temperature
由图5可以看出,溶剂化焓随温度和乙醇-水混合溶液中水的体积比增加而升高,所以在高温及水/乙醇体积比较大的情况下不利于阿奇霉素的溶剂化,得到的阿奇霉素溶剂化物不稳定,熔点较低,由于溶剂化作用的减弱,晶体晶腔中溶剂化数量和比例的相应降低,晶体的密度也随之下降,这与上述实验结果较吻合,因而说明了在不同温度、不同体积比的水/乙醇混合溶剂中,阿奇霉素多晶型的产生的与阿奇霉素溶剂化作用的强弱有关。
3 结 论
1)测定了278.2~303.2 K下阿奇霉素在不同体积组成的水/乙醇混合溶剂体系中的溶解度,建立了该体系的溶解度修正模型,并采用误差分析对模型进行了评价,关联效果较好。
2)在不同温度、不同体积比的水/乙醇溶剂结晶得到了阿奇霉素6种晶体,通过鉴别证实了阿奇霉素多晶型的存在。
3)根据阿奇霉素在不同的水/乙醇溶剂中产生多晶型的机制,应用溶液化学理论推导了溶剂化平衡常数表达式,利用溶解度数据估算了熔化热,溶解热、混合热、活度系数,建立了阿奇霉素溶剂化焓与温度、水/乙醇混合溶剂体积比之间的关系方程。尝试从溶剂化作用角度解释阿奇霉素在不同温度,不同体积比的乙醇和水混合溶剂中产生多晶型的可能机制与溶剂化作用的强弱有关。
[1] 马庆亮,张德运.阿奇霉素的药理与临床[J].工企医刊,2004,17(2):104.
[2] 王修性,王奕,郑晓波.阿奇霉素的药理作用和临床应用[J].中国药业,2002,11(10):59-60.
[3] Karimian K,Motamedi M.Azithromycin monohydrate isopropanol clathrate and methods for the manufacture thereof:EP,0984020[P].2002-07-24.
[4] 殷殿书.一种阿齐霉素结晶及其制备方法:中国,1161971[P].1997-10-15.
[5] Claude S,Judith A.Ethanolate azithromycin,process for manufacture,and pharmaceutical compositions thereof:WO,2000032203[P].2000-06-08.
[6] 李征,特拉斯克.阿奇霉素的晶形:中国,1780847[P].2006-05-31.
[7] 朱自强,姚善泾,金彰礼.流体相平衡原理及其应用[M].杭州:浙江大学出版社,1990.
[8] 黄承遇,陈钟秀,顾飞燕.化工热力学[M].北京:化学工业出版社,1990.
[9] Walas S M.Phase equilibrium in chemical engineering[M].Stoneham:Butterworths Publishers,1985.
[10] 骆赞椿,吕瑞乐,刘国杰,等.流体相平衡的分子热力学[M].北京:化学工业出版社,1990.
[11] 陈敏恒,丛德滋,方图南,等.化工原理[M].北京:化学工业出版社,2000.
[12] 王勤波,徐海波,李希.对苯二甲酸结晶热力学研究[J].化学工程,2006,34(4):32-34.
[13] Vippagunta S R,Brittain H G,Grant D J W.Crystalline solids[J].Adv Drug Deliv Rev,2001,48(1):3-26.
[14] Byrn S,Pfeiffer R,Ganey M,et al.Pharmaceutical solids:a strategic approach to regulatory considerations[J].Pharm Res,1995,12(7):945-954.
[15] Borka L.Review on crystal polymorphism of substances in the European pharmacopoeia[J].Pharm Acta Helv,1991,66(1):16-22.
[16] Bauer-Brandl A.Polymorphic transitions of cimetidine during manufacture of solid dosage forms[J].Int J Pharm,1996,140:195-206.
[17] Gohary A O,Fada N,Shafie A F,et al.Indentification of polymorphs of fluvoxamine maleate[J].Pharmazie,1994,49(8):592-594.
[18] Carlton R A,Difeo T J,Powner T H,et al.Preparation and characterization of polymorphs for an LTD4 antagonist,RG 12525[J].J Pharm Sci,1996,85(5):461-467.
[19] Pirttimäkia J,Laine E,Ketolainen J,et al.Effects of grinding and compression of crystal structure of anhydrous caffeine[J].Int J Pharm,1993,95(1/2/3):93-99.
(责任编辑 荀志金)
Polymorphism and thermodynamic of azihromycin in mixed water-ethanol solvent
CHEN Xiaochun1,HUANG Xiaoquan1,2,CHEN Changbao1,2,FU Tiansong1,2
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China; 2.Nanyang with Kay Biotechnology Co. Ltd.,Nangyang 473000,China)
The solubility of azithromycin in water-ethanol solvent was measured by the static method between 278.2 and 308.2 K.A modified general solubility model was established based on the solid-liquid equilibrium theory.The polymorphs of azithromycin prepared in the mixed solvent with different ratio of water to ethanol under different temperatures were identified by X-ray diffraction (XRD) and differential scanning calorimetry(DSC).The dissolution heat (-25.26--16.11 kJ/mol) and the mixing heat (-9.94--3.25 kJ/mol) of azithromycin were estimated from the solubility experimental data.The relationship between the activity coefficient γ2and the solvation constantKof azithromycin was deduced as follows:γ2=1/(1+K). An expression correlating the solvation enthalpy with the temperature and the volume ratio of water and ethanol (φ) in the mixed solvent was established according to theory of the solution chemistry (ΔH=RTln(17.86exp(3.4φ)-1)).Six crystals of azithromycin obtained by the anti-solvent crystallization belong to clinorhombic system,but with different cell parameters,density and melting point.It was also observed that stability of the azithromycin crystal become weaker (the melting point and the density of crystals decreased) as the temperature and the ratio of water to ethanol in mixed solvent increased.As conclusion,in the water-ethanol anti-solvent crystallization system,the formation of azihromycin polymorphism could be related with the solvation interactions.
azithromycin;polymorphism;solubility;salvation constant;solvation enthalpy
10.3969/j.issn.1672-3678.2014.06.016
2013-04-16
国家高技术研究发展计划(863计划)(2012AA021201)
陈晓春(1981—),男,江苏启东人,博士,助理研究员,研究方向:结晶生物化工,E-mail:cxc_1981@163.com
TQ4
A
1672-3678(2014)06-0084-06

