合成气厌氧发酵生物反应器的研究进展
宋安东,张炎达,杨大娇,谢 慧,王风芹
(河南农业大学生命科学学院农业部农业微生物酶工程重点实验室,郑州450002)
合成气厌氧发酵生物反应器的研究进展
宋安东,张炎达,杨大娇,谢 慧,王风芹
(河南农业大学生命科学学院农业部农业微生物酶工程重点实验室,郑州450002)
对合成气厌氧发酵生物反应器的研究进展进行综述,包括生物反应器操作原理、类型、构造、应用和对发酵过程的影响等,并对其未来的发展作出展望。
合成气;厌氧发酵;生物反应器
随着全球人口不断增加和工业化的不断扩大,世界各国对能源的需求剧增。据报道,20世纪以石油和煤炭为主要能源的消耗速率增长了17倍,石油和煤炭的开采与消耗加大了资源与能源匮乏的程度,按此消耗速度,预计今后50年内世界储备的石油将被耗竭[1-2],同时已造成了显著的环境问题,这就使得人们迫切需要寻求一种环境友好且可持续的再生能源。
我国是一个农业大国,植物纤维资源十分丰富,仅农作物秸杆每年产量就达7亿t,相当于3.5亿t标准煤,开发利用潜力巨大。目前,大量秸秆资源的不合理和低品位利用导致资源浪费和环境污染。秸秆资源经济合理化利用是实现我国由传统农业向现代农业转变的重要保证之一,其中,秸秆乙醇转化技术被认为是缓解我国液体燃料紧张和短缺的有效途径。
生物质气化合成燃料是利用生物质能的一种有效途径。生物质合成气发酵燃料乙醇,先利用气化装置将生物质气化得到合成气,再通过微生物发酵将其转化为乙醇。农林生物质气化可在不完全燃烧的条件下,使较高相对分子质量的有机碳氢化合物链断裂,变成较低相对分子质量的H2、CO和CH4组成的合成气[3]。组成成分(体积分数)有很大差别:H232%~67%、CO 10%~57%、CO22%~28%、CH40.1%~14%、N20.6%~23%。另外,来自于煤、石油和有机废物等的气化气也是一种重要的合成气资源[4-8],还有一部分合成气来自于炼钢厂的工业废气。对合成气的厌氧发酵能够获取洁净的燃料,如燃料乙醇、燃料丁醇,还能生产其他化学品,如乙酸、丁酸和脂肪酸等[9-16],这些生物燃料和化学品的生产将有利于解决上述问题。与合成气化学转化相比,合成气厌氧发酵技术具有反应温和、低能耗、产物专一的优点,且具有较强的毒性耐受能力及无需固定的CO与H2比例[17]。这都将使得合成气厌氧发酵在未来的发展与应用上更具有潜力和竞争力,日益受到人们的重视。
尽管合成气厌氧发酵在转化生物燃料和化学品方面具有多种优点和积极性,但是仍存在制约其进一步发展的瓶颈问题,主要包括气液传质限制、低细胞密度和合成气组分对酶具有抑制作用3个方面。其中气液传质已被报道成为影响合成气厌氧发酵过程中的主要限制因素,尤其是在高菌体密度厌氧发酵中的影响更为突出[18-20]。反应器是微生物发酵的载体和平台,在生物反应过程中发挥核心作用,也是实现产业化的关键设备。在合成气厌氧发酵中,一个良好的生物反应器不仅可以提高气液传质效率,还能显著增加产量。目前,已被报道的各种类型的生物反应器不断增多[21-22],而对于生物反应器的选择主要集中在气液传质、底物利用和产量获得三方面。新型生物反应器的设计和开发推动着合成气厌氧发酵向前快速发展,有利于商业化模式的实现。本文中,笔者对合成气厌氧发酵生物反应器的研究进行综述,重点介绍生物反应器操作原理、类型、构造、应用和对发酵过程的影响。
1 反应器操作原理
合成气厌氧发酵过程中,生物反应器中质量传递过程主要是气-液传递,即厌氧微生物发酵反应过程中合成气气体的传递。同时在完全混合的液体培养基质中,合成气传递过程的主要阻力来自于围绕合成气气泡周围液膜的传递阻力,必须通过各种方法提高反应体系间的气液体积传质系数(KLa)[21]来提高合成气组分的传递速率,进而获得更大的发酵反应效率。无论是传统生物反应器还是新型生物反应器,提高细胞密度、增强传质和基质高效转化是其结构设计与实际应用的主要目的。合成气厌氧发酵生物反应器主要通过机械搅拌、气体搅拌及气体经过载体细胞扩散或固定化等技术方法使得合成气在厌氧反应体系获得更大气液传质面积,并延长体系内的存在时间,进而提高合成气组分与反应细胞的接触和转化利用效率。
2 生物反应器类型
多种类型的生物反应器目前已经在合成气厌氧发酵实验与生产中得到了应用。根据生物反应器的结构特征和反应器内部物料混合方式,大致将生物反应器归类为机械搅拌槽式生物反应器、气体搅拌塔式生物反应器、固定床式生物反应器和膜生物反应器4种类型。各类生物反应器构造简图如图1所示。
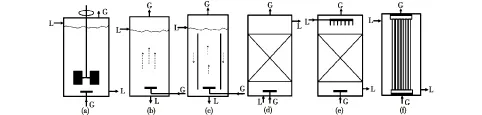
a—机械搅拌槽生物反应器;b—鼓泡塔生物反应器;c—气升式生物反应器;d—填充床生物反应器;e—滴流床生物反应器;f—中空纤维膜生物反应器;L—液体基质,G—合成气图1 生物反应器构造简图Fig.1 Schematic diagram of various bioreactors configurations
2.1 机械搅拌槽式反应器
机械搅拌槽式生物反应器主要包括搅拌槽反应器(STR)和连续搅拌槽反应器(CSTR)2种,是生物反应过程中应用最多的传统反应器。该类生物反应器构造较为复杂[22],如图1(a)所示。机械搅拌槽式生物反应器在合成气厌氧发酵中主要通过机械搅拌装置(搅拌器)和合成气通入压缩装置提供动力。同时,在合成气厌氧发酵过程中操作弹性大、易控、适应性强,但反应器结构复杂、剪切力大、运行能耗高、也容易导致发酵杂菌污染,所以在一定程度上限制了该类生物反应器在工业规模上的应用。STR,特别是CSTR,在发酵中不断通入合成气气体,微小的气泡传递到厌氧生产菌,为微生物的生存和生长提供了必要的C源。同时,液体基质连续地从反应器中添加和移除,增加了营养物质,减少了产物的抑制[23-24]。
2.2 气体搅拌塔式反应器
2.2.1 鼓泡塔反应器
鼓泡塔生物反应器(BCR),如图1(b)所示,是以气体为分散相、液体为连续相的一种气体搅拌的塔式生物反应器。该类生物反应器因未安装机械搅拌装置,所以相比机械搅拌槽式生物反应器结构简单。此类反应器具有较大的高径比(一般大于5∶ 1),在合成气厌氧发酵过程中通入合成气是向其输入能量的主要途径,而合成气的通气速率成为合成气厌氧发酵操作的主要变量。在BCR内无可移动部件,易密封,同时传质速率较快,所以该类生物反应器的资本与操作成本较低,而且还可以获得较高的合成气气体传递速率[25],被认为是替代传统STR的选择。为此,Rajagopalan等[26]曾利用4.5 L的连续鼓泡塔式生物反应器以合成气(CO、CO2和H2)为底物培养Clostridiumljungdahlili发酵获得更高产量的乙醇、丁醇和乙酸。目前,为进一步提高和改善BCR的传质和混合效率,在塔内装有若干筛板,多孔筛板的作用在于阻截气泡,使之在板下方聚集为气层,然后气体经过筛板又重新分散为小气泡,这样在反应器内多次重复,能延长气体与培养基质的直接接触时间并降低液膜阻力。所以, BCR能在相对较低的能耗下具有较高的气体传递速率。
2.2.2 气升式反应器
气升式生物反应器(ALR),如图1(c)所示,是在BCR的基础上发展而来。该类生物反应器主要依靠气体的喷射功能和液体基质密度差而形成反应体系的循环流动,进而实现液态基质的搅动、混合和气体底物的传递。有研究报告指出安装有20 μm孔径的气泡扩散器的ALR的KLa比搅拌槽反应器(STR)的KLa大[21]。ALR和BCR一样,气体通气量也是该反应器操作的主要变量。由于反应器内不含机械搅拌装置,进而剪切力小,已是一种广泛应用的生物反应器。现在已应用的ALR主要包括外循环和内循环2种类型。
2.3 固定床式反应器
2.3.1 填充床反应器
填充床反应器(PBR),又称为固定化细胞反应器,见图1(d),该类反应器内部装有可吸附固定微生物细胞的生物催化颗粒[27]。在PBR操作中,液体基质和气体同向流动并通过静止不动的固定化生物催化剂的床层[28]。液体基质通过床层空隙进行流动,床层压力降较大。由于该反应器体系中微生物细胞被吸附固定,所以反应器内床层具有较高的细胞密度并且细胞易于回收再利用。然而,细胞被固定后气体传质部分受到阻碍,同时床层内可能存在反应物系的扩散,对反应形成限制,这些都使得PBR内气体基质难以传质到微生物细胞上,尤其是不同类组分的传质,进而导致PBR在合成气厌氧发酵中的应用受到较大限制。
2.3.2 滴流床反应器
滴流床反应器(TBR)是一种包含气液固三相的固定床式反应器,也是一种可以用于各种气体处理的常用反应器,见图1(e)。TBR和PBR结构上较为相似,实际应用中TBR主要分为并流式与逆流式2种。在该类反应器中,微生物细胞可固定在固体填充物上,液态基质则以较小的流量自上而下流动,并在固定化细胞表面形成液膜,同时气体以并流或逆流的方式连续经床层空隙进行流动,固定化颗粒未被液体基质完全浸没,这也是TBR与PBR的重要区别。在合成气厌氧发酵中,影响其传质的主要参数有填料大小、液体基质流动速率和合成气气体流动速率,即固定化颗粒床层的表面积和其被下降液体基质所湿润的程度以及气液的流动模型。然而逆流式TBR比并流式TBR在实践中可以获得更大的KLa,Bredwell等[29]研究发现,利用逆流式TBR获得CO气体的KLa值高达137 h-1,而且比STR的还要高[19]。所以在合成气厌氧发酵应用中,逆流式TBR[30]使用相对较广。然而,由于生产中反应器条件操作难于调控,且微生物细胞生长易导致反应器堵塞[31],该类反应器应用也较少。
2.4 膜生物反应器
中空纤维膜生物反应器(HFMBR),见图1(f),是近来被认为具有潜力和吸引力的新型生物反应器[4,32]。它是将膜与反应器组合成一个反应分离的单元设备,在发酵生物反应过程中引进膜技术,可以通过有效利用膜功能来强化发酵过程。HFMBR总体分为膜组件和反应器两大部分,内部设有一段封闭区域,且该封闭区域内装有多根并列的中空纤维膜。近来,Coskata公司寻找到利用HFMBR将CO气体生物转化为乙醇的新技术并申请了专利[33-36]。膜在该类生物反应器中只起到分离和微生物细胞载体的作用,同时也是气液两相的分离界面。在合成气厌氧发酵过程中,采用中空纤维膜作为反应微生物的生长载体,能够增加气液面积、促进传质、改善合成气的利用效率。在HFMBR内,反应器内部装有中空纤维,微生物细胞在膜外挂膜吸附并不断生长形成一层包绕在纤维膜外的稳定生物膜(主要是细胞体与大分子胞外聚合物及营养物质的絮状体)。液体基质由反应器的一端加压进入壳程内,另一端装有培养基循环装置,气体或合成气由低端进气口以一定流速通入中空纤维,然后从出气孔排出,液体基质和透过膜的气体为微生物细胞提供营养,不断进行发酵反应,生成的产物能够进入液体基质中[13];另外一种类型是液体基质流经中空纤维内部,气体或合成气在反应器壳程内循环流动,液体基质经透膜作用后传质到微生物细胞,而气体或合成气直接与微生物细胞接触,发酵产物再经透膜作用进入中空纤维内部的液体基质内完成分离[11,37]。HFMBR能够减少产物抑制,增大反应速率,将微生物细胞截留在反应器内部,可以进行反复利用,进而有利于下游的产物分离和节约能耗,但如何增大细胞密度和增加细胞挂膜强度是该类生物反应器的关键。
3 不同反应器的应用及对发酵过程的影响
3.1 反应器的应用
反应器的构造决定了反应器的应用,不同构造的反应器因为自身固有属性的限制使得反应器都有利于自身操作的适用对象和范围。
在实验和生产中,机械搅拌槽式生物反应器适用于低黏性流体反应及高黏性流体反应;气体搅拌塔式反应器适用于低黏性流体反应,其中PBR和TBR需要微生物细胞的吸附和固定化;同样, HFMBR也适用于低黏性流体反应。合成气厌氧发酵是一个气液固三相的生物催化反应过程,近年来,有关不同生物反应器在该过程中应用的报道不断增多,特别是HFMBR等一类的新型生物反应器。就目前所报道的内容来看,其在实践中的应用主要集中在利用生物质合成气、煤气化合成气、工业废气和单纯气体(如CO)等发酵生产乙醇、乙酸、丁醇、丁酸、氢气和甲烷等。Ahmed等[38]研究了由菌种ClostridiumcarboxidivoransP7T在STR反应器中利用生物质合成气(16.5%CO、15.5%CO2、5%H2、56%N2、4.5%CH4等)发酵产乙醇,获得0.75 g/L的乙醇。同时,Rajagopalan等[26]利用CO气体将发酵菌株C.carboxidivoransP7在BCR中催化反应获得乙醇、丁醇和乙酸,且每消耗1 mol CO可分别转化0.15、0.075和 0.025 mol乙醇、丁醇和乙酸。另外,Zhang等[13]运用新型的HFMBR研究了厌氧微生物利用合成气(H2和CO2)合成中链脂肪酸,并分别获得7.4 g/L乙酸、1.8 g/L丁酸、0.98 g/L己酸和0.42 g/L的辛酸。在合成气厌氧发酵实际过程中,不同类型生物反应器因为存在构造差异,发酵过程中对基质的KLa也各不相同,KLa值的大小往往又能用来反向衡量和比较各个生物反应器在不同类型发酵体系中使用的优劣状况。笔者总结了部分不同生物反应器在合成气厌氧发酵中的实际应用情况与KLa值(表1)。

表1 合成气厌氧发酵生物反应器的应用与KLa
注:“—”表示“无”。
3.2 不同反应器对发酵过程的影响
目前,各类生物反应器已经在合成气厌氧发酵实验或生产中得到了不同程度的应用。
气体搅拌塔式生物反应器以通气作为操作动力,与传统的机械搅拌槽式生物反应器相比,结构简单。在该类生物反应器中,气液传递系数与气泡大小有关,流体混合强度和气体流速相关,在一定气体流速范围内,KLa值与气体流速大小直接关联。BCR通过塔体底部的气体分布器向液体基质中进行通气,所以气液传质速率主要取决于气体通入的速率和气泡尺寸的大小。在生产实践上,可通过增大气体通入速率来提高气液的传质水平。在该类反应器中,可以采用较大的高径比和通气量,甚至安装若干筛板,以此来改善和提高反应器内部的传质与混合效率。ALR是在BCR的基础上发展起来的。对于该类反应器,升液管和降液管内流体产生循环流动,一方面由通气速率造成其密度差所驱使,另一方面受到升液管和降液管的横截面积变化的影响;同时,发酵过程中如果流体流速分布不均,存在漩涡,再加上流体循环次数不断增加,反应器内部也会造成流体的宏观混合(即返混)。
TBR和PBR都属于固定床式反应器。在合成气厌氧发酵中,微生物细胞被固定在填充物上,液体基质和气体基质缓慢流经颗粒空隙,加之合成气组分溶解度小而使其传递速率较低。反应器内部的颗粒大小在一定程度上对发酵影响较大。同时,反应过程中底物和产物因受填充物分布的影响存在轴向浓度分布,易产生沟流或旁流,这些都不利于气液传质作用。在大规模生产中,床层温度和pH等也存在不易控制的难题。然而,对于TBR来说,反应器内的气液流行接近平推流,返混程度小且一般不存在液泛;填充剂表面的充分湿润和液膜较薄,其传质阻力也相对较小。
HFMBR在一定程度上有效改善了由于合成气组分微溶解性而影响生物转化效率的瓶颈问题。在HFMBR中,膜表面较高特异性的交换域能促进提高KLa,增大产物产生速率,进而减少了资本投入[14,43]。同时,稳定的生物膜对一定的外界环境压力具有适应能力,不仅能够保持缓慢的生长速率,而且还能减轻甚至避免反应器内部流体对微生物细胞的冲刷作用[32,43],可承受较强的冲击负荷。然而,对HFMBR来说,仍然存在许多问题,比如如何加快发酵微生物的生长及挂膜和如何延长膜的使用寿命等。
综上所述,在合成气厌氧发酵实验或生产中,各类生物反应器已经得到了不同程度的使用。由于生物反应器的构造和操作条件的差异,会产生不同的发酵过程效应及影响,进而对不同的合成气厌氧发酵体系也具有相对关系的选择性和适用性。所以,为进一步加深对不同类型生物反应器在合成气厌氧发酵体系中应用的认识和理解,现总结并比较了不同合成气厌氧发酵生物反应器的性质,如表2所示。
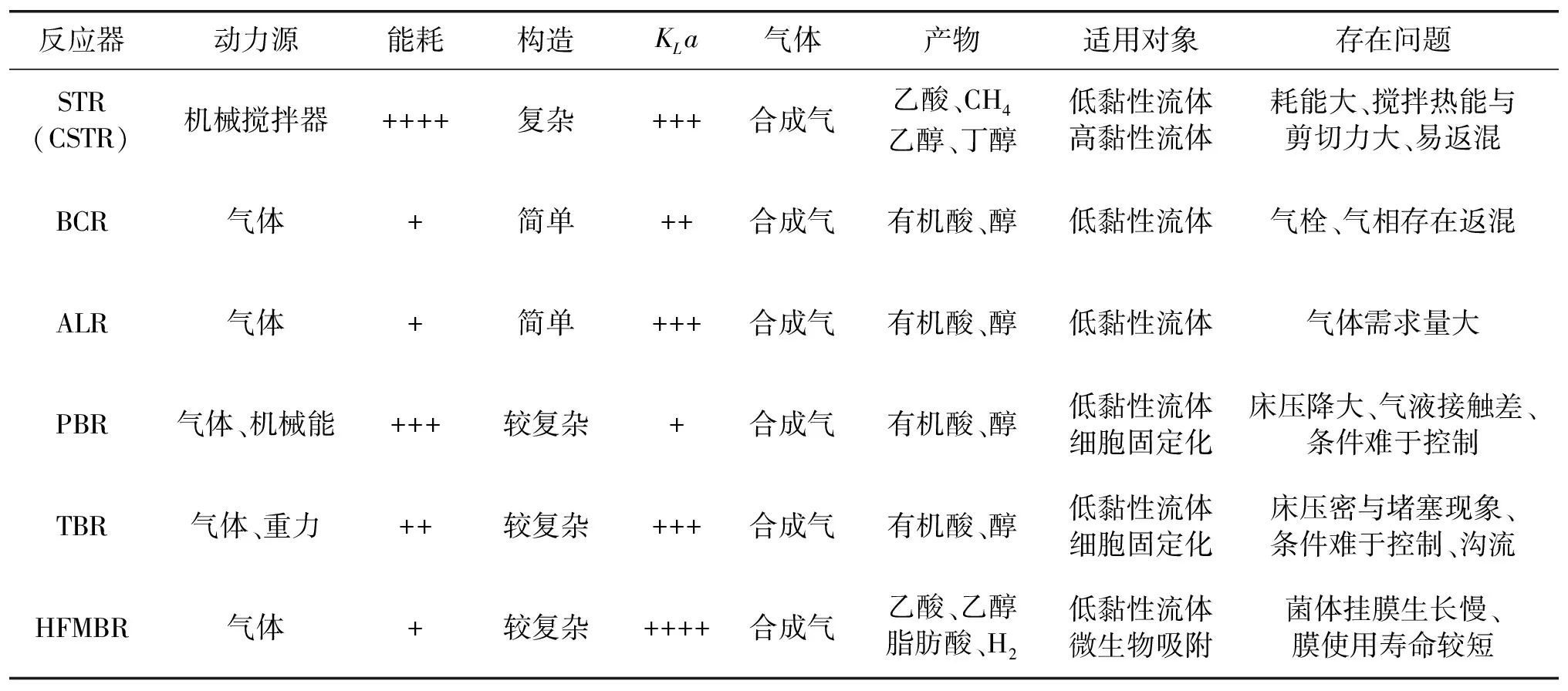
表2 合成气厌氧发酵生物反应器性质比较
注:“+、++、+++、++++”分别表示程度或大小依次增大。
4 展 望
合成气厌氧发酵能够获得液体燃料和基础化学品,如乙醇、乙酸、丁醇、丁酸和脂肪酸等。尤其是乙醇和丁醇,无论是在经济上还是能源战略上都具有重要意义,而目前国内在该方面的研究还较为薄弱。我国是农业大国,生物质资源丰富,且每年农林废弃物与生活生产废弃物数量巨大,如果这些资源经过气化,并将之合理利用于合成气厌氧发酵技术,将会成为一条利国利民的可持续发展道路。目前,合成气发酵还处于实验室研究阶段,离真正实现工业化和商业化还有一段距离。究其原因,气液传质效率低下已成为阻碍该技术发展的一大显著因素。因此,为解决上述难题,生物反应器的进一步研究和设计将成为关键。
目前,合成气厌氧发酵生物反应器的国内外研究主要集中在机械搅拌槽式生物反应器、气体搅拌塔式反应器、固定床式反应器和中空纤维膜生物反应器等4种类型。不同构造的反应器在合成气厌氧发酵操作中存在不同的缺陷,如能耗高、运行繁琐、传质速率低、气体需要量大和产物浓度低等,这就需要更深入系统地进行生物反应器的研究和设计。因而,今后可以围绕以下几个方面展开工作:①全面掌握各种生物反应器的动力学参数及模型,为完善设计生物反应器提供基础理论依据;②发展多级联用混合反应器;③设计发酵-分离耦合反应器;④研发新一代膜式生物反应器及新型膜组件。另外,有研究指出微泡生成分布器、亲和合成气组分的纳米粒子和细胞循环系统在合成气厌氧发酵反应器中得到了应用,获得了良好的效果,但三者在实际应用中还有很大的改进空间,这对未来反应器性能的提高与优化具有十分重要的意义。
[1] Demirbas A.Progress and recent trends in biofuels[J].Progress in Energy and Ecombustion Science,2007,33(1):1-18.
[2] Demirbas A.Progress and recent trends in biodiesel fuels[J].Energy Conversion and Management,2009,50(1):14-34.
[3] 孟凡生,阴秀丽,蔡建渝,等.燃用生物质气化气的内燃机特性分析[J].农业工程学报,2008,24(8):104-108.
[4] Munasinghe P C,Khanal S K.Biomass-derived syngas fermentation into biofuels:opportunities and challenges[J].Bioresource Technology,2010,101(13):5013-5022.
[5] Gaddy J L.Biological production of ethanol from waste gases withClostridiumljungdahlii:US,6136577[P].2000-10-24.
[6] Phillips J R,Klasson K T,Clausen E C,et al.Biological production of ethanol from coal synthesis gas[J].Applied Biochemistry and Biotechnology,1993,39(1):559-571.
[7] Vega J L,Prieto S,Elmore B B,aet al.The biological production of ethanol from synthesis gas[J].Applied Biochemistry and Biotechnology,1989,20(1):781-797.
[8] Kent H S.Biofuels in the US challenges and opportunities[J].Renewable Energy,2009,34(1):14-22.
[9] Michael K,Christophe M,Jason C B,aet al.Fermentative production of ethanol from carbon monoxide[J].Current Opinion in Biotechnology,2011,22(3):320-325.
[10] Maddipati P,Atiyeh H K,Bellmer D D,et al.Ethanol production from syngas byClostridiumstrain P11 using corn steep liquor as a nutrient replacement to yeast extract[J].Bioresource Technology,2011,102(11):6494-6501.
[11] Mark R W,Hasan K A.Microbial production of ethanol from carbon monoxide[J].Current Opinion in Biotechnology,2011,22(3):326-330.
[12] Zhao Y,Haddad M,Cimpoia R,et al.Performance of a carboxydothermus hydrogenoformans-immobilizing membrane reactor for syngas upgrading into hydrogen[J].International Journal of Hydrogen Energy,2013,38(5):2167-2175.
[13] Zhang F,Ding J,Zhang Y,et al.Fatty acids production from hydrogen and carbon dioxide by mixed culture in the membrane biofilm reactor[J].Water Research,2013,47(16):6122-6129.
[14] Henstra A M,Sipma J,Rinzema A,et al.Microbiology of synthesis gas fermentation for biofuel production[J].Current Opinion in Biotechnology,2007,18(3):200-206.
[15] 袁浩然,陈新德,陈勇,等.合成气合成低碳醇热力学及试验研究[J].农业工程学报,2011,27(12):297-301.
[16] 朱灵峰,杜磊,李新宝,等.秸秆合成气合成甲醇的动力学研究[J].农业工程学报,2008,24(6):36-40.
[17] Klasson K T,Ackerson C M D,Clausen E C,et al.Biological conversion of synthesis gas into fuels[J].International Journal of Hydrogen Energy,1992,17(4):281-288.
[18] Haris N A,Marí C V,Christian K.Biological conversion of carbon monoxide:rich syngas or waste gases to bioethanol[J].Biofuels,Bioproducts and Biorefining,2011,5(1):93-114.
[19] Meyer C L,McLaughlin J K,Papoutsakis E T.The effect of CO on growth and product formation in batch cultures ofClostridiumacetobutylicum[J].Biotechnology Letters,1985,7(1):37-42.
[20] Ragauskas A J,Williams C K,Davison B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311(5760):484-489.
[21] Munasinghe P C,Khanal S K.Syngas fermentation to biofuel:evaluation of carbon monoxide mass transfer coefficient (KLa) in different reactor configurations[J].Biotechnology Progress,2010,26(6):1616-1621.
[22] Ungerman A J,Heindel T J.Carbon monoxide mass transfer for syngas fermentation in a stirred tank reactor with dual impeller configurations[J].Biotechnology Progress,2007,23(3):613-620.
[23] Ahmed A,White A,Hu P,et al.Ethanol from syngas microbial conversion[EB/OL].[2014-02-11].http://bioweb.sungrant.org/Technical/Biofuels/Technologies/Biofuels+from+Syngas/Ethanol+from+Syngas.
[24] Orgill J J,Atiyeh H K,Devarapalli M,et al.A comparison of mass transfer coefficients between trickle-bed,hollow fiber membrane and stirred tank reactors[J].Bioresource Technology,2013,133:340-346.
[25] Datar R P,Shenkman R M,Cateni B G,et al.Fermentation of biomass generated producer gas to ethanol[J].Biotechnology and Bioengineering,2004,86(5):587-594.
[26] Rajagopalan S,Datar R P,Lewis R S.Formation of ethanol from carbon monoxide via a new microbial catalyst[J].Biomass and Bioenergy,2002,23(6):487-493.
[27] Bailey J E,Ollis D F.Biochemical engineering fundamentals[J].Chemical Engineering Education,1976,10(4):162-165.
[28] Klasson K T,Ackerson M D,Clausen E C,et al.Bioconversion of synthesis gas into liquid or gaseous fuels[J].Enzyme and Microbial Technology,1992,14(8):602-608.
[29] Bredwell M D,Srivastava P,Mark W R.Reactor design issues for synthesis-gas fermentations[J].Biotechnology Progress,1999,15(5):834-844.
[30] Wolfrum E J,Watt A S.Bioreactor design studies for a hydrogen-producing bacterium[J].Biotechnology for Fuels and Chemicals,2002,100(98):611-625.
[31] Alonso C,Suidan M T,Sorial G A,et al.Gas treatment in trickle-bed biofilters:Biomass,how much is enough?[J].Biotechnology and Bioengineering,1997,54(6):583-594.
[32] Rittmann B E.The membrane biofilm reactor is a versatile platform for water and wastewater treatment[J].Environmental Engineering Research,2007,12(4):157-175.
[33] Tsais P,Datta R,Basu R,et al.Syngas conversion system using asymmetric membrane and anaerobic microorganism:US,20090215163A1[P].2012-12-11.
[34] Tsais P,Datta R,Basu R,et al.Stacked array bioreactor for conversion of syngas components to liquid products:US,008222026B2[P].2012-07-17.
[35] Tsais P,Datta R,Basu R,et al.Modular membrane supported bioreactor for conversion of syngas components to liquid products:US,008017384B2[P].2011-09-13.
[36] Hickey R,Basu R,Datta R,et al.Method of conversion of syngas using microorganism on hydrophilic membrane:US,007923227B2[P].2011-04-12.
[37] Munasinghe P C,Khanal S K.Syngas fermentation to biofuel:evaluation of carbon monoxide mass transfer and analytical modeling using a composite hollow fiber (CHF) membrane bioreactor[J].Bioresource Technology,2012,122:130-136.
[38] Ahmed A,Cateni B G,Huhnke R L,et al.Effects of biomass-generated producer gas constituents on cell growth,product distribution and hydrogenase activity ofClostridiumcarboxidivoransP7T[J].Biomass and Bioenergy,2006,30(7):665-672.
[39] Younesi H,Najafpour G D,Syahidah K,et al.Biohydrogen production in a continuous stirred tank bioreactor from synthesis gas by anaerobic photosynthetic bacterium:Rhodopirillumrubrum[J].Bioresource Technology,2008,99(7):2612-2619.
[40] Klasson K T,Ackerson M D,Ackerson E C,et al.Biological conversion of coal and coal-derived synthesis gas[J].Fuel,1993,72(12):1673-1678.
[41] Cowger J P,Klasson K T,Ackerson M D,et al.Mass-transfer and kinetic aspects in continuous bioreactors usingRhodospirillumrubrum[J].Applied Biochemistry and Biotechnology,1992,34(1):613-624.
[42] Chang I S,Kim B H,Lovitt R W,et al.Effect of CO partial pressure on cell-recycled continuous CO fermentation byEubacteriumlimosumKIST612[J].Process Biochemistry,2001,37(4):411-421.
[43] Hussain A,Guiot S R,Mehta P,et al.Electricity generation from carbon monoxide and syngas in a microbial fuel cell[J].Applied Microbiology and Biotechnology,2011,90(3):827-836.
(责任编辑 管 珺)
Research progress in bioreactors for anaerobic fermentation of syngas
SONG Andong,ZHANG Yanda,YANG Dajiao,XIE Hui,WANG Fengqin
(Key Laboratory of Enzyme Engineering of Agricultural Microbiology of the Ministry of Agriculture, College of Life Science,Henan Agricultural University,Zhengzhou 450002,China)
Research progress in bioreactors of syngas fermentation was reviewed,focusing on operating principle,types,structure,application and the effect in the fermentation process.Suggestions were also given to indicate areas where advances can be made.
syngas; anaerobic fermentation; bioreactors
10.3969/j.issn.1672-3678.2014.06.018
2014-03-22
教育部新世纪优秀人才支持计划(NCET-12-0695);河南高校青年骨干教师资助计划(2013GGJS-041)
宋安东(1972—),男,河南宜阳人,教授,博士后,研究方向:微生物能源工程、生物质转化与利用技术与工程,E-mail:song1666@126.com
TQ920.5; Q815
A
1672-3678(2014)06-0096-07

