基于脯氨酸理论提高枯草芽孢杆菌脂肪酶A的热稳定性
李晓彤,江 凌,2,胡 燚,朱丽英,徐 娴
(1.南京工业大学生物与制药工程学院,江苏 南京 210009;2.南京工业大学食品与轻工学院,江苏 南京 210009;3.南京工业大学理学院,江苏 南京 210009)
脂肪酶(Lipase,EC3.1.1.3)即三酰基甘油酰基水解酶,是一种特殊的酯键水解酶,可以在油水界面上催化油脂的水解反应,生成脂肪酸和甘油、甘油单酯或二酯[1-2]。脂肪酶通常被用于在非水相体系中催化油脂及其它一些水不溶性酯类的水解、醇解、酯化、转酯化以及酯类逆向合成等反应[3-5],由于其高效专一、反应条件温和等特点,已被应用于化工、食品、制药等领域[6]。
枯草芽孢杆菌(Bacillussubtilis)脂肪酶A(LipA)是最小的脂肪酶之一,属于α/β-折叠水解酶。2001年,Pouderoyen等[7]报道了LipA的晶体结构特征,这是第1个获得解析的芽孢杆菌脂肪酶晶体结构。晶体结构分析发现,LipA缺乏多数脂肪酶都具有的α-螺旋形成的“盖子结构”,因此,在油水界面和有机溶剂中都有催化活性,没有其它脂肪酶具有的“界面激活”效应[8]。并且,与其它脂肪酶的保守的五肽序列Gly-X-Ser-X-Gly不同,LipA的保守序列为Ala-X-Ser-X-Gly(Ser参与组成活性中心催化三联体),这一结构特征与真菌(Candidaantarctica)脂肪酶 B(CALB)很相似[9],这表明LipA更接近于真菌脂肪酶而不是细菌脂肪酶。正是由于LipA独特的分子结构,使其在手性药物中间体拆分领域具有巨大潜力,已引起广泛关注[10]。然而,LipA是一个常温酶,最适温度仅为25 ℃,野生型的LipA在50 ℃下的酶活力仅为最适温度下的一半[11]。较差的热稳定性限制了它在工业生产中的进一步应用,但是也为其稳定性改造提供了进化空间,也使得LipA成为了一个理想的改造对象。
研究表明,通过单一氨基酸残基的置换来降低蛋白质去折叠时的骨架熵可以使蛋白质的热稳定性得到一定的提高,而脯氨酸(Pro)在这一理论中起关键作用[12]。Pro的N-Cα旋转受到其吡咯烷环的束缚,从而具有更小的构象自由度,同时限定其前面氨基酸只有有限的构象空间,这种结构使得它比其它氨基酸更能增加蛋白质的刚性。相对地,甘氨酸(Gly)由于没有侧链,具有灵活的构象,则可增加蛋白质的柔性[12-14]。对此,Suzuki等[15]、Watanabe等[16]提出了“脯氨酸理论”,认为只要主链构象不发生骤变,在适当的β-转角或无规卷曲位置引入Pro,就可以通过降低蛋白质去折叠时的骨架熵提高蛋白质的热稳定性。这一理论已应用于多种酶的热稳定性改造实验并得到了证实[14,17-18]。
结合“脯氨酸理论”,作者采用分子动力学模拟的方法,通过分析LipA的Rmsf图及其分子结构模型,确定位于柔性较高Loop区域的Gly52和Gly158作为突变位点,将Gly突变为Pro,并通过分子生物学实验验证预测结果,分别考察了野生型LipA和突变株LipAG52P、LipAG158P的比活力、耐温性等相关酶学性质。
1 实验
1.1 菌株及载体质粒
Bacillussubtilis168,自行保藏。
EscherichiacoliDH5α、EscherichiacoliBL21 (DE3)、pET-22b质粒,Novagen公司。
1.2 培养基
LB液体培养基:1%胰蛋白胨,0.5%酵母粉,1% NaCl,用蒸馏水配制,在121 ℃下高压蒸汽灭菌 20 min。
LB 固体培养基:在 LB 液体培养基的基础上再加 1.5%~2.0%的琼脂。
1.3 重组质粒的构建
1.3.1LipA基因的获取及PCR扩增
提取Bacillussubtilis168基因组(采用Takara公司的提取基因组试剂盒),根据Genbank中枯草芽孢杆菌基因组的序列(登录号为AL009126.3),设计合成一对PCR引物进行目的基因扩增并回收PCR产物:
上游引物:5′-CCGCATATGGCTGAACACAA-TC-3′;
下游引物:5′-CCCAAGCTTATTCGTATTCTGGC-3′。
上下游引物的5′-端分别设计了NdeⅠ和HindⅢ酶切位点用于连接到表达载体pET-22b,以Bacillussubtilis168菌株DNA为模板进行PCR扩增,PCR条件为:94 ℃预变性2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 2 min;35个循环后72 ℃延伸10 min。
1.3.2LipA基因与质粒的酶切
在含有50 μg·mL-1氨苄青霉素的LB液体培养基中扩增含有质粒的菌株,提取质粒(采用Takara公司的提取质粒试剂盒)。
选择NdeⅠ和HindⅢ为酶切位点,对Bacillussubtilis168基因组和pET-22b质粒进行双酶切操作,质粒双酶切产物去磷酸化后与LipA基因连接,核酸电泳验证。
1.3.3重组质粒的转化
采用氯化钙转化法,将重组质粒转入E.coliDH5α中构建DH5α-pET22b-LipA,涂布含有50 μg·mL-1氨苄青霉素的LB培养基过夜培养并保存。
1.4 LipA基因的定点突变和蛋白表达
1.4.1全质粒PCR扩增
采用全质粒PCR扩增的方法进行定点突变,设计含有Gly52Pro和Gly158Pro的全质粒PCR引物,序列如下:
引物1:
S链:5′-CGCCATTTATAACAATCCACCGGT-3′;
A链:5′-ACCGGTGGATTGTTATAACTTGG-G-3′;
引物2:
S链:5′-CGCCATGTTGGACACATCCCCCT-3′;
A链:5′-GCTGTACAGAAGGGGGATGTCTTGGG-3′。
用PrimSTAR对全质粒进行扩增,PCR反应液:5×Prime STAR Buffer (Mg+plus) 10 μL,dNTP Mixture (2.5 mmol·L-1) 4 μL,Prime2 (10 μmol·L-1) 1 μL,模板DNA<200 ng,PrimeSTAR HS、DNA Polymerase (2.5 U ·μL-1)各0.5 μL,灭菌蒸馏水补充至50 μL,PCR扩增产物约为629 bp。
1.4.2全质粒扩增的产物转化
从-80 ℃冰箱中取出感受态细胞E.coliDH5α,立即放入冰中融化。加入10 μL连接产物在冰上冷却30 min,将混合物在42 ℃热休克90 s(勿摇晃),立即放到冰浴中冷却2 min,再加入800 μL LB液体培养基,37 ℃下振荡培养30 min,涂布含有氨苄青霉素的LB平板,转接LB液体培养基中过夜培养,构建LipA突变株。酶切鉴定筛选重组表达质粒,并对其测序以确定突变克隆。
1.4.3LipA的诱导表达
提取DH5α-pET22b-LipA和突变株质粒,分别转化至表达载体E.coliBL21 (DE3)中,构建LipA 工程菌BL21-pET22b-LipA,涂布含有氨苄青霉素的LB平板过夜培养。挑取转化子于含50 μg·mL-1氨苄青霉素的LB液体培养基中,在37 ℃摇床上培养约2 h,当OD600达到0.6~0.8时,加入IPTG使其终浓度达到0.5 mmol·L-1,置于30 ℃摇床上继续培养6~8 h进行诱导表达。
1.5 LipA的分离和纯化
将发酵液离心,收集菌体,用与发酵液同等体积的Tris-HCl缓冲溶液(pH值7.4)重悬菌体,超声破碎细胞,至菌液澄清后于12 000 r·min-1离心15 min,收集上清液,即为LipA的粗酶液。采用Ni柱亲和层析的方法对粗酶液进行纯化后,置于4 ℃环境下保存。SDS-PAGE电泳验证纯化效果。
1.6 酶学性质的研究
1.6.1酶活力测定
采用p-NPP法测脂肪酶活力,并绘制p-NP浓度标准曲线。96孔板中分别加入240 μL底物溶液与10 μL酶液(空白对照加入10 μL蒸馏水),40 ℃下反应10 min,于405 nm处测定吸光度。依据标准曲线计算酶活力。
酶活力单位定义:每分钟催化p-NPP水解生成1 μmol的p-NP所需的脂肪酶量为1 U。
1.6.2蛋白浓度测定
采用Bradford法,以牛血清白蛋白作为标准蛋白绘制浓度标准曲线,分别测定原始菌与突变菌发酵液中蛋白浓度。
1.6.3热稳定性测定
将野生型LipA和LipAG52P、LipAG158P分别于20 ℃、30 ℃、40 ℃、50 ℃、55 ℃、60 ℃、65 ℃下保温30 min,测定残余酶活力。以未经温浴条件下所测得的酶活力为100%,将经过不同温度热处理后所测得的酶活力折合为相对剩余酶活力,对温度作图。相对剩余酶活力为50%所对应的温度为酶的Tm值。
1.6.4动力学参数测定
使用SpectraMax M3多功能酶标仪(Molecular Devices公司)测定LipA和LipAG52P、LipAG158P动力学参数,每30 s测定405 nm波长处吸光度,对时间作图。根据米氏方程力计算Km、kCat等相关参数。
1.7 分子动力学模拟
采用GROMACS4.5.4软件进行分子动力学模拟,体系在中性条件下,溶剂模型SPC,力场为GROMOS9653a6,温度为300 K。体系首先采用最速下降法能量最小化(steepest descent)进行优化;然后固定蛋白,采用压力(parrinello-rahman)与温度(V-rescale)进行500 ps约束优化;最后进行分子动力学模拟,放松蛋白,时间步长为2 fs,模拟时间为10 ns。体系每隔1 ps收集一次数据,得出分析均方根偏差RMSD(root mean square deviation)值与均方根涨落Rmsf(root mean square fluctuation)曲线。
2 结果与讨论
2.1 突变位点的确定
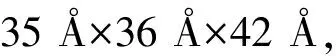
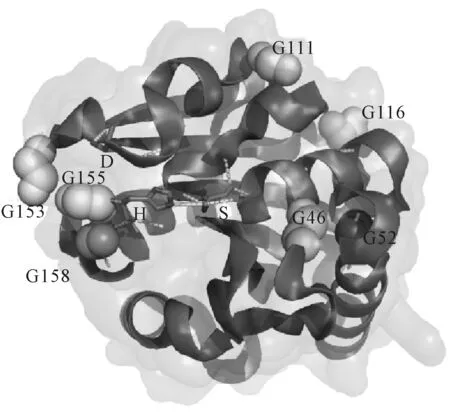
图1 LipA三维结构模型
采用分子动力学模拟的方法,得到野生型LipA的Rmsf值(图2)。Rmsf值越高则分子柔性越大、稳定性越低,从而确定野生型LipA柔性较高的区域(第151~156位、第109~124位、第130~138位、第38~48位)。结合上述LipA晶体结构,选取位于柔性较高Loop区域附近的Gly残基作为突变位点突变为Pro,分别确定为Gly153、Gly155、Gly158、Gly111、Gly116、Gly46、Gly52。
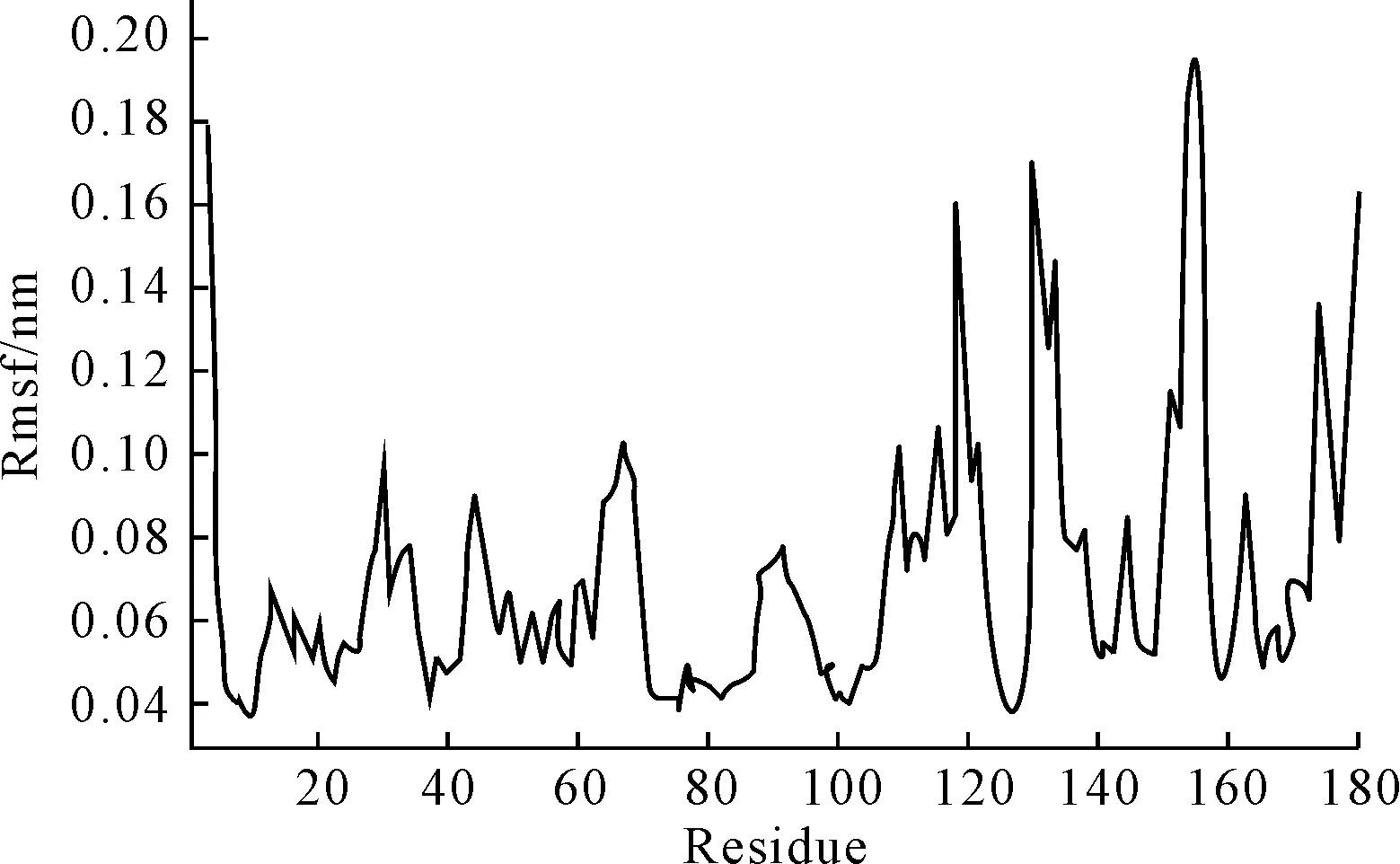
图2 野生型LipA在300 K平衡时间段的Rmsf值
2.2 分子动力学模拟预测突变体的热稳定性
实验采用GROMACS4.5.4软件进行分子动力学模拟,通过联合分析均方根涨落Rmsf值(图2)与均方根偏差RMSD值(图3),分析引入的Pro突变位点对LipA热稳定性的贡献。
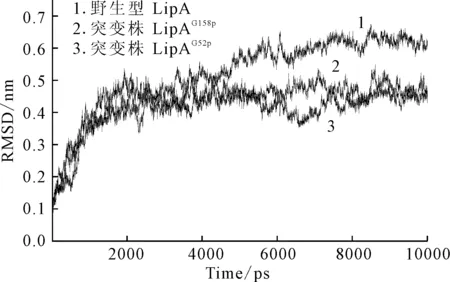
图3 野生型和突变株LipA的RMSD值随时间变化的演示图
由图3可知,6 000 ps后蛋白的构象趋于稳定,最终2 ns时野生型LipA的平均RMSD值为(0.59±0.01) nm,突变株LipAG52P和LipAG158P的平均RMSD值分别为(0.43±0.02) nm和(0.44±0.02) nm,低于野生型LipA;而其它5种突变株LipAG153P、LipAG155P、LipAG111P、LipAG116P、LipAG46P的平均RMSD值均高于野生型LipA。RMSD值越低则分子构象越稳定,因此得到提高LipA热稳定性的重要氨基酸位点是Gly52和Gly158(图4)。

图4 突变位点3D结构模型
2.3 突变体的获得
经NdeⅠ和HindⅢ酶切鉴定和DNA测序结果表明:突变表达质粒pET22b-LipAG52P、pET22b-LipAG158P构建成功,其电泳图谱如图5所示。
2.4 酶学性质及动力学特性的测定
粗酶液经Ni柱纯化后,采用SDS-PAGE电泳验证纯化过程中各收集液的蛋白条带,如图6所示。
由图6可知,酶液最终仅为一条大小为20.1 kDa的单一条带,达到了理想的纯化效果。
测得野生型LipA和LipAG52P、LipAG158P的酶活力、Km值等相关参数如表1所示。
由表1可知,LipAG52P、LipAG158P的比活力分别是野生型LipA的5.6倍和2.7倍,LipA的催化效率(kCat/Km)为5.21×10-2L·mmol-1·min-1,LipAG52P和LipAG158P的催化效率分别较LipA提高了85%(9.65×10-2L·mmol-1·min-1)和22%(6.35×10-2L·mmol-1·min-1)。
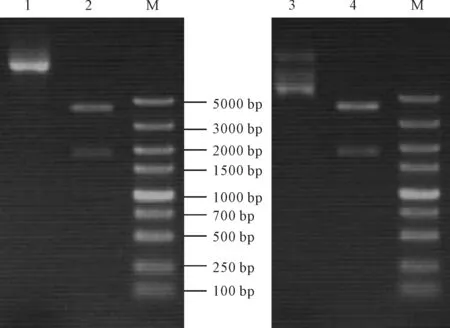
1,3:LipAG52P、LipAG158P质粒 2,4:Nde Ⅰ和Hind Ⅲ双酶切处理后LipAG52P、LipAG158P质粒片段 M:DNA Marker

M.DNA Marker 1~5.纯化过程中各个阶段收集的流出液
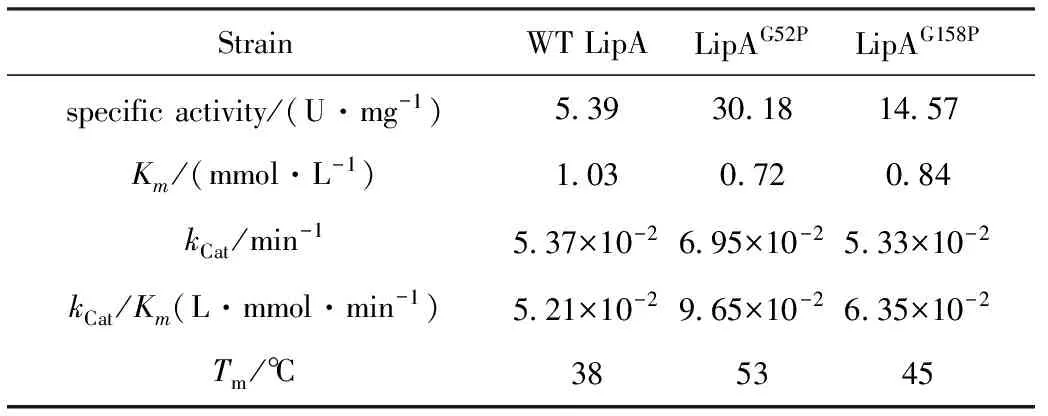
表1 野生型LipA和LipAG52P、LipAG158P相关酶学性质
由图7可知,各温度下处理30 min后突变株的残余酶活力均比野生型LipA高。在40 ℃处理30 min后,野生型LipA的残余酶活仅为32.14%,而突变株LipAG52P和LipAG158P的残余酶活分别为78.35%和63.51%。在50 ℃处理30 min后,野生型LipA丧失
2.5 热稳定性分析(图7)
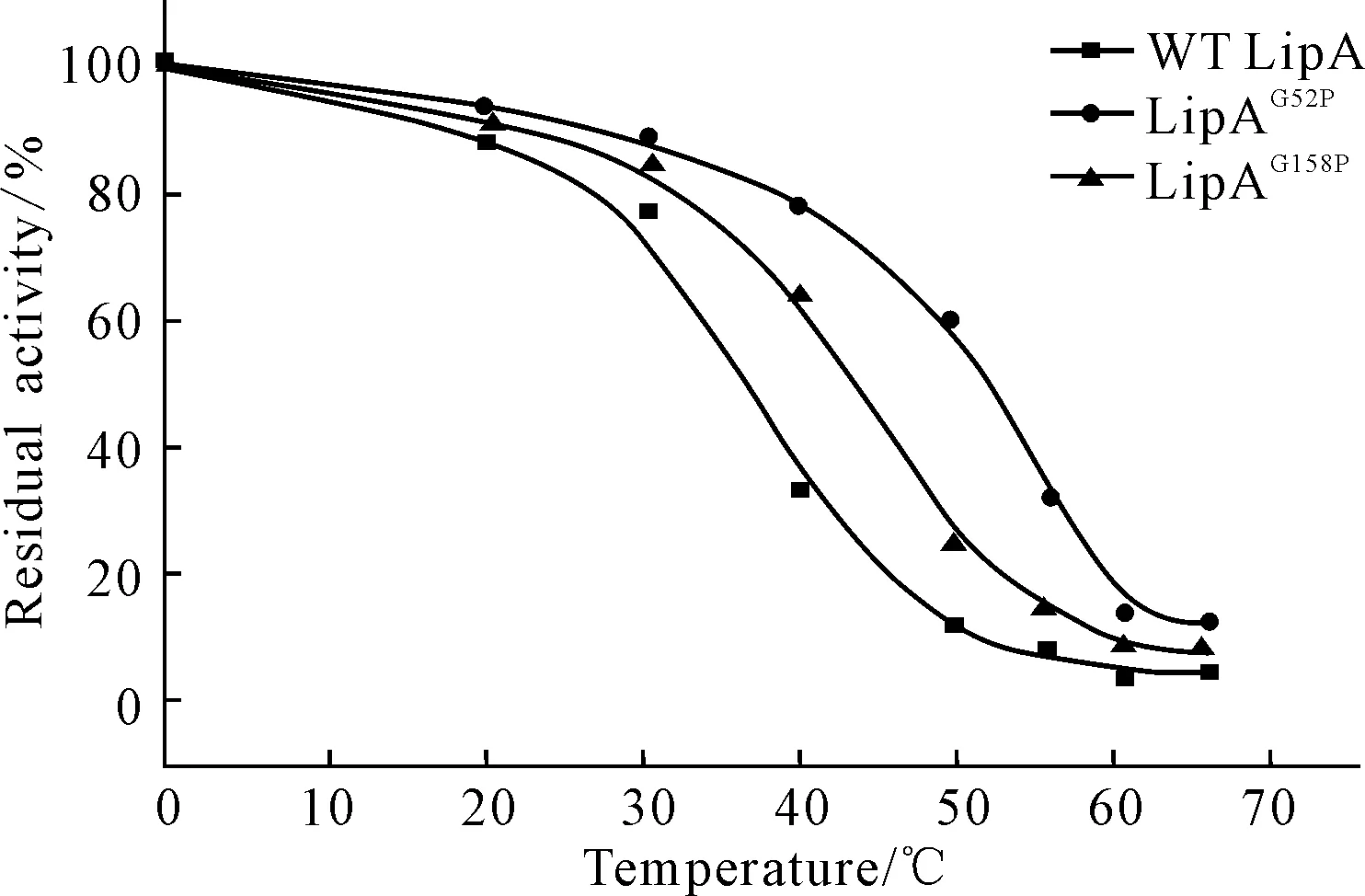
图7 野生型LipA、LipAG52P和LipAG158P的热稳定性
了90%的酶活,LipAG158P丧失了近80%的酶活,而LipAG52P仍保留了60%的残余酶活。此外,野生型LipA的Tm值为38 ℃,LipAG52P和LipAG158P的Tm值则分别提高了15 ℃和7 ℃。这说明LipAG52P、LipAG158P的热稳定性较野生型LipA有明显的提高。
2.6 讨论
赵博等[20]采用定向进化的方法经过两轮易错 PCR以及高通量筛选,最终获得了比活力为野生出发酶4.5倍的突变体。Le等[21]通过A162C和K308C双突变使CALB的Tm值提高了8.5 ℃。蔡少丽等[22]利用重叠延伸PCR方法对扩展青霉脂肪酶基因进行体外定点突变,得到的双突变体脂肪酶PEL-ep8-K115R-GS的Tm值比野生型脂肪酶PEL-GS提高3.5 ℃。可见,蛋白质分子设计与改造能改善酶的热稳定性。
本研究以LipA(PDB:1I6W)为研究对象,在计算机辅助设计的基础上将“脯氨酸理论”应用于LipA的热稳定性改造上,通过分子动力学模拟分析其三维结构找出相关的脯氨酸位点,并预测定点突变LipA后对其热稳定性的影响。既避免了现有技术中非理性设计方法需要面临的筛选容量大、过程复杂等难题,同时简化了理性设计方法,使得蛋白质的定点突变更具有针对性,并最终成功实现了LipA的热稳定性的显著提高,通过本实验得到的突变株LipAG52P、LipAG158P不仅比活力和热稳定性均强于野生型LipA,而且催化效率也得到了一定的提高。
3 结论
以LipA为研究对象,根据从RCSB数据库中获取的晶体结构,采用分子动力学模拟和分子生物学实验相结合的方法进行脂肪酶热稳定性位点突变的理性设计。首先,利用分子动力学模拟获得晶体结构中柔性较高的Loop区域;进而,结合“脯氨酸理论”,将位于该区域附近的Gly残基突变为Pro,分析引入Pro突变对LipA热稳定性的影响,筛选得到Gly52和Gly158两个突变位点;最后,通过定点突变操作对突变株LipAG52P和LipAG158P进行热稳定性实验验证。结果显示,突变株LipAG52P、LipAG158P的比活力分别是野生型LipA的5.6倍和2.7倍,Tm值分别提高了15 ℃和7 ℃,并且催化效率分别提高了85%和22%。
参考文献:
[1]MA J H,ZHANG Z M,WANG B J,et al.Overexpression and characterization of a lipase fromBacillussubtilis[J].Protein Expression and Purification,2006,45(1):22-29.
[2]JOSEPH B,RAMTEKE P W,THOMAS G.Cold active microbial lipases:Some hot issues and recent developments[J].Biotechnology Advances,2008,26(5):457-470.
[3]REJASSE B,MAUGARD T,LEGOY M D.Enzymatic procedures for the synthesis of water-soluble retinol derivatives in organic media[J].Enzyme and Microbial Technology,2003,32(2):312-320.
[4]RUFINO A R,BIAGGIO F C,SANTOS J C,et al.Screening of lipases for the synthesis of xylitol monoesters by chemoenzymatic esterification and the potential of microwave and ultrasound irradiations to enhance the reaction rate[J].International Journal of Biological Macromolecules,2010,47(1):5-9.
[5]YANG K S,SOHN J H,KIM H K.Catalytic properties of a lipase fromPhotobacteriumlipolyticumfor biodiesel production containing a high methanol concentration[J].Journal of Bioscience and Bioengineering,2009,107(6):599-604.
[6]JAEGER K E,EGGERT T.Lipases for biotechnology[J].Current Opinion in Biotechnology,2002,13(4):390-397.
[7]POUDEROYEN G,von EGGERT T,JAEGER K E,et al.The crystal structure ofBacillussubtilislipase:A minimalα/βhydrolase fold enzyme[J].Journal of Molecular Biology,2001,309(1):215-226.
[8]ACHARYA P,RAJAKUMARA E,SANKARANARAYANAN R.Structural basis of selection and thermostability of laboratory evolvedBacillussubtilislipase[J].Journal of Molecular Biology,2004,341(5):1271-1281.
[9] 赵博,高仁钧,廉虹,等.枯草杆菌脂肪水解酶 LipA 和LipB[J].中国生物化学与分子生物学,2008,24(5):419-425.
[10]DETRY J,ROSENBAUM T,LÜTZ S,et al.Biocatalytic production of enantiopure cyclohexane-trans-1,2-diol using extracellular lipases fromBacillussubtilis[J].Applied Microbiology and Biotechnology,2006,72(6):1107-1116.
[11]REETZ M T,CARBALLEIRA J D,VOGEL A.Iterative saturation mutagenesis on the basis of B factors as a strategy for increasing protein thermostability[J].Angewandte Chemie,2006,45(46):7745-7751.
[12]MATTHEWS B W,NIHOLSON H,BECKTEL W J.Enhanced protein thermostability from site-directed mutations that decrease the entropy of unfolding[J].Proceedings of the National Academy of Sciences,1987,84(19):6663-6667.
[13]ZHOU C,XUE Y F,MA Y H.Enhancing the thermostability ofα-glucosidase from thermo anaerobactertengcongensis MB4 by single proline substitution[J].Journal of Bioscience and Bioengineering,2010,110(1):12-17.
[14]GOIHBERG E,DYM O,TEL-OR S.A single proline substitution is critical for the thermostabilization ofClostridiumbeijerinckiialcohol dehydrogenase[J].Proteins:Structure,Function,and Bioinformatics,2007,66(1):196-204.
[15]SUZUKI Y,OISHI K,NAKANO H.A strong correlation between the increase in number of proline residues and the rise in thermostability of fiveBacillusoligo-1,6-glucosdiases[J].Applied Microbiology and Biotechnology,1987,26:546-551.
[16]WATANABE K,CHISHIRO K,KITAMURA K,et al.Proline residues responsible for thermostability occur with high frequency in the loop regions of an extremely thermostable oligo-1,6-glucosidase fromBacillusthermoglucosidasiusKP1006[J].Journal of Biological Chemistry,1991,266:24287-24294.
[17]SCHULTZ D A,FRIEDMAN A M,WHITE M A,et al.The crystal structure of thecis-proline to glycine variant (P114G) of ribonuclease A[J].Protein Science,2005,14(11):2862-2870.
[18]TIAN J,WANG P,GAO S.Enhanced thermostability of methyl parathion hydrolase fromOchrobactrumsp.M231 by rational engineering of a glycine to proline mutation[J].FEBS Journal,2010,277(23):4901-4908.
[19]NTHANGENI M B,PATTERTION H,van Tonder A,et al.Over-expression and properties of a purified recombinantBacilluslicheniformislipase:A comparative report onBacilluslipases[J].Enzyme and Microbial Technology,2001,28(7-8):705-712.
[20]赵博,陶进,马吉胜,等.定向进化提高枯草芽孢杆菌脂肪酶的活力[J].催化学报,2009,30(4):291-296.
[21]LE Q A T,JOO J C,YOO Y J,et al.Development of thermostableCandidaantarcticalipase B through novel in silico design of disulfidebridge[J].Biotechnology and Bioengineering,2012,109(4):867-876.
[22]蔡少丽,邹有土,黄建忠,等.定点突变对扩展青霉脂肪酶热稳定性的改善[J].应用与环境生物学报,2013,19(1):43-47.

