产蛋白酶菌Planomicrobium sp.L-2发酵条件的优化
金玉兰,王玉荣
(青岛农业大学化学与药学院,山东 青岛 266109)
蛋白酶广泛存在于动物和人的消化道中,对蛋白质的消化吸收起着非常重要的作用[1]。蛋白酶也是目前工业中不可或缺的一类重要工业酶,约占世界总酶量的60%,在食品、药品加工、日用化学品及皮品毛皮工业等诸多领域都有广泛应用[2-4]。目前,商业化蛋白酶按来源分为动物蛋白酶、植物蛋白酶及微生物蛋白酶,随着国内外鱼类养殖业的发展,鱼类胃肠道蛋白酶的研究越来越受到关注。水生动物肠道微生物所产的蛋白酶类与其它动物肠道所产的蛋白酶类相比,有着其独特的特点,如:低温下催化活性高、低热下稳定性强和耐酸或耐碱等[5-7]。近年来,关于鱼类胃肠道蛋白酶分离纯化及性质研究的报道很多,从鱼类胃肠道提取的蛋白酶成为现代工业化酶制剂的主要来源之一[8-9]。
作者通过单因素实验和Box-Behnken设计,对从长蛸胃肠道分离出的产蛋白酶菌Planomicrobiumsp.L-2菌株进行发酵条件优化,确定该菌株产蛋白酶的最佳培养基组成和发酵条件,为该菌株在发酵罐及工业化条件下进行产酶条件的优化提供了理论依据,同时为海洋动物的进一步综合开发与利用提供参考。
1 实验
1.1 材料、试剂、培养基与仪器
Planomicrobiumsp.L-2菌株(菌种保藏号 No.6638),筛选自长蛸胃肠道,中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)。
偶氮酪蛋白(azocasein)、福林酚,美国Sigma公司;葡萄糖、蛋白胨、酵母膏等,均为国产分析纯。
2216E基础发酵培养基:蛋白胨0.5 g,酵母膏0.1 g,磷酸高铁0.01 g,海水100 mL,pH值7.8~8.0,121 ℃灭菌15 min。
PH-211型台式酸度测定仪,意大利哈纳公司;IS-RDV3型立式恒温振荡器,美国精骐有限公司;TGL-16M型高速台式冷冻离心机,湖南湘仪实验室仪器开发有限公司;DU-800型紫外分光光度计,美国贝克曼公司。
1.2 发酵条件的单因素实验
1.2.1碳源对产酶的影响
在2216E基础发酵培养基的基础上,分别添加0.5%(质量分数)的可溶性淀粉、葡萄糖、蔗糖、乳糖、果糖作为碳源,25 ℃下180 r·min-1振荡培养3 d,根据酶活力高低确定最佳碳源。
1.2.2氮源对产酶的影响
在确定最佳碳源的基础上,分别添加0.5%(质量分数)的蛋白胨、牛肉膏、酪蛋白、酪蛋白、硝酸钠作为氮源,25 ℃下180 r·min-1振荡培养3 d,根据酶活力高低确定最佳氮源。
1.2.3培养基初始pH值对产酶的影响
分别将初步优化后的培养基初始pH值调至5.0、6.0、7.0、7.5、8.0、8.5、9.0、10.0、11.0,25 ℃下180 r·min-1振荡培养3 d,根据酶活力高低确定最佳培养基初始pH值。
1.2.4发酵温度对产酶的影响
将发酵培养基初始pH值调至最佳后,接入活化后的Planomicrobiumsp.L-2,分别在15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃下180 r·min-1培养3 d,根据酶活力高低确定最佳发酵温度。
1.2.5发酵时间对产酶的影响
将活化的Planomicrobiumsp.L-2接入最佳初始pH值的培养基中,在最佳发酵温度下,180 r·min-1培养5 d,期间每12 h取样一次,根据酶活力高低确定最佳发酵时间。
1.2.6接种量对产酶的影响
分别按5%~12%的接种量,将活化的Planomicrobiumsp.L-2菌悬液接种到初始pH值为8.0的培养基中,在25 ℃下180 r·min-1振荡培养3.5 d,根据酶活力高低确定最佳接种量。
1.3 响应面优化设计
在单因素实验的基础上,采用Box-Behnken设计方法,选用可溶性淀粉、蛋白胨、酵母膏为考察因素,利用Design Expert 8.05设计3因素3水平的响应面分析 (RSA) 实验和数据分析,实验因子和编码水平见表1。
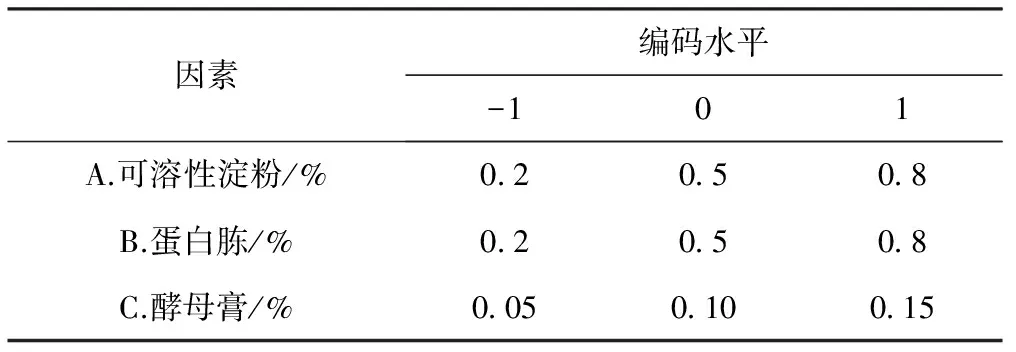
表1 响应面分析实验的因素及编码水平
1.4 酶活力的测定
酶活力测定采用Azocasein测定方法[10]。取1%偶氮酪蛋白溶于0.02 mol·L-1pH值8.0的 PBS缓冲溶液中作为底物,准确吸取50 μL粗酶样品与50 μL 1%偶氮酪蛋白充分混匀,37 ℃下140 r·min-1水浴振荡反应1 h。反应结束后,加入300 μL 10%(质量浓度)TCA终止反应,常温静置15 min后,10 000 r·min-1离心5 min,取上清液100 μL,加入1 mol·L-1NaOH 100 μL,充分混匀,于450 nm处测吸光度A,计算酶活力。
酶活力单位定义:每分钟蛋白酶水解底物偶氮酪蛋白使吸光度改变0.001个单位所需的酶量为1 U。
酶活力计算公式:
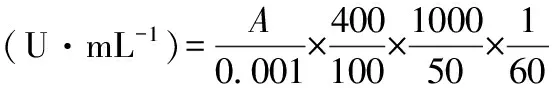
式中:A为450 nm处的吸光度;400为反应的总体积;100为反应后所取上清液的量,μL;50为所加样品的量,μL;1 000为从微升转化为毫升的转化系数;60为反应时间,s。
1.5 蛋白酶含量的测定
蛋白酶含量测定采用Bradford 测定方法。取浓度为0 μg·mL-1、25 μg·mL-1、50 μg·mL-1、75 μg·mL-1、100 μg·mL-1、125 μg·mL-1、150 μg·mL-1、175 μg·mL-1的BSA标准溶液100 μL,各加考马斯亮蓝工作液1 mL混匀,室温放置2 min后在595 nm处测吸光度,绘制标准曲线(图1),拟合线性回归方程为:y=0.0202x+0.0242,R2=0.9981。
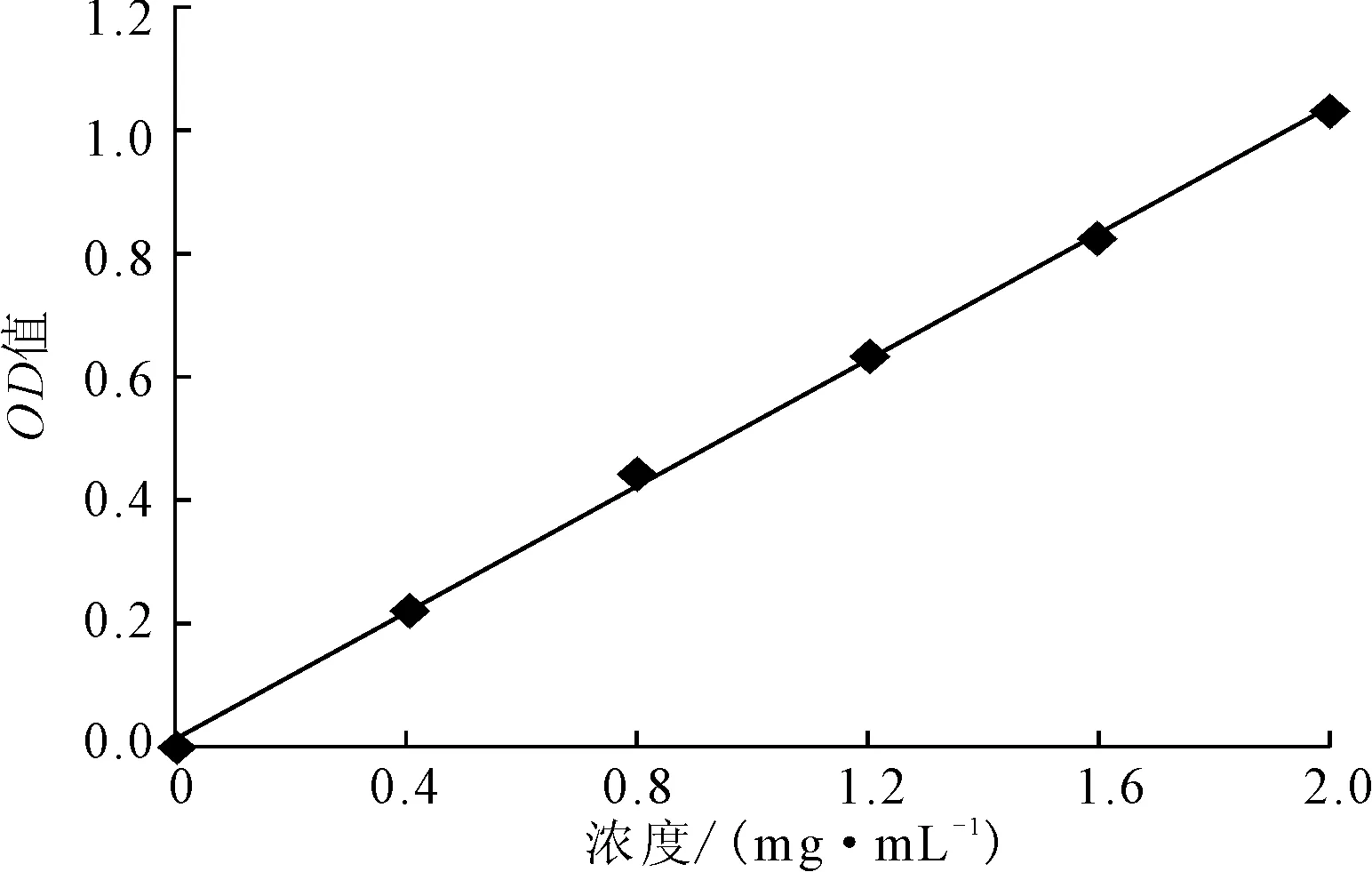
图1 Bradford 法标准曲线
取样品溶液100 μL,加考马斯亮蓝工作液1 mL混匀,室温静置2 min,在595 nm处测吸光度,根据标准曲线计算样品的蛋白酶含量。
1.6 生长量的测定
采用比浊度法测定Planomicrobiumsp.L-2的生长曲线。将Planomicrobiumsp.L-2菌株接入摇瓶培养基中,25 ℃下180 r·min-1振荡培养,间隔不同时间取1 mL发酵液,稀释至恰当倍数,在600 nm处测定菌悬液吸光度。
2 结果与讨论
2.1 Planomicrobium sp.L-2菌株的生长曲线及产蛋白酶过程(图1)
由图1可知,菌株在0~8 h时为生长延滞期,菌株处于适应环境的阶段;8~16 h时菌株适应环境后,利用培养基中提供的营养成分呈指数关系快速生长;16 h后达到稳定期,菌株浓度最高。与生长相比,Planomicrobiumsp.L-2菌株合成蛋白酶明显滞后,在0~24 h 蛋白酶活性增加迅速,24 h 以后增速减缓。
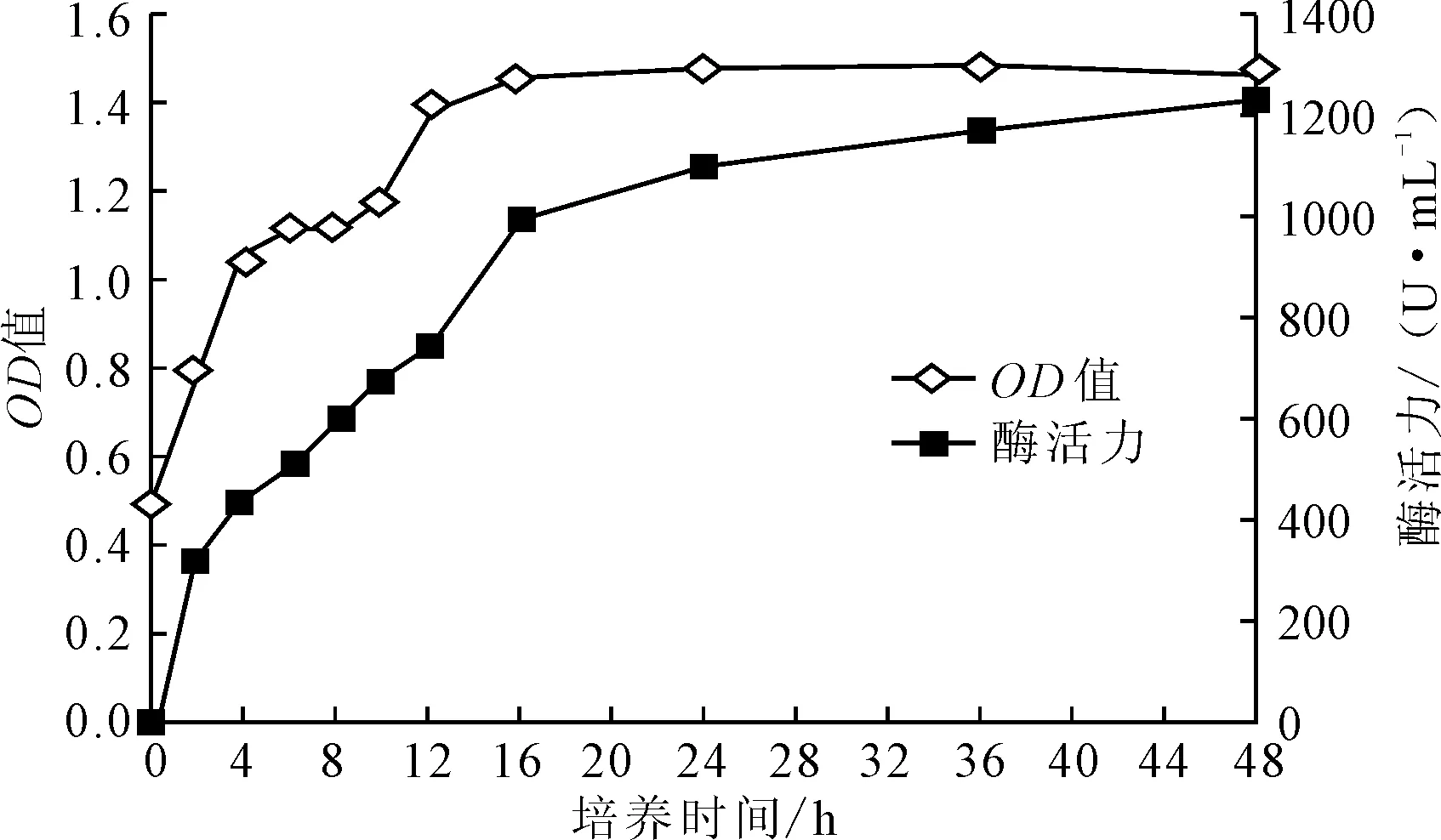
图2 Planomicrobium sp.L-2菌株的生长曲线及产蛋白酶过程
2.2 碳源对产酶的影响
碳源既是细菌生长发育的基本物质,也是某些酶的诱导物,选择适宜的碳源有利于定向促进某些酶的合成[11]。碳源对Planomicrobiumsp.L-2产酶的影响如图3所示。
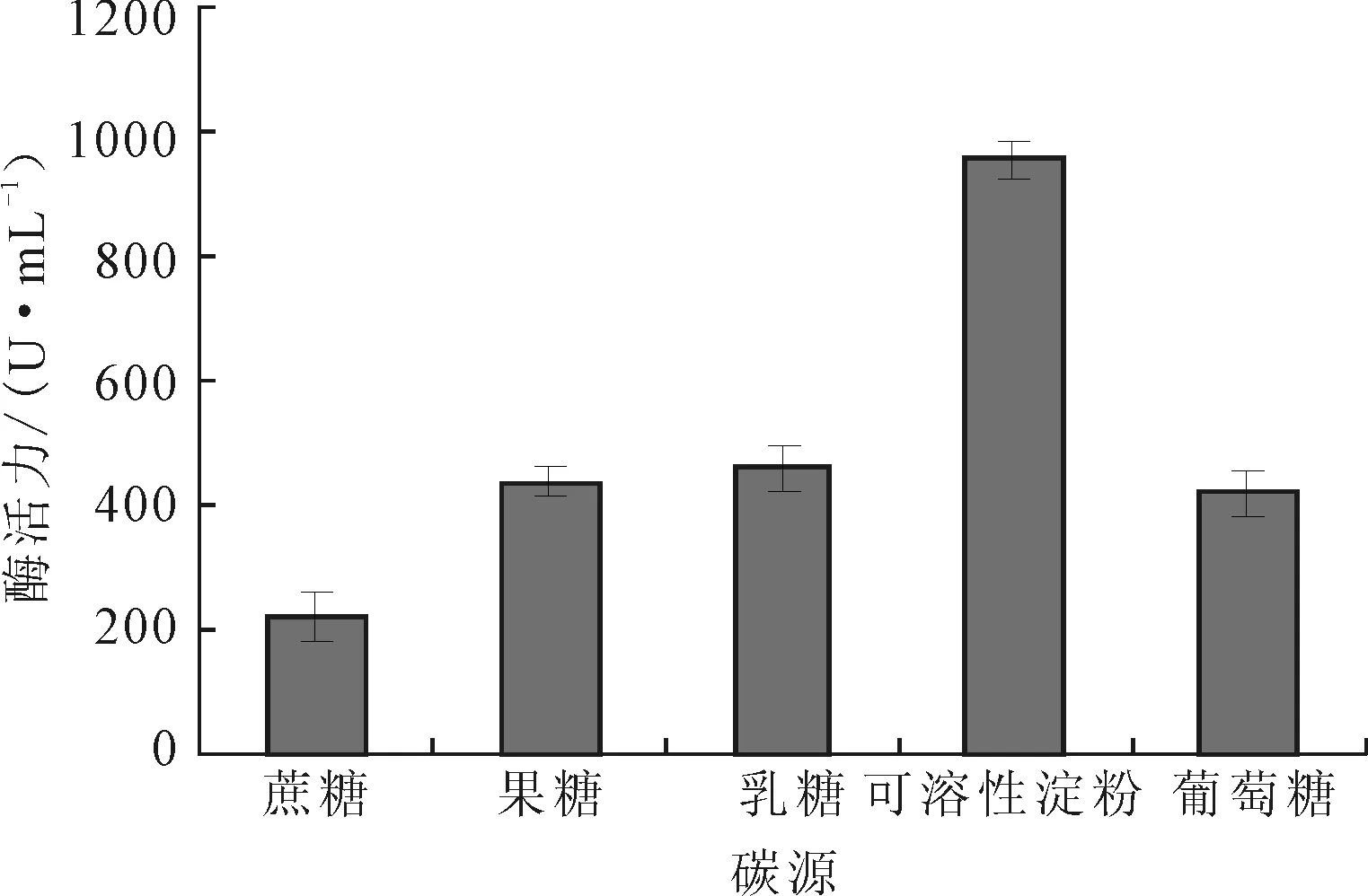
图3 碳源对Planomicrobium sp.L-2产酶的影响
由图3可知,本实验中所选择的碳源都可被Planomicrobiumsp.L-2菌株利用产生蛋白酶,以可溶性淀粉为碳源时,菌株的产酶活力最高,为958 U·mL-1。故选择最佳碳源为可溶性淀粉。
2.3 氮源对产酶的影响
氮源对Planomicrobiumsp.L-2产酶的影响如图4所示。
由图4可知,蛋白胨对蛋白酶活力的促进作用最明显,其次为牛肉膏,而硫酸铵、硝酸钠、酪蛋白对蛋白酶活力的促进作用较弱。这可能是因为,蛋白酶是一种诱导酶,其生物合成受底物及其类似物的诱导,也易受到氨基酸或铵盐等易利用氮源的阻遏[12]。故选择最佳氮源为蛋白胨。
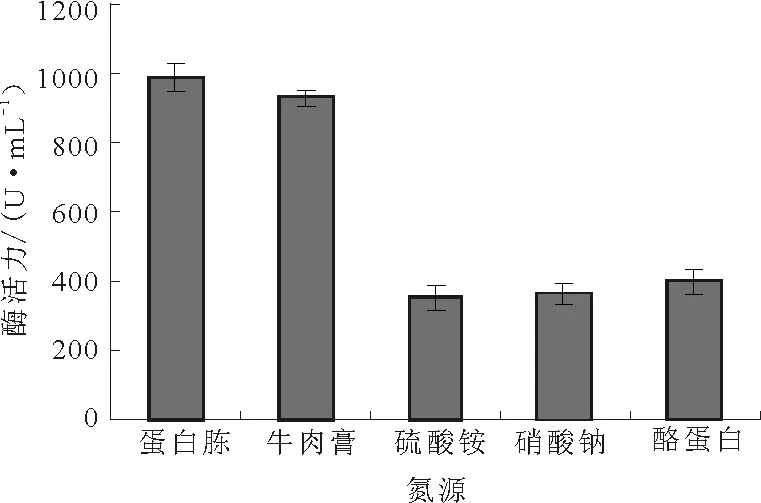
图4 氮源对Planomicrobium sp.L-2产酶的影响
2.4 培养基初始pH值对产酶的影响
培养基初始pH值对Planomicrobiumsp.L-2产酶的影响如图5所示。
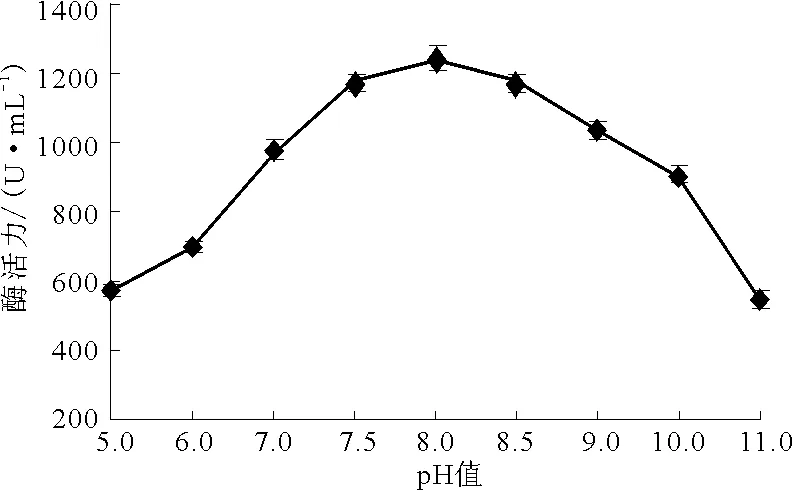
图5 培养基初始pH值对Planomicrobium sp.L-2产酶的影响
研究表明,弱碱性培养环境更有利于蛋白酶的产生。由图5可知,在pH值为8.0时,菌株产酶的活力达到最高,为1 248 U·mL-1,低于或高于该pH值,菌株的产酶活力则显著降低。故选择最佳培养基初始pH值为8.0。
2.5 发酵温度对产酶的影响
发酵温度对Planomicrobiumsp.L-2产酶的影响如图6所示。
由图6可知,发酵温度对Planomicrobiumsp.L-2的产酶活力有明显的影响,在20~25 ℃时,菌株的产酶活力较高,25 ℃时最高,为1 148 U·mL-1,超过25 ℃后,菌株的产酶活力下降。故选择最佳发酵温度为25 ℃。
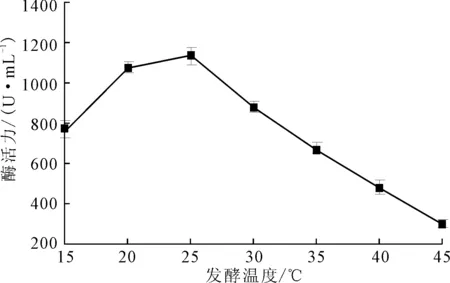
图6 发酵温度对Planomicrobium sp.L-2产酶的影响
2.6 发酵时间对产酶的影响
发酵时间对Planomicrobiumsp.L-2产酶的影响如图7所示。
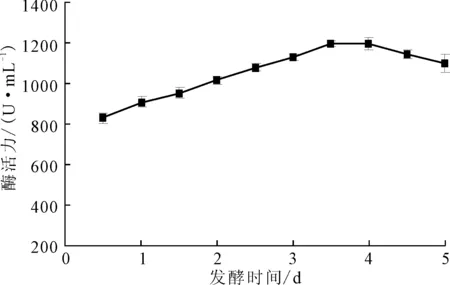
图7 发酵时间对Planomicrobium sp.L-2产酶的影响
由图7可知,随着发酵时间的延长,菌株的产酶活力呈现先升高后降低的趋势,发酵3.5 d时,菌株的产酶活力最高,为1 195 U·mL-1。这可能是因为,发酵时间延长,培养基中营养物质减少,有毒代谢物质增多,发酵液pH值发生变化,抑制了菌株的正常生理活动,导致菌体的衰退从而引起酶的生物合成减少。故选择最佳发酵时间为3.5 d。
2.7 接种量对产酶的影响
接种量对Planomicrobiumsp.L-2产酶的影响如图8所示。
由图8可知,不同接种量对菌株的产酶活力的影响差异不显著。接种量为8%时,菌株的产酶活力最高,为1 210 U·mL-1。接种量过低,菌体生长缓慢,发酵时间延长;接种量过大,菌体生长过快,菌体很容易衰老,影响蛋白酶的合成[13]。故选择最佳接种量为8%。
2.8 响应面实验设计优化结果
2.8.1回归模型的建立及显著性检验
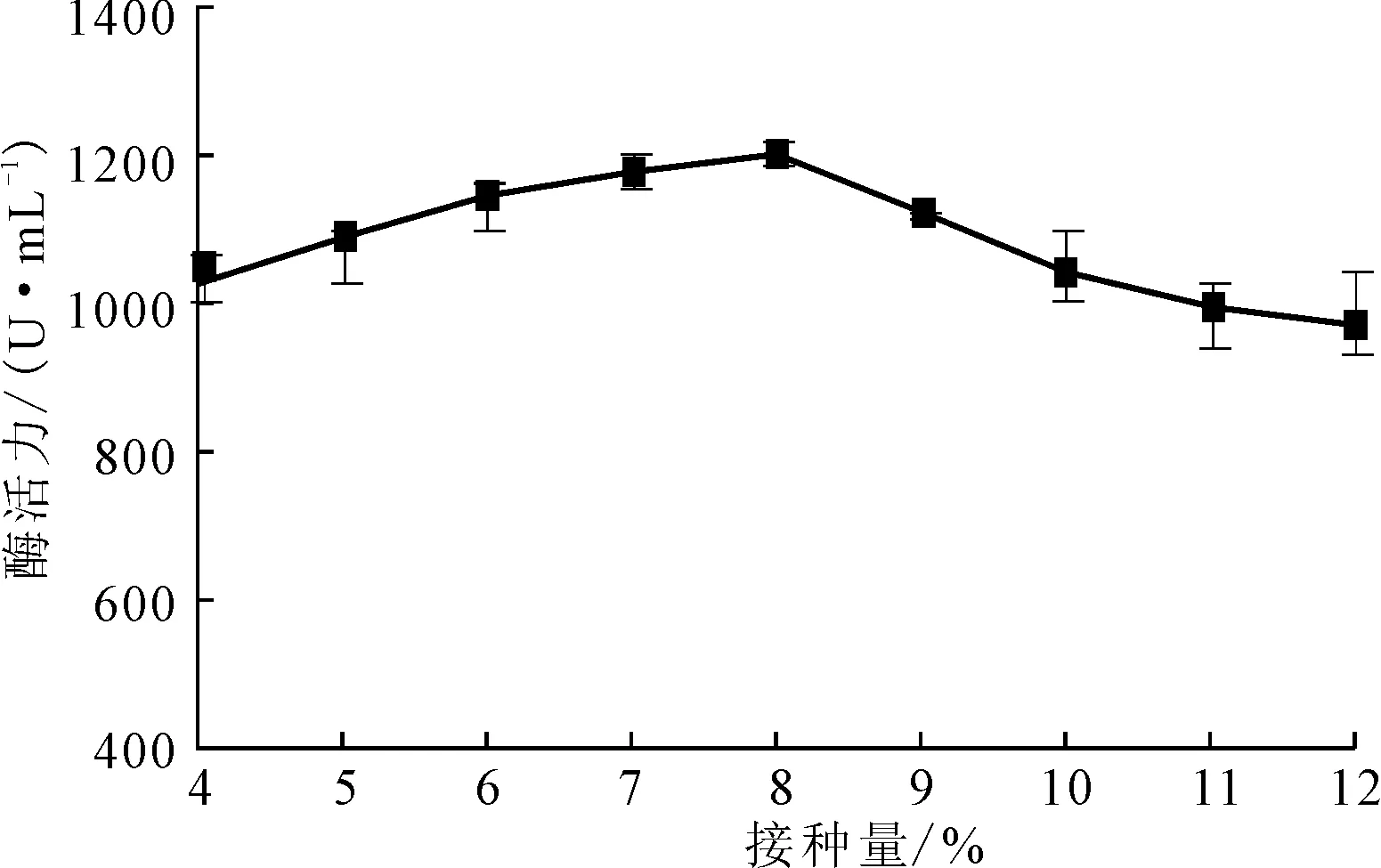
图8 接种量对Planomicrobium sp.L-2产酶的影响
在单因素实验的基础上,采用Box-Behnken设计方法,对Planomicrobiumsp.L-2发酵产蛋白酶的培养基组分进行优化,结果见表2。
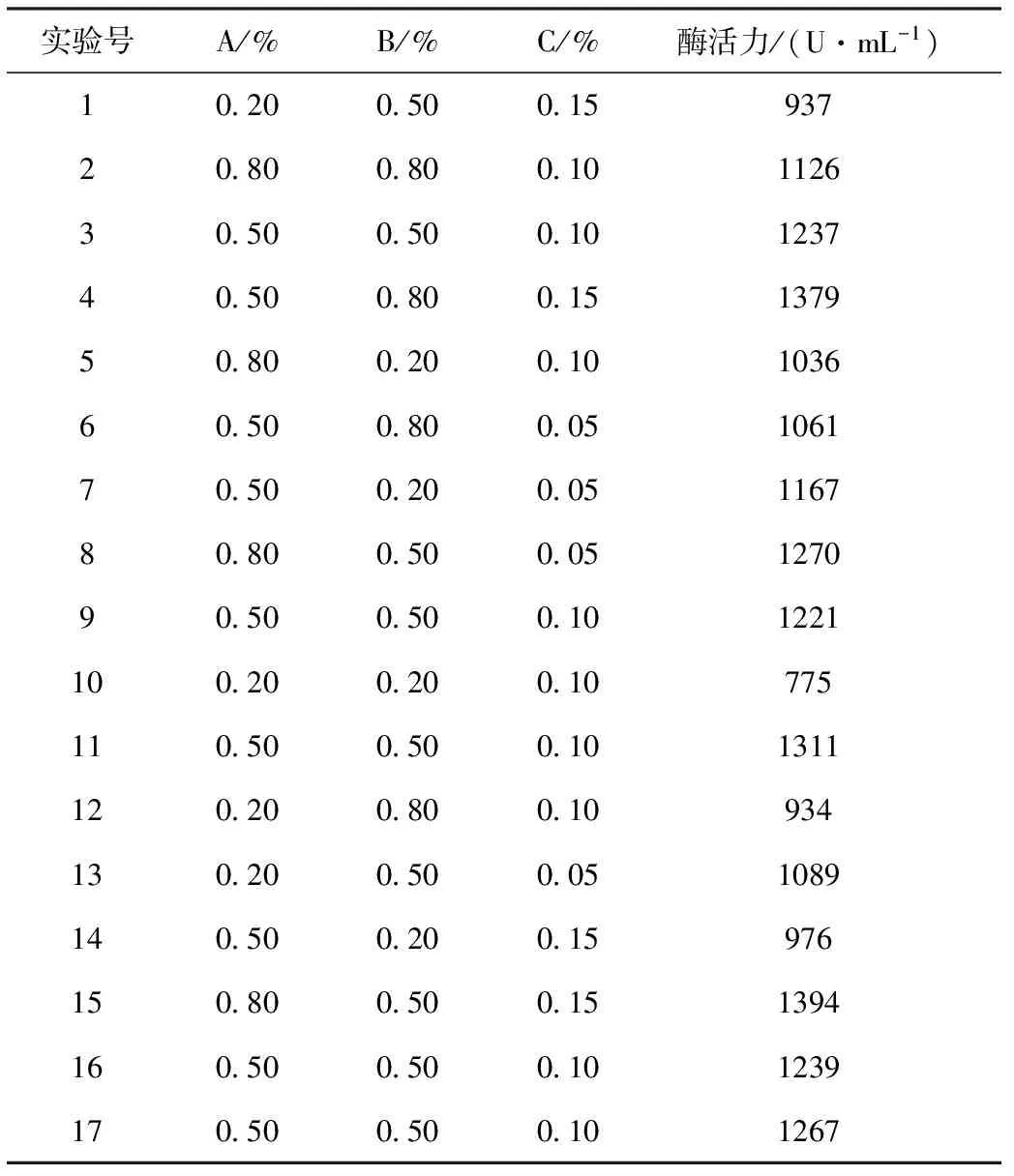
表2 响应面实验设计及结果
对表2中数据进行多元回归拟合,得到Planomicrobiumsp.L-2菌株产蛋白酶活性(Y)对可溶性淀粉(A)、蛋白胨(B)、酵母膏(C)的多项回归方程为:Y=896.10+1526.53A+1208.33B-10194.17C-191.67AB+4600.00AC+8483.33BC-1436.11A2-1733.33B2+19500.00C2。
对该模型及系数进行方差分析,结果见表3。
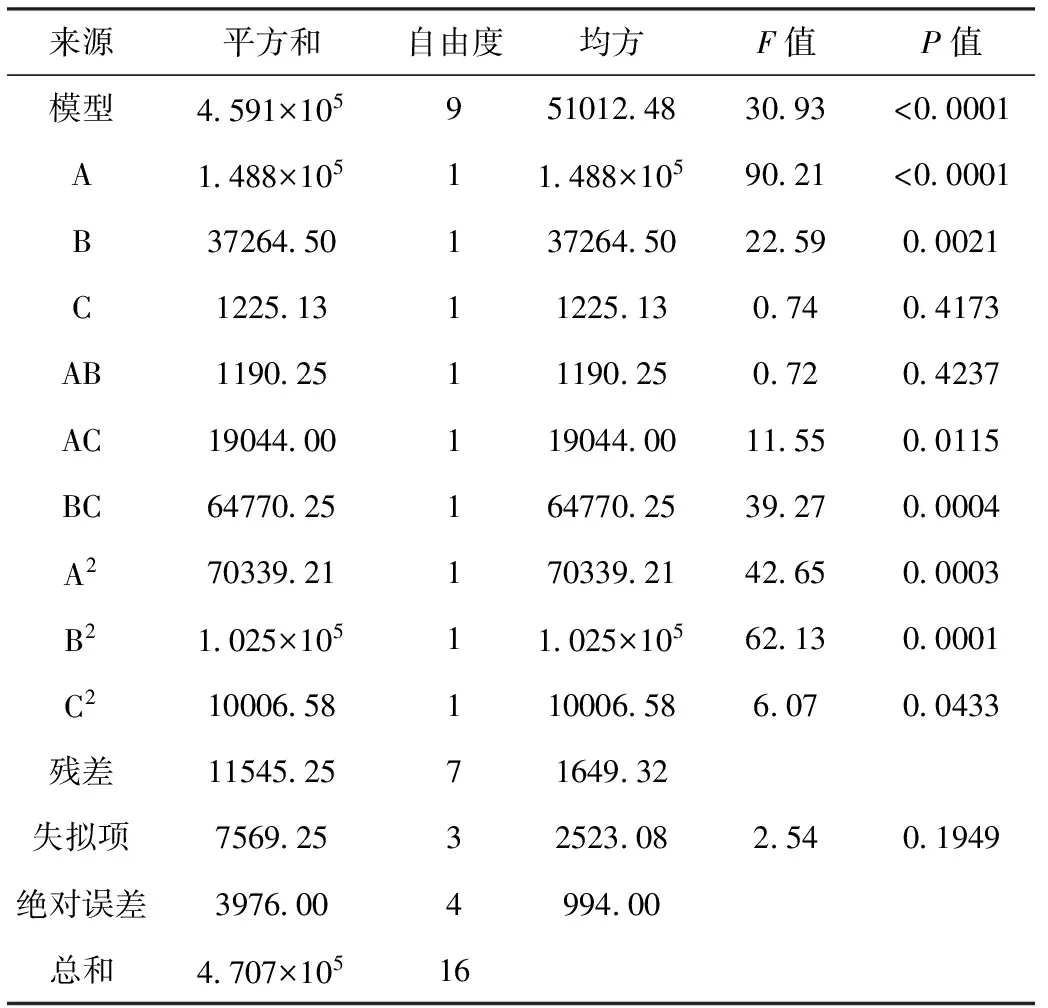
表3 回归模型的方差分析及回归系数的显著性检验
由表3可知,P<0.0001,回归模型显著,说明方程拟合度较好,失拟项P=0.1949>0.05,失拟项不显著,残差由随机误差引起,说明模型与实验拟合程度良好,模型选择正确。复相关系数R2=0.9775,表明所建立的回归二次模型成立,可用此模型分析和预测Planomicrobiumsp.L-2发酵产蛋白酶的培养基组成。
根据回归模型绘制相应的响应面分析图,分别反映了可溶性淀粉、蛋白胨、酵母膏两两交互作用对Planomicrobiumsp.L-2产蛋白酶活力的影响,结果如图9所示。
由图9可知,当可溶性淀粉添加量一定时,蛋白酶活力随着蛋白胨添加量的增加而增大,但当蛋白胨添加量大于0.55%时,蛋白酶活力逐渐降低;当蛋白胨添加量一定时,蛋白酶活力随着可溶性淀粉添加量的增加而增大,但当可溶性淀粉添加量继续增大时,蛋白酶活力逐渐降低。此外,从响应面图及方差分析可知,在各因素的影响中,酵母膏对蛋白酶活力影响最大,可溶性淀粉次之,蛋白胨最弱。
利用Design Expert 8.05软件包,结合回归模型和响应面图分析得出Planomicrobiumsp.L-2发酵产蛋白酶的最佳条件是:可溶性淀粉(A)0.73%、蛋白胨(B)0.68%、酵母膏(C)0.15%。在此条件下,预测蛋白酶的最高酶活力为1 449 U·mL-1。
2.8.2验证实验
为检验响应面优化法对Planomicrobiumsp.L-2发酵产蛋白酶的可靠性,在优化发酵条件下进行产蛋白酶发酵,培养基组成为:可溶性淀粉0.73%、蛋白胨0.68%、酵母膏0.15%、磷酸高铁0.01%,培养基初始pH值8.0,接种量8%,25 ℃培养3.5 d,进行3次平行实验,所得蛋白酶的平均酶活力为1 457 U·mL-1,与理论值偏差0.55%,说明此模型准确可靠。
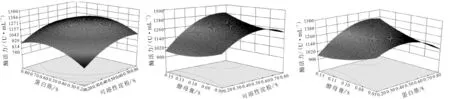
图9 各因素之间交互影响对蛋白酶活力影响的响应面分析图
3 结论
在单因素实验的基础上,采用Box-Behnken设计,以蛋白酶活力为考察指标,建立了Planomicrobiumsp.L-2发酵产蛋白酶的数学模型,经验证实验确定该模型合理可靠。优化得到的最佳培养基组成及发酵条件为:用海水配制含可溶性淀粉0.73%、蛋白胨0.68%、酵母膏0.15%、磷酸高铁0.01%的培养基,调培养基初始pH值8.0,接种量为8%,发酵温度为25 ℃,发酵时间为3.5 d。优化后,所产蛋白酶的最高酶活力为1 457 U·mL-1,比优化前提高约2倍。
参考文献:
[1]冯雪,吴志新,祝东梅,等.草鱼和银鲫肠道产消化酶细菌的研究 [J].淡水渔业,2008,38(3):51-57.
[2]KTARI N,KHALED H B,YOUNES I,et al.Zebra blenny (Salariabasilisca) viscera as a source of solvent-stable proteases:Characteristics,potential application in the deproteinization of shrimp wastes and evaluation in liquid laundry commercial detergents[J].Journal of Food Science and Technology,2012,49(4):1-10.
[3]TEMIZ H,USTUN N S,TURHAN S,et al.Partial purification and characterization of alkaline proteases from the Black Sea anchovy (Engraulisencrasicholus) digestive tract[J].African Journal of Biotechnology,2013,12(1):56-63.
[4]韩秋菊,张倩倩.蛋白酶产生菌LN02 发酵玉米黄粉蛋白的条件优化[J].化学与生物工程,2011,28(6):74-76.
[5]陈明霞,李和阳,陈维维,等.68株北极产蛋白酶菌株的筛选、鉴定以及部分酶学性质[J].微生物学报,2013,53(7):702-709.
[6]李秀芬,牛海玲,张蕊,等.海参蛋白酶体的提取及其酶学性质研究[J].中国食品学报,2013,13(12):65-70.
[7]王玉荣,曲田丽,金玉兰.短蛸胃肠道产蛋白酶菌株的筛选及其酶学性质研究[J].水产科学,2014,33(4):237-240.
[8]尹青春,岑燕钊,许纯绚,等.鱿鱼内脏蛋白酶的提取工艺研究 [J].现代食品科技,2012,28(3):304-308.
[9]WU Y,WANG P,LI L,et al.Purification and characteristics of serine protease from the head of pacific white shrimp[J].Food Science and Biotechnology,2012,21(4):1129-1134.
[10]BEZERRA R S,LINS E J F,ALENCAR R B,et al.Alkaline protease from intestine ofNiletilapia(Oreochromisniloticus) [J].Process Biochemistry,2004,40(5):1829-1834.
[11]刘波,邬应龙,张霞,等.红曲霉固态发酵产木聚糖酶培养基的响应面优化[J].食品工业科技,2013,35(1):254-258,314.
[12]胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4):49-61.
[13]李娟.利用木糖生产乳酸菌株的选育及发酵条件优化[D].大连:大连理工大学,2013.

