巢式PCR与LAMP方法在蜱的莱姆病螺旋体检测中的应用
张 琳,侯学霞,耿 震,郝 琴
莱姆病是一种主要经蜱传播的人兽共患病,可引起人体多系统、多器官的损害。其致病病原体为伯氏疏螺旋体(Borreliaburgdorferi),俗称莱姆病螺旋体。据报道,现已有全世界五大洲70多个国家有莱姆病的存在,且发病区域和发病率均呈扩大和上升趋势,该病已被世界卫生组织(WHO)列为重点防治研究对象[1]。
我国自上世纪八十年代开始研究莱姆病以来,已经发表了百余篇文献,报道了针对莱姆病在29个省(自治区、直辖市)开展了莱姆病血清学调查。被调查人群的血清抗体阳性率为0.22%~44.18%,并从20个省(自治区、直辖市)的病人、动物和/或蜱中分离出病原体,证实我国存在莱姆病的自然疫源地,部分地区还有典型莱姆病病例存在[2]。
我国莱姆病疫区主要分布于东北部、西北部和华北地区,分布范围广,高危人群多。然而针对我国各地林区媒介蜱的莱姆病带菌率的调查数据十分缺乏,已有的研究地点主要集中在黑龙江、吉林、辽宁、内蒙古、河北、北京、广东等地[3-5]。在青海省循化撒拉族自治县以及辽宁省的新宾满族自治县尚没有数据报道。据文献报道,青海省与辽宁省均存在莱姆病病例[6-7]。并且青海省循化县的草场面积广,达到213万亩,森林覆盖率达20.5%[8],辽宁省新宾县的森林面积达140万亩,覆盖率61%,拥有14个国有林场。因此我们选择在林区覆盖率较高的两个地点采集蜱样本,检测莱姆病螺旋体带菌率,是十分有必要的。
目前蜱带菌率的检测方法主要为PCR方法,包括:普通PCR和巢式PCR。常用的靶基因有:5S-23SrRNA基因间隔区,ospA,fla等。因为巢式PCR比普通PCR具有更高的敏感度和特异度,因此得到广泛的应用。2000年Notomi[9]等开发了一种新的核酸等温扩增方法,即环介导等温扩增法 (loop-mediated isothermal amplification,LAMP),其特点是在等温条件下即可高效、快速、高特异、高灵敏地扩增靶基因序列。2011年,杨吉飞等[10]建立了检测蜱中莱姆病螺旋体的LAMP方法。在本研究中,我们同时应用两种方法对蜱带菌率进行检测,以提高检测准确率,并对两种方法进行评价。
1 材料方法
1.1蜱样品的采集 蜱采集地点位于青海省循化撒拉族自治县以及辽宁省新宾满族自治县。采用布旗法采集游离蜱,同时从调查点自然放牧的牛羊体表采集饱血蜱,放入标本瓶保存于4 ℃。
1.2主要试剂 DNA提取试剂盒(DNeasy®Blood & Tissue Kit)由德国QIAGEN 公司提供。引物由天一辉远生物公司合成。PCR相关试剂由天根生物公司提供,LAMP相关试剂由广州华峰生物科技有限公司提供。
1.3阳性对照莱姆病螺旋体DNA的提取 将我实验室保存的PD91菌株于BSK培养基中传代培养,当菌体浓度达到107/mL时,将全部培养基装至1.5 mL Eppendorf离心管中,13 200 r/min离心30 min,弃去上清液,然后用0.01 mol/L pH7.4 PBS洗涤3遍,弃去上清液,然后加入100 μL ddH2O重悬,恒温金属浴上100 ℃水煮10 min,最后3 500 r/min离心5 min,吸取上清液保存于-80 ℃冰箱,备用。
1.4蜱样本莱姆病螺旋体检测
1.4.1蜱样品DNA的提取 采用DNeasy®Blood & Tissue Kit(DNA 提取试剂盒),提取112只蜱标本DNA。
1.4.2巢式PCR
1.4.2.1引物的设计 引物参照文献[11]的rrf(5S)-rrl(23S) rRNA基因间隔区巢式PCR的引物,引物序列见表1。
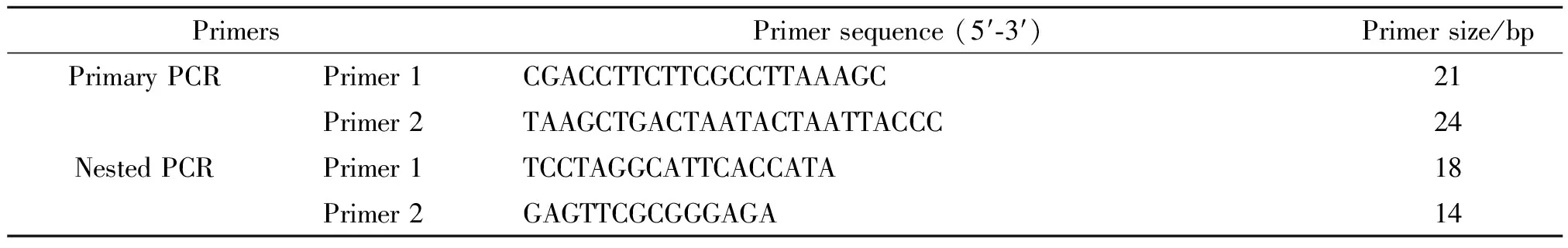
表1 rrf-rrl间隔区巢式PCR引物序列
1.4.2.2巢式PCR反应体系 50 μL反应体系:2×Taq MasterMix 25 μL,上下游引物(100 μmol/L)各1 μL,第1轮模板4 μL,第2轮模板0.5 μL。
1.4.2.3巢式PCR反应条件 94 ℃预变性5 min,94 ℃变性45 s,53 ℃退火45 s(第2轮退火温度为55 ℃),72 ℃延伸45 s,35个循环后72 ℃延伸5 min。
1.4.2.4巢式PCR产物检测 巢式PCR产物经2%琼脂糖凝胶电泳,凝胶成像仪成像拍照。阳性片段约为250 bp左右。
1.4.3环介导等温扩增技术(LAMP)检测莱姆病螺旋体基因片段 参考文献[13],以16s rRNA为靶基因设计LAMP引物,分别是上游外侧引物(F3,5′-ttccccgtttggggtcta-3′)和下游外侧引物(B3, 5′- gggccatgatgatttgacgt -3′),上游内侧引物(FIP, 5′-cgttgcgggacttaacccaacattttatacaggtgctgcatggttg-3′)和下游内侧引物(BIP,5′- accagcatgtaatggtggggactttttcctcaccttcctccgac -3′)。反应体系体积共25 μL,包括10×反应缓冲液(2.5 μL)、Primer Mixture(1.3 μL,包括100 μmol/L的FIP和同浓度的BIP各0.4 μL,20 μmol/L的F3和同浓度的B3各0.25 μL)、MgSO4(100 mmol/L, 2 μL)、dNTP(10 mmol/L, 3 μL)、Betaine(2.5 mol/L, 8 μL)、Bst DNA聚合酶(1 μL)和Target DNA(7.2 μL)。反应条件为63 ℃ 90 min,80 ℃ 5 min灭活酶。扩增产物取5 μL于2%琼脂糖凝胶(含5% Goldenview荧光染料)中电泳,100 V电压下电泳约40 min,在凝胶成像仪中成像并保存。
2 结 果
2.1蜱带菌率 采用巢式PCR与LAMP方法检测蜱共计112只。其中青海省循化县蜱为51只,巢式PCR检测9只阳性,LAMP检测6只阳性,两种方法共检测到12份阳性(3份标本2种方法均为阳性),青海循化蜱标本的总阳性率为23.53%(12/51);辽宁省新宾县蜱61只,巢式PCR检测11只阳性,LAMP检测9只阳性,两种方法共检测到18份阳性(2份标本2种方法均为阳性),辽宁省新宾县蜱标本的阳性率为29.51%(18/51)(见表2)。
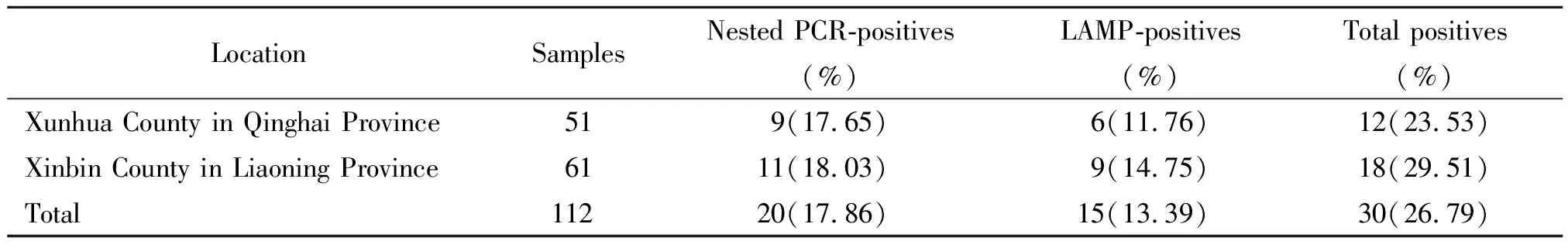
表2 112份蜱标本的巢式PCR和LAMP检测结果
2.2Nest-PCR和LAMP方法比较 在112只蜱中,巢式PCR共检测出20只蜱莱姆病螺旋体阳性,阳性率为17.86%(20/112);LAMP方法共检测出15只阳性,阳性率为13.39%(15/112)。两种方法差异无统计学意义(χ2=0.85,P>0.05)(见表1)。在两种方法对112份蜱标本的检测中,5份标本巢式PCR和LAMP均为阳性,15份巢式PCR检测阳性的样本,LAMP检测为阴性,10份LAMP检测阳性的标本,巢式PCR检测为阴性(见表3)。

表3 巢式PCR与LAMP两种方法检测结果对比
3 讨 论
莱姆病分布广泛,全球已有70多个国家报告发现该病,且发病率呈上升趋势,新的疫源地被不断发现。我国29个省(市、自治区)的人群存在不同程度的莱姆病感染。由于莱姆病的传播,依靠蜱作为传播媒介,因此要深入地探讨莱姆病的发生与传播的机制,首先了解各地蜱的莱姆病螺旋体的带菌率。
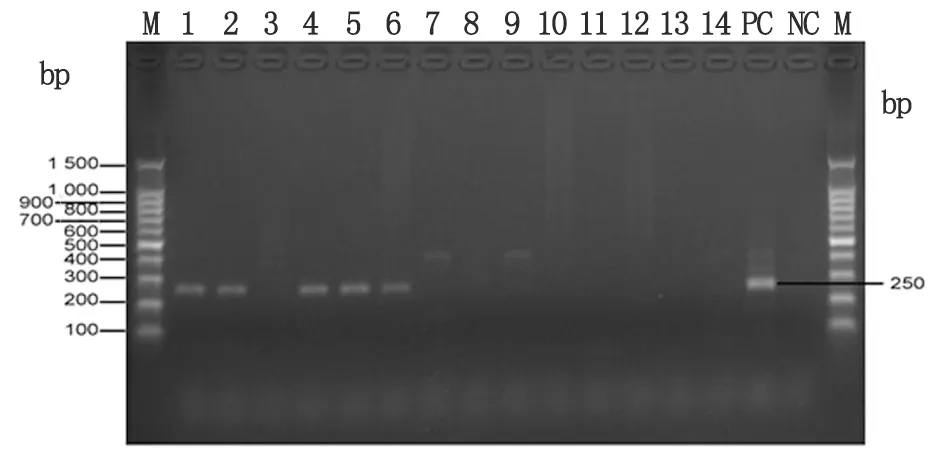
图1 部分蜱样本巢式PCR电泳结果
我们的采样点分别位于青海省循化县和辽宁省抚顺新宾县的岗山。循化县位于青海省东部,属青海省海东市管辖,循化县内平均海拔2 300 m,地处黄河谷地,全县草场面积213万亩,森林覆盖率达20.5%,草场以温性草原(长芒草群系、芨芨草群系、冷蒿群系和冰草群系)和高寒草甸(蒿草群系、高山蒿草群系、矮生蒿草群系和线叶蒿草群系)为主[12]。辽宁抚顺的新宾县的森林面积达140万亩,覆盖率61%,拥有14个国有林场,草地面积广。我国莱姆病疫区主要分布于东北部、西北部和华北地区,而疫区则主要集中在林区,林区人群的感染率可达44.18%,为我国人群平均感染率的5倍还多。因此我们选择在林区覆盖率较高的两个地点采集蜱样本,检测莱姆病螺旋体带菌率。
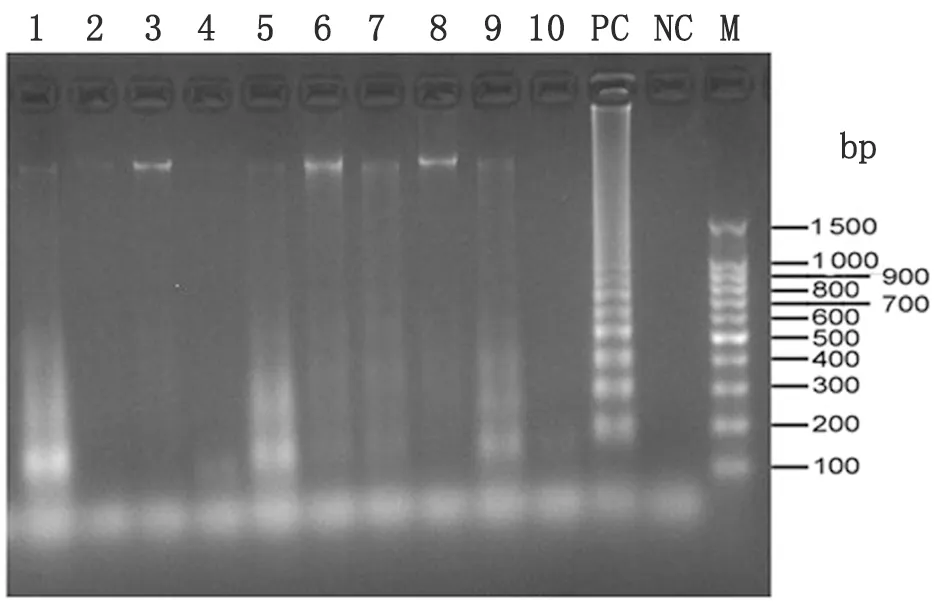
图2 部分蜱样本LAMP电泳结果
我们分别采用巢式PCR与LAMP两种方法检测蜱的莱姆病螺旋体带菌率,共计112只,采用巢式PCR方法共检测出20份样本莱姆病螺旋体阳性,检测阳性率为17.86%;采用LAMP方法共检测15份阳性,阳性率为13.39%。两种方法检测标本的阳性率在统计学上差异无统计学意义。但是进一步比较两种方法发现,在对112只蜱标本的检测中,只有5份标本巢式PCR和LAMP检测均为阳性,15份巢式PCR检测阳性的标本,LAMP检测为阴性,10份LAMP检测阳性的标本,巢式PCR检测为阴性。两种方法检测的结果不一致,在杨吉飞等建立的莱姆病螺旋体16S rRNA LAMP方法检测蜱样本的文献中也有报道[10]。可能是由于两种方法的敏感性不同、靶基因不同、以及Bst酶活性等原因造成的[10,12-13]。两种方法共同使用,可以使结果更加全面和准确。
同时本研究首次报道了我国两个林区覆盖面积较高地区的蜱莱姆病带菌率,完善了我国莱姆病研究中的蜱带菌率的研究数据。为更加系统的研究我国莱姆病发生和传播模式提供基础数据。
参考文献:
[1]Piesman J. Strategies for reducing the risk of Lyme borreliosis in North America[J]. Zentralbl Bakteriol, 2006, 296(S1): 17-22.
[2]Zhang ZF, Wan KL, Zhang JS, et al. Studies on epidemiology and etiology of Lyme disease in China[J]. Chin J Epidem, 1997, 18(1): 8. (in Chinese)
张哲夫,万康林,张金声,等.我国莱姆病的流行病学和病原学研究[J].中华流行病学杂志,1997, 18(1):8.
[3]Du LY, Chen XN, Sun Y, et al. The investigatin of primary vector of Lyme disease in Chengde forest region[J]. Chin J Zoonoses, 2005, 21(6): 534-535. (in Chinese)
杜娈英,陈晓宁,孙毅,等.承德林区莱姆病主要生物媒介的调查 [J].中国人兽共患病学报, 2005, 21(6):534-535.
[4]Du ZS, Wan KL, Wang CS, et al. Epidemilogical investigation and gene classification of Lyme disease in Jilin province[J]. Chin J Zoonoses, 2007, 23(8): 836-838. (in Chinese)
杜占森,万康林,王春生,等.吉林省莱姆病流行病学调查[J].中国人兽共患病学报,2007, 23(8):836-838.
[5]Wan KL, Zhang ZF, Dou GL, et al. Investigation on primary vectors ofBorreliaburgdorferiin China[J]. Chin J Epidemol, 1998, 19(5): 263-266. (in Chinese)
万康林,张哲夫,窦桂兰,等.中国莱姆病螺旋体主要生物媒介的调查研究[J].中华流行病学杂志, 1998, 19(5):263-266.
[6]Liu GR, Ma XL, Qu YZ, et al. Epidemiological investigation of lyme disease in three countys in Qinghai[J]. Chin J Public Health, 1995, 14(4): 202. (in Chinese)
刘光润,马秀兰,曲月照,等.青海省三县林区莱姆病血清流行病学调查[J].中国公共卫生学报, 1995, 14(4):202.
[7]Cai DH, He YX, Wang JS, et al. The investigation of Lyme disease in Qingyuan County[J]. Chin J Vector Bio Ctrl, 1994, 5(5): 382-383. (in Chinese)
蔡东浩,何亚轩,王金生,等.清原县莱姆病自然疫源地调查[J].中国媒介生物学及控制杂志,1994, 5(5):382-383.
[8]Yuan QS. Type of vegetation and distribution in Xunhua county[J]. Qinghai Prataculture. 2012, 21(1): 46-49. (in Chinese)
袁青杉.循化县植被类型及分布 [J].青海草业, 2012, 21(1):46-49.
[9]Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): e63. DOI: 10.1093/nar/28.12.e63
[10]Yang J, Guan G, Niu Q, et al. Development and application of a loop-mediated isothermal amplification assay for rapid detection ofBorreliaburgdorferisl in ticks[J]. Transbound Emerg Dis, 2011, 60(3): 238-244. DOI: 10.1111/j.1865-1682.2012.01335.x
[11]Huang HN, Ding Z, He J, et al. Investigation on Borrelia burgdorferi infection in ticks and animal from a forest area of Jilin province[J]. Chin J Zoonoses,2006,22(8):785-788. (in Chinese)
黄海楠,丁壮,何静,等.吉林林区动物莱姆病螺旋体感染的调查研究[J].中国人兽共患病学报,2006,22(8):785-788.
[12]Kaneko H, Kawana T, Fukushima E, et al. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances[J]. J Biochem Bioph Methods, 2007, 70(3): 499-501.
[13]Paris DH, Blacksell SD, Newton PN, et al. Simple, rapid and sensitive detection ofOrientiatsutsugamushiby loop-isothermal DNA amplification[J]. Trans R Soc Trop Med Hyg, 2008, 102(12): 1239-1246. DOI: 10.1016/j.trstmh.2008.04.040

