冷冻干燥过程中重要参数塌陷温度的研究
杨智,李代禧,张燕,郭柏松,杨春生,赵凤
(1.上海交通大学药学院,上海 201108;2.上海东富龙科技股份有限公司,上海 201108)
冷冻干燥是目前广泛应用的生物制品保存方法[1],但是冻干过程干燥速率低、时间长、能耗大等不足,导致生产成本较高,因此优化和改进冻干过程是当前面临的重要问题[2]。冷冻干燥过程可分为预冻、一次干燥、二次干燥[3]。其中一次干燥是整个冷冻干燥过程中周期最长的阶段,一次干燥周期又与其升华时的温度相关。如果能尽量提高一次升华时的样品温度,就可以很大程度上缩短升华干燥时间。样品温度每升高1℃,干燥时间缩短13%[2,4]。但生物制品温度过高,会引起塌陷或者熔融,进而导致干燥层的多孔结构丧失、残余水分增多、复水时间延长,严重的将会导致生物制品活性丧失。因此,冷冻干燥中寻找一次升华时的临界温度尤为重要。
目前绝大多数都是以共熔温度作为一次升华时的临界温度,很少关于玻璃化转变温度Tg,塌陷温度Tc的数据更是甚少提到[5-6]。关于制品的塌陷温度和相应的玻璃化转变温度/共熔温度之间的相互关系几乎没有被研究过。
本文利用冻干显微镜和差示扫描量热仪研究氯化钠盐溶液、蔗糖水溶液、海藻糖水溶液和甘露醇水溶液的塌陷温度和玻璃化转变温度,分析研究两者之间的关系。
1 实验部分
1.1 材料与仪器
纯化水,自制;果糖、蔗糖、海藻糖、甘露醇、氯化钠均为分析纯;液氮(纯度>99.999%);氮气(纯度>99.99%)。
LYOSTAT2冻干显微镜;差示扫描量热仪(DSC);纯水仪(明澈TM-D 24UV纯水系统 );XS205电子天平;水系针筒式滤膜过滤器,自制。
1.2 溶液制备
按质量浓度配制供试品溶液,以配制2%蔗糖为例。用电子天平精密称取蔗糖0.200 0 g,加纯化水至10.000 0 g溶解,用 0.22 μL滤膜过滤待用。其他供试品溶液依此法配制。
1.3 实验方法
1.3.1 崩解温度测定 采用冻干显微镜(配有液氮冷却系统、可编程温度控制器和真空泵)测量。显微镜放大倍数为100倍。载玻片上放置一银环,取2 μL样品溶液于银环和光源中间,压力保持在1 Pa。温度标定采用氯化镁、氯化钠和氯化钾(共晶熔融温度分别为 -33.6,-21.1,-10.7 ℃)。样品以10℃/min从25℃降温至-55℃,等温5 min,抽真空,然后以2℃/min升温。本文中的塌陷温度Tc为样品在干燥界面和冷冻界面交界处出现亮点时的温度。每个实验重复3次,取平均值。
1.3.2 DSC检测 吹扫气体采用50 mL/min左右速率的氮气(纯度>99.99%,氮气在高至600℃的温度范围内都是惰性的,因此是DSC测量的标准气体)。温度标定采用铟和锌(熔融温度分别为156.6℃和419.47℃)。样品皿采用铝坩埚,盖钻孔,用压片机压制。样品质量浓度分别为2%,5%,8%。在参比侧放置与样品皿相同的空皿。样品均以10℃/min从25℃降温至-55℃,等温5 min,然后以2℃/min升温至20℃。在升温扫描时读取数据,玻璃化转变温度Tg,取中点温度。每个实验重复3次,取平均值。
2 结果与讨论
2.1 崩解温度
显微镜冻干实验表明,对于降温时发生玻璃化转变的样品,如果糖、蔗糖和海藻糖,其水溶液升温时均发生塌陷,临界温度为塌陷温度。塌陷温度可分为微塌陷温度和塌陷温度。前者表示的是样品结构的局部丧失,干燥界面与升华界面交界处出现小的孔洞或裂缝;后者对应样品结构的整体丧失,干燥界面与升华界面交界处出现大的孔洞或裂缝,干燥界面与升华界面已不再相连。本实验定义的塌陷温度为微塌陷温度。降温速率为10℃/min,升温速率为2℃/min条件下,各物质在不同浓度时的塌陷温度、共晶熔融温度和玻璃化转变温度见表1。
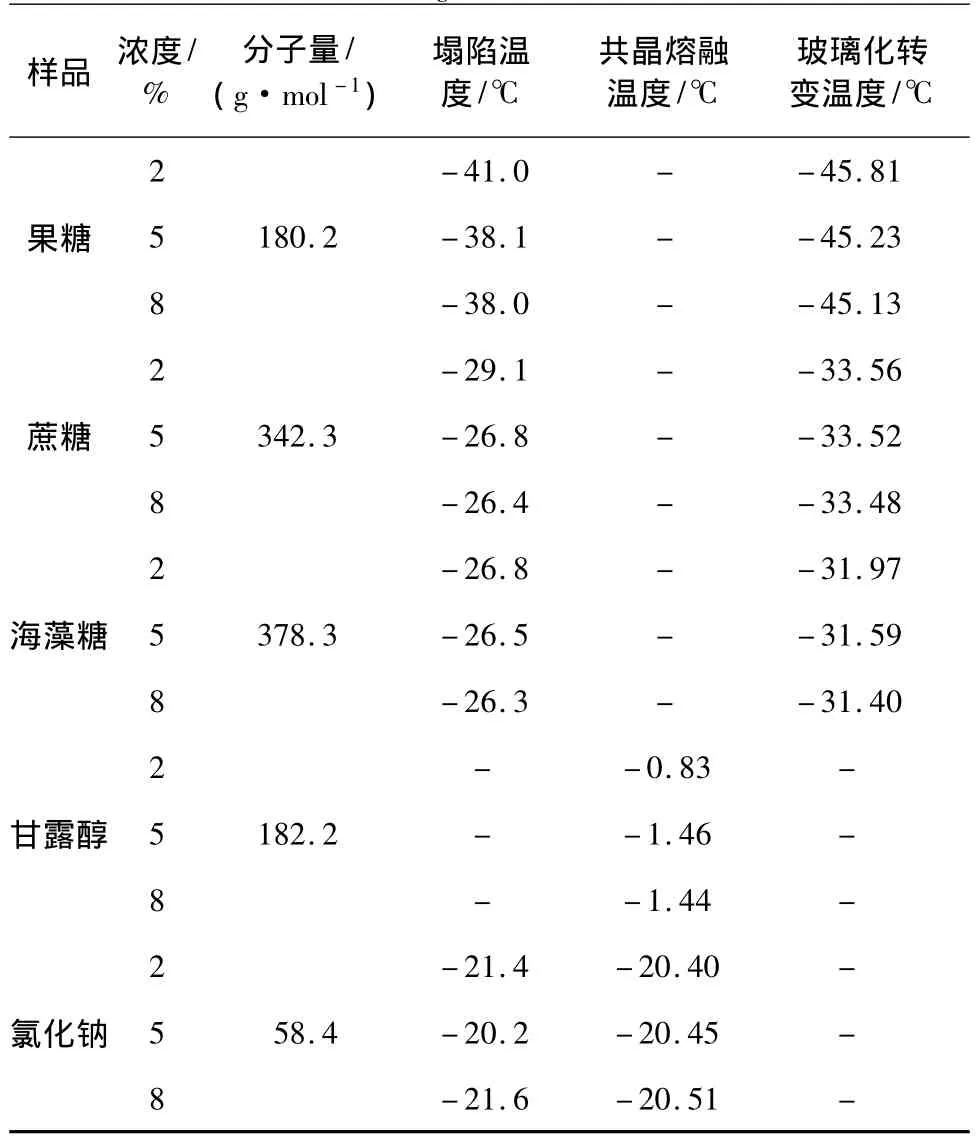
表1 二元水溶液的塌陷温度(Tc)、共晶熔融温度(Tem)和玻璃化转变温度(T'g)Table 1 Collapse temperature(Tc),eutectic melting temperature(Tem)and glass transition temperature(T'g)of aqueous solutions
由表1可知,果糖、蔗糖和海藻糖的塌陷温度和玻璃化转变温度均随样品质量分数的增大而增大,这与文献[7-9]结论一致。
降温速率对物质的塌陷温度的影响见表2。
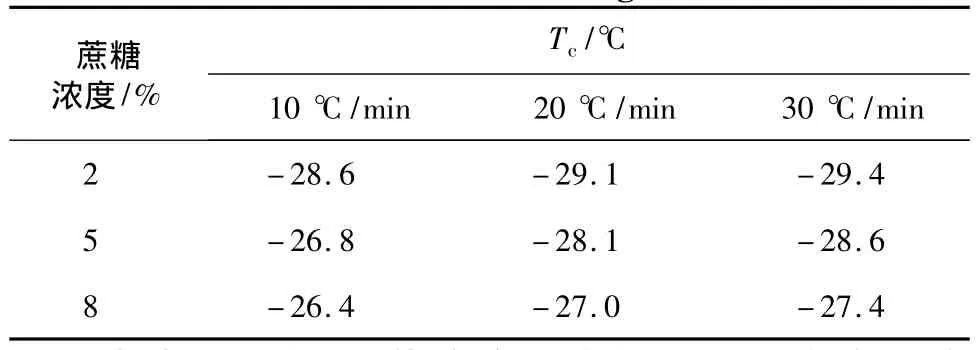
表2 不同质量浓度蔗糖溶液在不同降温速率下的塌陷温度Table 2 Collapse temperature of sucrose under different cooling rate
由表2可知,3种溶液浓度的塌陷温度均随降温速率的增大而减少。因为在冻干过程中,降温速率过快,会导致结晶不充分,生成的冰晶颗粒较大,升华时传质阻力变大,升华速率降低,塌陷温度就会减小。
实验还发现,甘露醇在升温过程中未发生崩解,该物质热稳定性较好,作为保护剂,可以很好地提高冻干样品的塌陷温度,从而提高样品预冻温度,大大缩短干燥时间,降低成本。
图1是甘露醇水溶液的显微图像。
从图中可以直观看出,在整个干燥过程中,溶液都未发生崩解,直至全部升华。

图1 2%甘露醇溶液的冻干显微图像Fig.1 Microscopic observations of freeze-drying of 2%mannitol aqueous solution
图2为2%海藻糖水溶液的冻干显微图像。

图2 2%海藻糖溶液的冻干显微图像Fig.2 Microscopic observations of freeze-drying of 2%trehalose aqueous solution
由图2可知,在-26.9℃时,干燥界面和冻结界面结构都比较完好,没有发生任何塌陷;当样品温度升高到-26.6℃时开始发生塌陷,干燥界面与冻结界面交界处局部出现了小的孔洞,孔洞不相连,但随着温度的升高,孔洞会逐渐变大,并连成一片,直至整体塌陷。此时升华界面移动速度明显降低,表明干燥层的粘性流动堵塞了水蒸气逸出通道。
2.2 塌陷温度与相应的玻璃化转变温度分析
由表1可知:①蔗糖和海藻糖的塌陷温度都比其相应的玻璃化转变温度略高些,差值在5℃左右。因此,以玻璃化转变温度作为临界温度有些保守,而应以塌陷温度作为临界温度。另外,塌陷温度和玻璃化转变温度/共晶熔融温度的实验环境不同,塌陷温度是利用FDM在真正的冷冻干燥过程中测得的;而玻璃化转变温度/共晶熔融温度是利用DSC在封闭环境下测得的,所以,对于晶体或是非晶体,塌陷温度作为一次升华温度都更能真实地反映产品特性;②无论是玻璃化转变温度还是塌陷温度,都随着样品分子量的增大而呈增长趋势。因此选用冻干保护剂时,在保证产品品质的情况下,应优先选用大分子保护剂,以提高升华干燥温度,缩短干燥时间,降低生产成本。
在DSC实验中发现,甘露醇在升温过程中-25℃时出现一个放热峰,且明显低于在降温过程中生成的结晶放热峰。
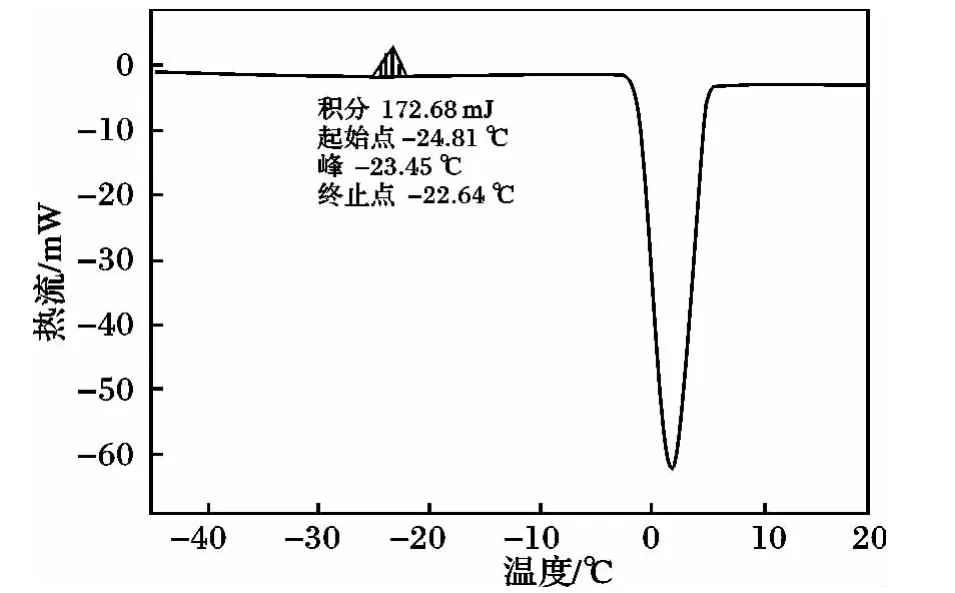
图3 甘露醇的DSC曲线图Fig.3 DSC curve of mannitol
经分析该峰为冷结晶峰。冷结晶是由于物质内部该结晶的部分,因为温度与时间的限制,无法完全结晶,当温度高于T'g后,这些未完成结晶的部分由于分子链柔软而具有足够的运动能力,重新排列成为新生结晶的现象[10-11]。冷结晶过程中分子链排列从无序到有序,是一个熵减的过程,会放出热量,在DSC扫描曲线上呈现放热峰,温度值小于熔融温度。
对于降温时发生共晶的样品,如氯化钠,其水溶液升温到共晶熔融温度时,冻结层和干燥层整体发生融化。
图4为氯化钠水溶液的冻干显微图像。
由图4可知,氯化钠溶液在-20.4℃时,干燥界面和冷冻界面结构都完整;而达到塌陷温度-20.2℃,整体发生了融化。

图4 5%氯化钠水溶液的冻干显微图像Fig.4 Microscopic observations of freeze-drying of 5%NaCl
3 结论
(1)测定了氯化钠、蔗糖、海藻糖和甘露醇等水溶液的玻璃化转变温度和塌陷温度。玻璃化转变温度和熔融温度是在封闭环境下测得的,塌陷温度是在真正的冷冻干燥过程中测得的,所以塌陷温度更能真实地反应产品的特性,对冷冻干燥具有重要的指导意义。
(2)蔗糖和海藻糖的水溶液在降温时发生玻璃化转变,塌陷温度和玻璃化转变温度比较接近,但并不相等;而氯化钠和甘露醇二元水溶液降温时发生结晶,塌陷温度与熔融温度也不相等,其中甘露醇在升华过程中未发生崩解。
(3)塌陷温度一般都比相应的玻璃化转变温度高5℃左右。因此,降温过程中,样品不论是发生玻璃化转变还是结晶,均以塌陷温度作为临界温度,可在保证产品品质的前提下,提高升华干燥速率,缩短冻干时间。
(4)样品的质量分数、降温速率以及分子量的大小都会对塌陷温度产生影响。质量分数越大,降温速率越小,则塌陷温度越高。对于不同的物质,分子量大的物质,则塌陷温度大。
[1]左建国,李维仲,翁林岽.冷冻干燥中升华界面的临界温度实验[J].农业机械学报,2010,41(10):126-133.
[2]左建国,李维仲,翁林岽.冷冻干燥参数对塌陷温度的影响分析[J].农业机械学报,2011,42(2):126-128.
[3]华泽钊.冷冻干燥新技术[M].北京:科学出版社,2005:1-4.
[4]Pikal M J.Use of laboratory data in freeze drying process design:Heat and mass transfer coefficients and the computer simulation of freeze drying[J].Journal of Parenteral Science and Technology,1985,39(3):115-138.
[5]崔清亮,郭玉明,程正伟.冷冻干燥物料共晶点和共熔点的电阻法测量[J].农业机械学报,2008,39(5):65-69.
[6]程远霞,陈素芝,朱文学,等.土豆冷冻干燥工艺的试验研究[J].食品科学,2005,26(3):113-116.
[7]Meister E,Gieseler H.Freeze-dry microscopy of protein/sugar mixtures:Drying behavior,interpretation of collapse temperatures and a comparison to corresponding glass transition data [J].Journal of Pharmaceutical Science,2009,98(9):3072-3087.
[8]Knopp S A,Chongprasert S,Nail S L.The relationship between the TMDSC curve of frozen sucrose solutions and collapse during freeze-drying[J].Journal of Thermal Analysis and Calorimetry,1998,54(2):659-672.
[9]Meister E,Saiscc S,Gieseler H.Freeze-dry microscopy:Impact of nucleation temperature and excipient concentration on collapse temperature data[J].AAPS Pharm Sci Tech,2009,10(2):582-588.
[10]张雪芹,王超先,郝伟萍.差示扫描量热法对PET热性能的研究[J].塑料工业,2001,29(5):42-43.
[11]吴唯,毕丽颖,陈玉,等.PET/PEN共混物的结晶与冷结晶性能及其机理[J].高分子材料科学与工程,2013,29(1):67-70.

