不同运动强度对青春期肥胖大鼠脂联素的影响
柏友萍, 李 萌, 崔建飞, 许晓东, 戴园园, 张 晶, 聂刘旺
(1.安徽师范大学 体育学院,安徽 芜湖 241003;2.安徽师范大学 生命科学学院,安徽 芜湖 241000)
不同运动强度对青春期肥胖大鼠脂联素的影响
柏友萍1, 李 萌1, 崔建飞1, 许晓东1, 戴园园1, 张 晶1, 聂刘旺2
(1.安徽师范大学 体育学院,安徽 芜湖 241003;2.安徽师范大学 生命科学学院,安徽 芜湖 241000)
目的:探讨不同运动强度对青春期肥胖大鼠内脏脂肪组织脂联素mRNA表达、蛋白表达及血浆浓度的影响.方法:选取青春期SD大鼠普食8只为单纯空白对照组(C),高脂诱导青春期肥胖32只随机分为4组,每组8只,分为静止对照组(OC)、低运动强度组(OL)、中运动强度组(OM)和高运动强度组(OH).运动速度为15-18m/min、21-25m/min和28-32m/min,坡度均为0,1h/天,5次/周,在大鼠专用运动跑台持续8周的运动干预.8周后用qRT-PCR测内脏脂肪组织脂联素mRNA表达,免疫组化测内脏脂肪组织脂联素蛋白表达,ELISA测血浆脂联素浓度.结果:8周后OL、OM、OH组体重、内脏脂肪重量及体脂率均显著低于OC组(P<0.01),OM、OH组内脏脂肪重量及体脂率显著低于OL组(P<0.01);OM、OH组内脏脂肪脂联素mRNA高于OC、OL组(P<0.05,P<0.01);OH组脂联素蛋白质的表达均比OC组增加;OL、OM、OH组血浆脂联素浓度较OC组显著提高(P<0.01),OM、OH组显著高于OL组(P<0.05,P<0.01).结论:通过8周不同运动强度干预均显著降低了青春期肥胖大鼠体重、内脏脂肪量和体脂率,上调了内脏脂肪组织脂联素 mRNA的基因表达及蛋白表达,升高血浆脂联素浓度,均为中、高运动强度效果较明显.
运动强度;青春期肥胖;脂肪组织;体脂率;脂联素
目前全世界有超过 15 亿的超重和肥胖人群,预计到 2030 年超重和肥胖人群将增加到21.6亿和11.2亿[1].2010年国民体质监测结果显示,青春期超重和肥胖人群在惊人的增长[2].脂肪细胞的数目增加或体积的增大是肥胖主要特征之一,在青春期二者兼有.青春期肥胖可能引起成人期的健康负担,已被视为亟待解决的一个公共卫生问题.运动有助于减肥已为人们所熟知,如何进行科学运动减肥引起学术界的研究兴趣.在健身中采用运动处方进行体育锻炼是比较科学的,运动强度制订是否恰当直接影响运动处方实施的效果,在运动减肥中运动强度同样关键,适宜运动强度制定是决定运动减肥效果的最重要核心要素之一[3].
脂联素(adiponectin,ADP)是Yamanchi[4]等领导的研究小组发现的一种脂肪细胞分泌的激素蛋白,在脂肪组织中大量表达,主要由脂肪细胞分泌,具有多种生物学功能.脂联素是脂肪组织特异性分泌,在肥胖形成过程中,脂联素分泌发生异常,对机体的胰岛素抵抗和糖脂代谢起着重要作用[4].目前,脂联素的分泌调控与肥胖的关系一直是国内外的研究热点.能否通过不同运动强度干预来调节脂联素在内脏脂肪组织中的基因表达、蛋白表达和血液中的浓度以达到防控肥胖预防相关疾病的目的?弄清这个问题对于明晰运动减肥的作用机制无疑具有重要的理论价值.本研究拟采用高脂饮食饲喂SD大鼠7周,诱导建立青春期单纯肥胖模型,分别设置高、中和低运动强度进行运动干预.8周后,采用qRT-PCR、免疫组化及酶联免疫等技术,研究不同运动强度对青春期肥胖大鼠的体重、内脏脂肪重量及体脂率等减肥相关指标的影响,对青春期肥胖大鼠的内脏脂肪组织脂联素的mRNA基因表达和蛋白表达及血浆浓度的影响.
1 材料与方法
1.1实验动物与分组
3周龄的离乳雄性SD幼鼠,清洁级,体重75.52±7.64 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK (沪)2012-0002.随机分为普食组和高脂组,体重无差异(P>0.05).普食组喂普通饲料,高脂组喂高脂饲料,7周建模成功(成功标准:肥胖组体重>20%对照组体重[5]),对照组体重为378.92±24.70(g),根据上述标准肥胖倾向大鼠体重应为454.70(g),本实验建模成功大鼠体重为469.82±19.25(g).选取自然生长8只青春期SD大鼠为单纯空白对照组(C);选取32只肥胖大鼠,随机分为4组:肥胖对照组(OC),运动组分为低运动强度组(OL)、中运动强度组(OM)和高运动强度组(OH),每组8只(见表1).实验期间,大鼠分笼饲养,饲养房的温度为20℃±2℃,相对湿度50%-70%,每天光照为12h,每周测量一次体重和体长.

表1 实验大鼠分组的一般情况(M±SD)
注:one-way ANOVA分析,P>0.05(C组除外)
1.2运动方案设计与实施
运动方案设计为低、中、高三种运动强度,干预8周.开始进行2-3次/天的适应性跑台练习,训练3天.C组和OC组不施加运动负荷,安静状态下笼养.实验组的运动方式以动物运动模型Bedford方案[6]为依据进行改进,OL、OM和OH组跑台速度分别为15-18m/min、21-25 m/min和28-32 m/min,跑台坡度为0,60min/天, 5次/周,周一、周四休息,干预期间喂普通饲料,每天进食量控制一致,自由饮水,每周末运动干预结束后测量体重、体长.
1.3主要实验仪器与试剂
仪器:电子秤(JM-A20001/中国),电子分析天平(BS223S/北京),6跑道大鼠跑台(北京).全自动生化分析仪(日立7060),酶标仪(Tecan Sunrise/瑞士),洗板机(Tecan Columbus Washer/瑞士),冰冻切片机(LEICACM1900型/德国),万能荧光显微镜BX61高分辨成像系统(DP71/日本),实时荧光定量PCR仪(博日line-gene K FQD-48A),超低温高速离心机(Eppendorf Centrifuge 5417).
试剂:免疫组化抗体试剂盒(北京博奥森),脂联素的ELISA 试剂盒(美国R&D公司),M-MLV反转录酶(Promega M1705),SunShineBioTM总RNA提取试剂(SunShineBio SN114).
1.4ELISA测定血浆脂联素
8周干预后,对实验大鼠禁食12h,禁水6h.每组随机取6只,用水合氯醛溶液(8%)腹腔注射麻醉,麻醉后测量体重,剖腹取腹主动脉血,分离血浆,保存在-80℃冰箱待ELISA测定.脂联素采用ELISA中的双抗体一步夹心法酶联免疫吸附试验测定,ELISA操作方法严格按照试剂盒使用说明书提供的程序进行,脂联素浓度值:在Excel工作表中,以标准品浓度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,脂联素回归曲线方程为y=0.026x-0.001,标准品试剂测量值与实际测量值相关系数r=0.999,把该方程代入Excel工作表中,得到相应的浓度值,此浓度值再乘以5为样本实际浓度.
1.5免疫组化测定内脏脂肪组织脂联素蛋白表达
每组中剩下2只麻醉后剖胸,从左心室灌注4%的甲醛溶液,从右心耳流出,固定大鼠,取内脏脂肪组织称重.取部分内脏脂肪组织固定于4%的甲醛和蔗糖混合溶液中,待免疫组化测定.选取少许内脏脂肪组织,加胶包埋放入-20℃冰冻切片机内,连续冰冻切片40μm,按顺序放入多孔板的PBS溶液中,然后捞至玻璃片上.用过氧化氢与纯甲醇混合浸泡→缓冲液冲洗→0.3%Triton-x 100-PBS中浸泡→滴加小牛血清,室温孵育20min;擦干滴加一抗(脂联素)工作液4℃孵育36h,在常温下孵育2h后用PBS缓冲液洗→擦干滴加二抗室温孵育2h,PBS缓冲液洗→擦干滴加三抗室温孵育2h,PBS缓冲液洗→擦干转入显色液中.依次滴加A、B、C显色试剂显色3-15 min,观察显色结果.蒸馏水充分冲洗→脱水→透明→封片.最后转入显微镜下观察脂联素在脂肪组织的显色及采集图片.
1.6qRT-PCR测内脏脂肪组织中脂联素mRNA的表达
取内脏脂肪组织(附睾及肾周脂肪),称脂肪重量,取部分含血管少的脂肪组织立即置于Trizol中,保存在-80℃冰箱,待测脂联素 mRNA值.根据GenBank公布的SD大鼠脂联素基因和β-actin基因序列设计相应的引物,委托上海生工技术有限公司合成.脂联素rat-gAd-F:GGGACAACAATGGACTCTATG,rat-gAd-R:CTGTCGCCTGTTCTTTGATTC;β-actin Beta-Actin-F:GGGAAATCGTGCGTGACATT,Beta-Actin-R:GCGGCAGTGGCCATCTC.总RNA的提取→RT反应→SYBR Green Realtime-PCR.循环条件为 95℃变性55s,48℃退火(β-actin退火温度是 58℃)40s,79.5℃延伸45s,共40个循环.脂联素熔解曲线 Tm 79.5℃(见图1).按照上述实验方法得出数据,阈值与Ct值由软件自动得出.目的基因的相对表达量采用2-△Ct法来进行相对定量,其中△Ct=Ct目的基因-Ctβ-Actin).

图1 gAdiponect mRNA expression in visceral fat rats
1.7统计方法
对实验前后的一系列指标的数据,采用统计软件包SPSS17.0进行数据整理、统计分析,数据采用均数±标准差(M±SD)表示,多组间差异比较采用one-way ANOVA检验,P>0.05无显著性差异,P<0.05有显著性差异,P<0.01有非常显著性差异.
2 结果
2.1不同运动强度实验后体重、内脏脂肪量和体脂率的比较
由表2、图2和图3可知,该体重为禁食禁水麻醉后测量的大鼠体重,为更精确体脂率所用,取内脏脂肪组织用无菌吸水纸吸干后称重,体脂率=内脏脂肪重量/麻醉后体重×100%.①体重比较:OC组高于C组(P<0.05),OH组低于C组(P<0.01);OL、OM、OH组显著低于OC组(P<0.01),OL组高于OH组(P<0.05),OL高于OM组、OM高于OH组,但无差异(P>0.05).②内脏脂肪量和体脂率的比较:OL、OM、OH组显著低于C、OC组(P<0.01),OL组显著高于OM、OH组(P<0.05,P<0.01),C组与OC组、OM组与OH组之间无差异(P>0.05).该结果表明:运动能明显降低麻醉后体重,伴随运动强度增加而降低明显,中、高强度运动明显低于低强度运动;不同运动强度显著降低内脏脂肪量和体脂率,随着运动强度增加而下降明显,中、高强度运动明显低于低强度运动.麻醉后体重、内脏脂肪量和体脂率运动组均低于自然生长组.

表2 不同运动强度实验后大鼠体重、内脏脂肪量及体脂率比较(M±SD,n=8)
注:one-way ANOVA,与C比较:*表示(P<0.05),**表示(P<0.01),与OC比较:★表示(P<0.05)★★表示(P<0.01);与OL组比较:&表示(P<0.05),&&表示(P<0.01).

图2 不同运动强度实验后体重比较

图3 不同运动强度实验后内脏脂肪量和体脂率比较
2.2不同运动强度实验后内脏脂肪组织脂联素mRNA表达的比较
从表3可知,OM、OH组高于C、OC组(P<0.01),OM、OH组高于OL组(P<0.05,P<0.01),C、OC、OL组之间无显著性差异(P>0.05).肥胖的大鼠脂联素高于自然生长,运动能明显上调其mRNA表达,伴随运动强度增加而增大.
2.3不同运动强度实验后内脏脂肪组织脂联素蛋白表达的比较
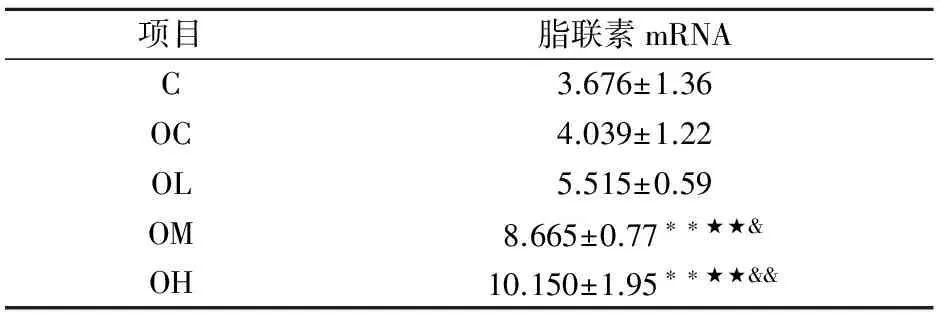
表3 不同运动强度实验后大鼠内脏脂肪组织脂联素mRNA表达比较(M±SD)
注:one-way ANOVA,与C比较:*表示(P<0.05),**表示(P<0.01);与OC比较:★表示(P<0.05),★★表示(P<0.01);与OL比较:&表示(P<0.05),&&表示(P<0.01).

图4 不同强度运动实验后大鼠内脏脂肪脂联素蛋白表达的比较
注:图A为内脏脂肪组织常规尼氏染色图×200,图B为不加一抗体免疫组化染色图,图C、图D、图F、图H、图J分别为添加脂联素一抗体蛋白表达图×400.
图4为青春期大鼠附睾及肾周脂肪组织中脂肪细胞,脂联素主要在内脏脂肪细胞质中表达.在尼氏染色切片上,脂滴被酒精及二甲笨溶解,细胞呈空泡状,胞核扁圆形,被脂滴推挤到细胞一侧,连同部分胞质呈新月形(见图A);免疫组化对照图为未加一抗体(脂联素)的蛋白表达图(图B);细胞呈空泡状,细胞核未显示,胞质呈薄层细线状,着色较浅;图C、图D为空白对照组和肥胖对照组(添加一抗体脂联素)脂联素蛋白表达免疫组化图,胞质呈薄层粗线状,着色较图B加深;图F、图H、图J分别代表低、中、高运动强度实验组添加一抗体(脂联素)蛋白表达免疫组化图,细胞呈空泡状,细胞核未显示,胞质呈粗线状,图H、图J颜色较图F深.从脂肪细胞体积比较显示:肥胖对照组大鼠的脂肪细胞体积大于其他各组,且随着运动强度增加,而内脏脂肪细胞的体积越小.
2.4不同运动强度实验后血浆脂联素浓度的比较
从表4可知,OL、OM、OH组显著高于C、OC组(P<0.05,P<0.01),C、OL、OM、OH组显著高于OC组(P<0.01),OM、OH组显著高于OL组(P<0.05,P<0.01),C、OC组显著低于OL组(P<0.05,P<0.01),OM和OH组之间无显著性差异(P>0.05).因此,青春期肥胖大鼠的血浆脂联素浓度显著低于自然生长大鼠;运动能提高脂联素水平,伴随运动强度增加而增长.
3 讨论
3.1不同运动强度对青春期肥胖大鼠肥胖相关指标的影响
青少年超重和肥胖的发生率逐年增高,已经成为世界范围内的一个公共健康问题.减肥的方法逐渐增多,如节食、运动、药物和外科手术等[7].研究表明[8-9],节食和外科干预来对抗肥胖,虽然某种程度上取得成功,但对肥胖者身体造成有害影响,对于青春期肥胖学生来说,最为安全有效的减肥方法是采用运动处方指导的科学运动减肥,在减肥的同时可以提高健康体适能.体重、体脂百分比已被作为评价健康体适能的重要相关指标,也是监测营养状况及评价生长发育指标,在临床和基础研究中具有重要应用价值[10].
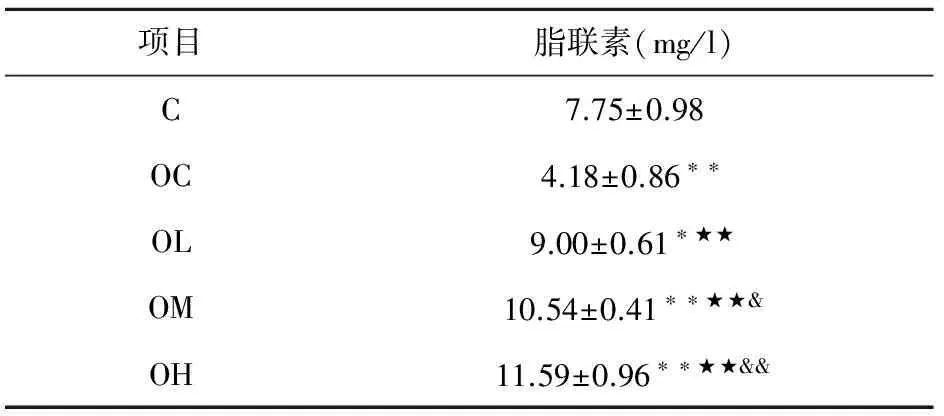
表4 不同运动强度干预大鼠血浆脂联素浓度比较(M±SD,n=6)
注:one-way ANOVA,与C比较:*表示(P<0.05),**表示(P<0.01),与OC比较:★表示(P<0.05),★★表示(P<0.01),与OL比较:&表示(P<0.05),&&表示(P<0.01).
有研究认为,中低强度有氧运动可以降低肥胖相关指标,如体脂百分比、肥胖指数,长期进行有氧运动能提高机体对脂肪的利用率,加速脂肪的动员速度,增加脂肪功能效率,降低体重和体脂百分比,从而提高运动能力[11-12].本实验室对青春期肥胖学生经过8周60%-70%F.C.运动强度减肥运动处方实施,其体重、体脂率、BMI均显著下降,有效改善了青春期肥胖学生的肥胖程度,取得良好的减肥效果[13-14].Levin BE[15]等研究发现,膳食诱导的肥胖大鼠经过4周跑台运动后,体重和脂肪含量与安静组相比都显著下降.本实验表明青春期肥胖大鼠体重,伴随运动强度增加而降低明显,中、高强度运动体重明显低于低强度运动;不同运动强度显著降低内脏脂肪量和体脂率,随着运动强度增加而下降明显,中、高强度运动明显低于低强度运动.体重、内脏脂肪量和体脂率运动组均低于自然生长组.
3.2不同运动强度对青春期肥胖大鼠脂肪组织脂联素的mRNA和蛋白表达影响
脂联素是一种具有生物活性胶原样蛋白质,具有多种生物学效应的细胞因子,在脂肪细胞分化时仅由白色脂肪组织合成,并在脂肪组织中mRNA大量表达,而脂联素受体却在多种组织中广泛表达[16-17].有研究证明[18],肥胖个体的脂联素浓度明显低于非肥胖者,而当体质量减轻后,脂联素浓度又升高.尽管脂联素是有脂肪组织合成,但表现为脂肪组织多而合成减少,脂肪组织重量减少,其浓度依然增加[19].闻颖等[20]在脂肪细胞分化过程中加入姜黄素,3T3-L1脂肪细胞脂联素mRNA水平增加,经姜黄素处理24h的成熟3T3-L1脂肪细胞脂联素mRNA水平增加.低脂联素水平是代谢综合征的一个独立危险因素,独立于肥胖、胰岛素抵抗及炎症标志物,血清脂联素水平降低是代谢综合征的特征性标志[21].
为了探究脂联素基因表达和蛋白表达水平是否是肥胖所具有的特征,不同运动强度对其产生怎样影响?本研究验证了高脂饮食诱导的青春期肥胖大鼠内脏脂肪组织中脂联素mRNA表达及蛋白表达的情况以及不同运动强度对其产生的影响.实验结果显示,肥胖的大鼠脂联素mRNA表达高于自然生长,运动能上调其mRNA表达,伴随运动强度增加而增大;肥胖大鼠内脏脂肪组织中脂联素蛋白表达与自然生长的大鼠无明显差异,运动能增加蛋白表达量,随着运动强度增加表达量递增,中、高强度差异明显;运动能上调内脏脂肪组织脂联素mRNA表达和蛋白表达,二者具有一致性.
4 结论
通过8周不同运动强度干预均显著降低了青春期肥胖大鼠体重、内脏脂肪量和体脂率,达到了较好的减肥效果;不同运动强度均上调了大鼠内脏脂肪组织脂联素 mRNA的基因表达及蛋白表达;不同运动强度导致大鼠血浆脂联素浓度显著升高;均为中、高运动强度效果较明显.
[1] KASTORINI CM, MILIONIS HJ, IOANNIDI A,et al. Adherence to the Mediterranean diet in relation to acute coronary syndrome or stroke nonfatal events:a comparative analysis of a case/case-control study[J]. Am Heart J,2011,162(4):717-724.
[2] 国家体育总局群体司.2010年国民体质监测公报[M].2011,10.
[3] TOBINA T, NAKASHIMA H, KOZAKO T, et al. Differences in high molecular weight adiponectin and adiponectin receptor alterations based on exercise and diet[J]. Medicine & Science in Sports & Exercise,2010,42(10):46-47.
[4] YAMAUCHI T, KAMON J, MINOKOSHI Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activaed protein kinase[J]. Nature Medicine,2002,8(11):1288-1295.
[5] CHANDLER P C, VIANA J B, OSWALD KD, et al. Feeding response to melanocortin agonist predicts preference for and obesity from a high-fat diet[J]. Physiol Behav,2005,85(2):221-230.
[6] BEDFOR D, TOBY G, CHARLES M, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[7] TREMBLAY MS, KATZMARZYK PT, WILLMS JD. Temporal trends in overweight and obesity in Canada 1981-1996[J]. Int J Obes RelatMetab Disord,2002,26:538-543.
[8] EBRAHIM K,naderali.Obesity and cardiovascular dysfunction:A role for resveratrol[J].Obesity Research ,Clinical Practice,2009,21(3):45-52.
[9] 赵雪梅.有氧健身操练习对中年女性体质的影响[J].上海体育科研,2003,24(1):45-46.
[10] SCHMITZ K H, HOLTZMAN J, COURNEYA K S,et al.Controlled physical activity trials in cancer survivors: a systematic review and meta-analysis[J].Cancer Epidemiol Biomarkers Prev,2005,14 (7):1588:1595.
[11] 林华,王洪.有氧健身操对女性BMI和WHR的影响[J].体育科学,2000,20(3):63-65.
[12] DOUGLAS M, OKAY PV, JAVKSON MM, et al.Exercise and obesity review article[J].Primary Care:Clinics in Office Practice,2009,2(36):379-393.
[13] 柏友萍,张晶,孙骏,等.减肥运动处方对超重肥胖大学生体脂、血糖和抵抗素的影响[J].卫生研究,2013,42(4):538-542.
[14] 柏友萍,江双双,余祥,孙骏,王克,钱晶晶.60-70%F.C.减肥运动处方对超重肥胖大学生肺通气功能的影响[J].安徽师范大学学报:自然科学版,2013,36(1):67-71.
[15] BELEVIN AA, DUNNMEYNE LL. Differential effects of exercise on body weightgain and adiposity in obesity-prone and resistant rats[J]. International Journal of Obesity,2006(30):722-727.
[16] YUCHANG FU. Chapter nine-adiponectin signaling and metabolic syndrome[J]. Progress in Molecular Biology and Translational Science, 2014,121:293-319.
[17] CHANDRNA M, PHILLIPS S A, CIARALDI T, HENY RR. Adiponectin:moer than just another fat Cell hormone[J]. Diabetes Cear,2003,26:2442-2450.
[18] YANG W S, LEE W J, FUNHASHI T, et al. Weight reduction increased plasma levels of an adipose-derived anti-inflammatory rotein1adiponectin[J]. J Clin Endocrirol Metab,2001,86(8):815-819.
[19] OKAMOTO Y, KIHARA S, FUNAHASHI T, et al. Adiponeetin:a key adipocytokine in metabolie Syndrome[J]. Clin Sei(Lond), 2006,110(3):267-278.
[20] 闻颖,戴岭,吕鹏,等.姜黄素对脂肪细胞脂联素及抵抗素表达影响[J].中国公共卫生,2010,26(10):1248-1250.
[21] HUNG J, McQuillan B M, THOMPSON P L, et al. Circulating adiponectin levels associate with inflammatorymarkers,insulin resistance and metabolic syndrome independent of obesity[J]. Int J Obes(Lond),2008,32(5):772-779.
EffectofAdiponectinonDifferentExerciseIntensityinAdolescentObeseRats
BAI You-ping1, LI Meng1, CUI Jian-fei1, XU Xiao-dong1,DAI Yuan-yuan1, ZHANG Jing1, NIE Liu-wang2
(1.College of Physical Education, Anhui Normal University,Wuhu 241003, China;2.College of Life Sciences, Anhui Normal University, Wuhu 241000, China)
Objective: To explore the effect of adiponectin mRNA expression and protein expression in visceral adipose tissue and plasma concentration on different exercise intensity in adolescent obese rats. Methods: The adolescent SD 8 rats for simple diet control group (C), high fat induced adolescent obesity 32 rats were randomly divided into 4 groups, 8 rats in each group, divided into a control group (OC), low intensity exercise group (OL), medium intensity exercise group (OM)and high intensity exercise group (OH). Exercise groups were practiced with a special motion rat treadmill at the speed of 15-18,21-25,and 28-32m/min,respectively,one hour per day,5 times a week,for 8 weeks.Adiponectin mRNA in adipose tissues was measured with qRT-PCR and protein expression in adipose tissues was measured with the immunohistochemical technique,adiponectin in plasma concentration by ELISA.Results:OL, OM, OH body weight, visceral fat weight and percentage of body fat after 8 weeks were significantly lower than that in OC group (P<0.01), OM, OH group of visceral fat weight and percentage of body fat was lower than that in OL group (P<0.01); Visceral fat adiponectin mRNA of OM, OH group than OC, OL group (P<0.05, P<0.01), OH group of expression of protein of adiponectin increased than OC group; OL, OM, OH group of plasma adiponectin concentrations were significantly increased than OC group (P<0.01), OM, OH group was significantly higher than that in group OL (P<0.05, P<0.01). Conclusion: Through 8 weeks of different intensities of exercise intervention significantly reduced body weight, visceral fat mass and percentage of body fat in adolescent obese rats, the upregulation of adiponectin the expression of the gene expression mRNA and the expression of protein in visceral adipose tissue, increased plasma adiponectin concentrations, the effect of medium and high intensity exercise were obvious.
exercise intensity; adolescent obesity; adipose tissue; body fat percentage; adiponectin
2014-06-23
安徽省高校自然科学基金重点(KJ2013A138).
柏友萍(1964-),女,安徽舒城人,教授,在读博士,研究方向为健身运动处方的生理机理与运动对人体适应的分子生物学机制.
柏友萍,李萌,崔建飞,等.不同运动强度对青春期肥胖大鼠脂联素的影响[J].安徽师范大学学报:自然科学版,2014,37(4):394-400.
G804.2
A
1001-2443(2014)04-0394-07

