阿拉瑞林免疫影响FSHR表达及FSHR生物信息学分析①
雷池月 巩转娣 韦 敏 欧阳霞辉 谢 坤 陈士恩 魏锁成
(西北民族大学生命科学与工程学院,兰州 730030)
促性腺激素释放激素(Gonadotropin releasing hormone,GnRH)是生殖过程中最重要的激素,可促进促黄体生成素(LH)和促卵泡刺激素(FSH)的合成与释放[1,2]。GnRH 类似物(GnRH-A)具有与天然的GnRH相似的生理和生物学作用,而且与Gn-RH 受体(GnRHR)的结合力增强 100~200 倍[3,4]。阿拉瑞林(Alarelin,又名丙氨瑞林)是一种GnRH激动剂(GnRHa),可以使肽的降解变慢,半衰期变长[5,6],促进垂体释放 FSH[6],其药效为天然 GnRH的15倍,因此在临床上得以广泛应用[7]。
国内外学者用免疫组织化学技术对促性腺激素释放激素(GnRH)及其受体(GnRHR)在鸡、马、牛、猴子和猪等动物进行了研究[8,9],我们前期的研究表明,阿拉瑞林主动免疫雌兔可抑制垂体FSH-β mRNA表达,增大卵泡纵径和横径、增大卵泡细胞的线粒体、透明度和微绒毛[10,11]。阿拉瑞林免疫可以抑制小鼠垂体FSHR的表达[12]。
生物信息学广泛应用于生物学与医学各个领域,已成为生物医学发展必不可少的部分。随着人类基因组计划的飞速发展,生物信息学技术已经在人类疾病的研究、识别功能基因、基因与蛋白的表达、蛋白的功能研究等方面都发挥着至关重要的作用[13]。目前尚不清楚 FSHR在绵羊各种组织中的定位与分布[14],尤其是用促性腺激素释放激素类似物(GnRH-A)免疫绵羊后对卵泡FSHR蛋白表达的作用很少见有报道,其机理尚不清楚其表达水平有何关系[15]。有鉴于此,我们在前期研究的基础上[6,10,16],用 qPCR 和Western blot测定了FSHR在绵羊垂体和卵巢中的表达及FSHR的生物信息学分析,以期为深入研究GnRH-A免疫调节动物机体发育和生殖功能的机理及合理应用提供科学依据。
1 材料与方法
1.1 主要试剂与仪器 DNA聚合酶(美国AMERSCO公司);pMD 18-T Vector(TaKaRa公司);Sybr Green qPCR Master Mix(美国 Qiagen);M-MLV Rtase;PCR试剂盒和RT-PCR试剂盒(Invitrogen);FSHR兔抗羊多克隆抗体、β-actin单克隆抗体(美国Sigma公司);第二抗体为HRP标记的兔抗羊IgG抗体。正常羊血清,武汉博士德生物工程有限公司生产;Step one plus型荧光定量PCR仪(美国ABI公司);Rayto-6000型酶标仪(Rayto公司);Image Analyst 1.0图像分析软件。
1.2 实验动物与抗原注射方法 见表1。5~6月龄健康母绵羊(Ovis aries)42只,体重(24.21±2.51)kg,随机均分为6组(n=7),分别标记为 EG-Ⅰ、EG-Ⅱ、EG-Ⅲ、EG-Ⅳ、EG-Ⅴ和 CG(对照组),经检验组间和组内均无显著差异。预饲15 d后正式实验。阿拉瑞林抗原的制备方法见参考文献[17]。
1.3 样本采集与处理 分别在0、7、14、21、28、35、45、60和70颈静脉采血,立即以3 500 r/min离心15 min,分离血清,-20℃保存。于70 d绵羊颈动脉放血处死,无菌采集腺垂体和卵巢,用电子天平称重,迅速-80℃保存。
1.4 引物的设计 从GenBank中获得绵羊FSHR mRNA(L12767.1)序列,用Premier 5.0软件设计引物(由上海生工合成)。FSHR上游引物AGGGATGCGGTCGAACTGAGGT,下游引物 TGCAGCAGTGGAGACAGAATGACC;内参用绵羊甘油醛-3-磷酸脱氢酶(GAPDH)。
1.5 垂体总RNA提取与反转录扩增 将绵羊放血处死后,获取绵羊的腺垂体,按照Trizol说明书提取总RNA。RT-PCR反应采用25 μl体系。PCR条件是 94℃ 5 min,95℃ 2 min,95℃ 10 s,60℃ 40 s,循环40次;72℃ 10 min。RT-PCR反应条件:95℃ 15 min,95℃ 30 s,55℃ 45 s,40 个循环;70℃ 8 min。
1.6 PCR产物的克隆和测序 回收PCR产物并与pMD18-T载体连接,连接产物转化到感受态细胞JM-109,将转化产物涂布于LB平板,37℃下培养15 h,再接种于5 ml LB液体培养基,37℃下培养12 h,采用碱裂解法提取出质粒,对其进行酶切鉴定,对鉴定结果为阳性的进行序列测定。

表1 各组实验绵羊抗原注射剂量和时间Tab.1 Doses and times for injecting GnRHa antigen in ewes
1.7 垂体FSHR mRNA实时荧光定量PCR(qPCR)
以实验组 FSHR mRNA 的 2-ΔΔCt与对照组 2-ΔΔCt的比值计算其相对表达量,其中Ct表示基因扩增产物达到设定阈值所经历的循环数,ΔΔCt=实验组Ct(目的基因Ct-内参基因Ct)-对照组Ct(目的基因Ct-内参基因Ct),2-ΔΔCt表示2的-ΔΔCt次方。实验重复3次,计算平均值。
1.8 卵巢FSHR蛋白的Western blot检测 取50 μg蛋白样品进行SDS-PAGE(聚丙烯酰胺凝胶电泳),电泳后的蛋白转移至PVDF膜,封闭4℃过夜,用FSHR多克隆抗体(1∶200)和β-actin兔多克隆抗体(1∶1 000)孵育,再用辣根过氧化物酶标记的兔抗羊IgG(1∶2 000)室温孵育120 min,TBS洗涤3次,加入免疫印迹化学发光试剂(ECL),显影、洗片、晾干。用凝胶图像分析仪扫描照片。用Quantity One软件(美国Bio-Rad公司)分析每个条带的灰度值,灰度值为扫描条带的积分光密度(IOD)。以FSHR条带的灰度值与β-actin条带灰度值之比值表示组织中FSHR的相对含量。
1.9 绵羊FSHR基因的生物信息学分析 用TM-pred、SignalP、DNAMAN、TargetP1.1、PSORT、Baser tools等在线工具及软件分析。
2 结果
2.1 垂体总RNA提取结果 如图1所示。
图1 垂体总RNA提取Fig.1 Total RNA extraction from pituitary of ewes
2.2 垂体FSHR mRNA实时荧光定量PCR相对定量 各实验组垂体FSHR mRNA的2-ΔΔCt均低于对照组(图2),随着阿拉瑞林抗原注射剂量的增加,EG-Ⅰ、EG-Ⅱ和 EG-Ⅲ的 2-ΔΔCt值逐渐下降;而且,EG-Ⅰ与 EG-Ⅳ、EG-Ⅱ和 EG-Ⅴ相比较,注射阿拉瑞林抗原 4次后 FSHR mRNA的2-ΔΔCt值分别低于注射2次后FSHRmRNA的2-ΔΔCt值,表明加大阿拉瑞林的注射剂量和增加注射次数均会抑制垂体FSHR mRNA的表达。
2.3 卵巢FSHR蛋白的Western blot表达 用Western blot检测到卵巢组织中有FSHR表达(图3)。与对照组比较,实验组羊卵巢中FSHR表达量随阿拉瑞林免疫注射剂量和次数的增多而增加,EG-IV(7.68±1.17)和 EG-V(8.09±1.25)显著高于 CG(6.12±0.65),即阿拉瑞林免疫增强FSHR蛋白的表达。
2.4 FSHR的生物信息学分析
2.4.1 绵羊FSHR的DNA属性 将经PCR扩增、转录等得到的序列用 DANMAN进行分析,得出FSHR的DNA属性图,表明FSHR具有蛋白属性。FSHR由345个氨基酸构成。
2.4.2 绵羊FSHR核苷酸构成比例及理化性质
FSHR核苷酸序列长度为1 091 bp,与NCBI报道的同源性为100%,总原子数11 675,由C 3 348,H 5 607,O 1 387,N 1 091,S 242 构成。理论等电点5.05;在体外哺乳动物网织红细胞中的估计半衰期是1.2 h,该蛋白质不稳定指数是47.75,属于不稳定蛋白;脂肪指数为30.61;疏水性平均值为0.836,这表明该蛋白是疏水性蛋白。
2.4.3 开放阅读框分析 采用NCBI开放阅读框ORF(Open reading frame)Finder程序,得出长780 bp的ORF,起始密码子位于41 bp处,终止密码子位于820 bp处,推测编码129个氨基酸残基。
2.4.4 FSHR蛋白的细胞定位、功能位点及氨基酸序列跨膜区预测 用PSORTⅡprediction(http://psort.nibb.ac.jp/form2.html)分析FSHR蛋白的细胞定位,结果表明用k-NN(Nearest Neighbors)k=9/23,细胞质60.9%,细胞核26.1%,囊泡(Vacuolar)4.3%,高尔基体4.3%和过氧化物酶体4.3%。

图2 FSHR在垂体的表达Fig.2 Expression of FSHR in pituitary of ewes
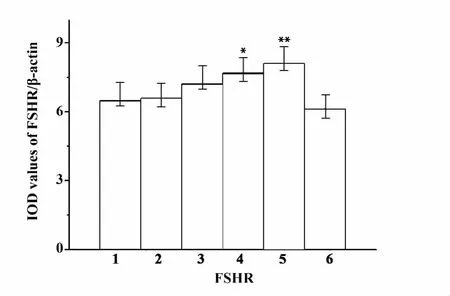
图3 各组绵羊卵巢组织中FSHR蛋白表达量Fig.3 FSHR expression levels in ovaries of ewes immunized with alarelin
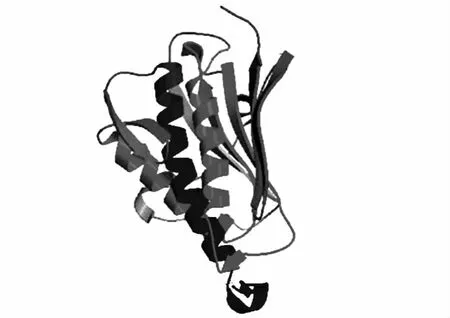
图4 绵羊FSHR蛋白三级结构Fig.4 Predicted tertiary structure of FSHR of ewe
2.4.5 FSHR的信号肽序列分析结果 经SignalP 4.1在线工具分析表明FSHR无信号肽。其中C最大值为0.146(19位点),Y最大值0.263(19位点),S最大值0.650(1位点),S值0.433(1~18位点),D值 0.355(1~18位点),Cutoff值 0.450。TargetP序列分析得出FSHR的线粒体转运肽为0.144,信号肽为0.136,其他 0.726。NetoGlyc功能位点预测表明该蛋白序列不存在潜在糖基化。
2.4.6 FSHR蛋白三级结构、α螺旋和β螺旋的分析 α螺旋Chou&Fasman(http://www.expasy.ch/tools/protscale.html)最小0.671(56,57 位点),最大1.289(818和819位点)。β螺旋最小为0.794(999和1 000位点),最大为1.190(130位点)。应用Swiss-Model程序预测FSHR编码产物的三维结构,结果如图4。
2.4.7 FSHR跨膜区预测结果 用http://www.cbs.dtu.dk/services/TMHMM)在线分析表明FSHR无跨膜区。应用TMpred(http://embnet.vitalit.ch/softw-are/TMPRED_form.html)跨膜结构软件分析FSHR蛋白跨膜区域及方向,得出绵羊FSHR的TM螺旋长度为17~33,且从内向外含有29个强跨膜螺旋区,从内到外和从外到内均有29个螺旋,N端外侧含26个强跨膜螺旋。
3 讨论
GnRH抗体特异性地中和动物体内GnRH,从而影响FSH和LH的合成与分泌。阿拉瑞林与大分子免疫原性物质(如BSA)结合后,具有良好的抗原性和免疫原性[18]。本文结果与笔者前期在家兔的研究一致[19,20]。然而,对阿拉瑞林免疫注射后激素受体mRNA的表达和分布是否发生改变迄今未见研究报道,其机理尚不清楚[21]。本实验结果表明阿拉瑞林免疫可增加卵巢中FSHR蛋白表达。本研究结果与 Schirman-Hildesheim[22]和 Lopot 等[23]的报道一致。然而其分子机制有待深入探讨[24,25]。
本研究运用生物信息学分析工具,对绵羊垂体FSHR进行生物信息学特点分析,得出了FSHR的DNA属性图,得到了氨基酸数和氨基酸序列,得出核苷酸比例与分子量,FSHR核苷酸序列的核苷酸构成、预测出了信号肽序列及三级结构图,脂肪指数、疏水性及稳定性等生物信息学特点。这些研究结果使我们更深入的了解绵羊FSHR,为今后对FSHR的进一步研究和应用提供了科学数据平台,为合理应用GnRH类似物调节生殖功能和治疗疾病提供了科学依据[14,15,26]。
综上所述,阿拉瑞林免疫剂量依赖性的抑制垂体FSHR mRNA的表达,但是可以增加卵巢FSHR蛋白表达,体和卵巢FSHR表达呈负相关。FSHR蛋白为不稳定的疏水性蛋白。这对于提高母羊的繁殖能力具有重要意义。
[1]Grundker C,Gunthert AR,Westphalen S,et al.Biology of the gonadotropin releasing hormone system in gynecological cancers[J].Eur J Endocrinol,2002,146:1-14.
[2]Volker P,Grundker C,Schmidt O,et al.Expression of receptors for luteinizing hormone releasing hormone in human ovarian and endometrial cancers:frequency,autoregulation,and correlation with di-rect antiproliferative activity of luteinizing hormone releasing hormone analogues[J].Am J Obstet Gynecol,2002,186:171-179.
[3]郭红宇,高云荷.GnRH类似物的研究进展[J].中国实用妇科与产科杂志,2005,21(11):12-17.
[4]Zanagnolo V,Dharmarajan AM,Hesla J,et al.Effects of a gonadotropin-releasing hormone analog on rabbit ovarian function[J].Endocrinology,1996,137:5400-5406.
[5]魏锁成,韦 敏.GnRH-A主动免疫公兔对垂体 Gn-RHR、FSH和LH基因表达的影响[J].免疫学杂志,2010,26(7):569-572.
[6]魏锁成,巩转娣,韦 敏.雄兔垂体 GnRHR的序列测定与生物信息学分析[J].中国实验动物学报,2011,19(1):45-50.
[7]李 冰,苏念军,王 芳.丙氨瑞林在诱导排卵中的应用[J].生殖与避孕,2009,29(1):55-58.
[8]魏锁成,巩转娣,韦 敏,等.GnRH及其受体在兔卵巢和子宫分布的研究[J].免疫学杂志,2010,26(10):846-849.
[9]Bo Yu,Jane Ruman,Gregory Christman.The role of peripheral gonadotropin releasing hormone receptors in female reproduction[J].Fertility and Sterility,2011,95(2):465-473.
[10]巩转娣,魏锁成,韦 敏.GnRH-A主动免疫公兔对垂体Gn-RHR、FSHβ和LHβ基因表达的影响[J].免疫学杂志,2010,26(7):569-572.
[11]Wei SC,Gong ZD,Ma W,et al.Effects of GnRH agonist on reproductive functions of female rabbits[J].Animal Science Papers and Reports vol,2012,30(1):73-86.
[12]Wei SC,Gong ZD,Wei M,et al.GnRH agonist active immunization influences gonadotropin receptor expression in pituitary gland,uterine development and secretion of peripheral reproduction hormones in female mice[J].Clin Exp Med J,2011,5(4):243-253.
[13]许忠能.生物信息学[M].北京:清华大学出版社,2012:81-126.
[14]Schirman-Hildesheim TD,Bar T,Aroya NB.Differential GnRH and GnRH-receptor mRNA expression patterns in different tissues of the female rat across the estrous cycle[J].Endocrinol,2005,146:3401-3408.
[15]Crawford JL,Heath DA,Haydon LJ,et al.Gene expression and secretion of LH and FSH in relation to gene expression of GnRH receptors in the brushtail possum(Trichosurus vulpecula)demonstrates highly conserved mechanisms[J].Reprod,2009,137:129-140.
[16]Wei SD,Gong ZD,Wei M.GnRH-A immunization and the changes of reproductive hormone concentration in female rabbits[J].Acta Lab Anim Sci Sin,2010,18:247-250.
[17]魏锁成,张 剑.GnRH-A抗原的制备及不同剂量免疫效果的研究[J].西北民族大学学报,2008,29(1):49-53.
[18]Li B,Su NJ,Wang F.Application of short acting GnRH-a alarelin in ovulation induction[J].Reproduction & Contraception,2009,29(1):55-58.
[19]魏锁成,巩转娣,韦 敏.GnRH-A免疫对 GnRHR、FSH-和LH-B表达及生物信息学特性的影响[J].中国免疫学杂志,2011,27(3):232-235.
[20]Wei S,Bai J,Gong Z,et al.GnRH agonist active immunity influences ovarian development and GnRH receptor mRNA expression levels of pituitary in Japanese white rabbits(Oryctolagus cuniculus)[J].Livest Sci,2011,139:222-229.
[21]Schneider F,Heleil B,Alm H,et al.Endocrine,morphological,and cytological effects of a depot GnRH agonist in bovine[J].Animal Reproduction Science,2006,92:19-28.
[22]Schirman-Hildesheim TD,Bar T,Ben Aroya N.Differential Gn-RH and GnRH-receptor mRNA expression patterns in different tissues of the female rat across the estrous cycle[J].Endocrinol,2005,146:3401-3408.
[23]Lopot M,Ciechanowska M,Malewski T.Changes in the GnRH mRNA and GnRH receptor(GnRH-R)mRNA levels in the hypothalamic-anterior pituitary unit of anestrous ewes after infusion of GnRH into the third cerebral ventricle[J].Reprod Biol,2008,8(2):149-161.
[24]Bo Yu,Jane R,Gregory C.The role of peripheral gonadotropinreleasing hormone receptors in female reproduction[J].Fertil Steril,2011,95(2):465-473.
[25]Rupesh KG,Jodi AF.Gonadotropin-releasing hormone(GnRH)analogs and the ovary:Do GnRH antagonists destroy primordial follicles[J].Fertil Steril,2005,83(5):1339-1342.
[26]Wei SC,Gong ZD,Ouyang XH,et al.Modulation of expression,localization of FSHR and uterine development by GnRH agonist active immunization in ewes[J].J Anim Plant Sci,2013,19(2):2888-2900.

