特异性TCRαβ基因转染T细胞促进抗肿瘤免疫的研究①
吴凤麟 张文峰 何 免 杨 暖 沈 晗 薄华本 邵红伟 黄树林
(广东药学院生命科学与生物制药学院,广州 510006)
肿瘤细胞可以通过诱导免疫耐受、抗原调变、分泌免疫抑制因子等不同机制逃脱机体免疫监视。研究者发现,肿瘤细胞表达的大多数抗原并非具备特异性的新抗原,而是极其接近机体正常细胞表达的组织分化抗原[1,2]。由于胸腺的阴性选择清除了表达可识别自身抗原肽/MHC复合物的T细胞受体(T cell receptor,TCR)的T细胞,使成熟T细胞难以识别肿瘤抗原肽进而活化发挥免疫效应。为解决此问题,研究者通过从患者肿瘤浸润细胞(Tumor-infiltrating lymphocyte,TIL)中筛选获得反应性T细胞克隆,继而鉴定了可特异性识别肿瘤抗原的TCR分子,再将编码肿瘤特异性TCR的基因导入成熟T细胞,最终获得了TCR基因修饰T细胞(TCR gene engineered T cell)。肿瘤特异性TCR基因修饰T细胞可在体外特异性识别抗原阳性肿瘤细胞,并在回输患者体内后重建抗肿瘤免疫。通过将MART-1抗原特异的TCR基因转入黑色素瘤病人的外周血淋巴细胞(Peripheral blood lymphocyte,PBL)后回输,成功地在患者体内建立了针对抗原阳性肿瘤的免疫能力,部分患者可见肿瘤完全转归[3]。用 NY-ESO-1抗原特异性TCR基因修饰T细胞在以黑色素瘤和滑膜肉瘤患者为对象的临床试验中也获得了类似结果[4]。以上研究结果提示,TCR基因转染T细胞作为一种有效的免疫疗法已经具备了临床应用前景[5]。
本实验室一直从事肿瘤特异性TCR基因的筛选与功能研究。在前期研究中,课题组利用基因优势取用技术筛选获得了可特异性识别肝癌抗原的TCRVα12.2-Vβ7.1 基因[6,7]。在本研究中,我们通过重组腺病毒载体携带的TCRVα12.2-Vβ7.1基因转染T细胞,并作用于不同肿瘤细胞株。证实了特异性TCR基因有效转染T细胞后,可赋予T细胞识别肿瘤抗原的能力,进而充分活化发挥抗肿瘤免疫效应。
1 材料与方法
1.1 试剂与仪器 人源性肝癌细胞株HepG-2(HLA-A2+, AFP+), SMMC-7721(HLA-A2+,AFP+);人源性乳腺癌细胞株 MCF-7(HLA-A2+,AFP-);人胚肾细胞系HEK-293均为本实验室保存。重组腺病毒 Ad5F35由本室构建保存[8]。TCRVα12.2、Vβ7.1特异性引物及病毒纤毛基因引物合成于Invitrogen公司。1640培养基、胎牛血清购自Gibco公司,人淋巴细胞分离液购自TBD公司,重组人IFN-γ购自Boehringer Ingelheim公司,重组人IL-2、鼠抗人CD3单克隆抗体、鼠抗人CD28单克隆抗体购自R&D公司,钙黄绿素(Calcein-AM)购自日本同仁化学,PE标记抗人 TCR Vβ7抗体、PC5标记抗人CD3抗体、PC5标记抗人CD8抗体、PE标记抗人FasL抗体均购自BioLegend公司,FITC标记抗人TCRα12抗体购自Endogen公司,Annexin V-PI细胞凋亡检测试剂盒购自杭州联科生物公司。全波长多功能酶标仪为美国Thermo Fisher Scientific公司产品,流式细胞仪(EPICS-XL)为美国Beckman-Coulter公司产品。
1.2 方法
1.2.1 人PBMC分离 取HLA-A2阳性健康人外周血,Ficoll-Hapaque密度梯度离心法分离PBMC。
1.2.2 T细胞培养与刺激活化 分离获得的PBMC在添加10%胎牛血清、双抗(青霉素100 U/ml,链霉素100 μg/ml)的RPMI1640完全培养液中培养。分离后第1天。以抗人CD3单克隆抗体(OKT3,30 ng/ml),抗人CD28单克隆抗体(1 ng/ml)及重组人IL-2(300 U/ml)完成刺激。此后每3天半量换液。并补加重组人IL-2(终浓度为50 U/ml)。
1.2.3 重组腺病毒Ad5F35-TRAV-TRBV的构建与鉴定 将TCA-12-2基因通过EcoRⅠ、SalⅠ位点连入载体 pIRES2-AcGFP1,获得中间载体 pIRESAcGFP1-TCA;TCB-7.1基因通过BstXⅠ和NotⅠ酶切后,克隆于pIRES-TCA,得到 pIRES-TCA-TCB载体,随后通过亚克隆连入载体pDC315,得到重组质粒 pDC315-TCA-12-2-TCB-7.1。将重 组 载体pDC315-TCA-12-2-TCB-7.1与Ad5f35骨架载体通过阳离子脂质体转染293细胞。载体转染后12天通过显微镜观察病斑出现。通过TCID50法测病毒滴度。提取重组腺病毒基因组DNA后,TCRVα12.2与Vβ7.1特异性引物PCR扩增后,产物经1% 琼脂糖凝胶电泳分离后溴化乙锭显色观察目的基因条带。PCR产物经酶切、克隆转化后送Invitrogen公司测序鉴定。
1.2.4 重组腺病毒Ad5F35-TRAV-TRBV转染T细胞 PBMC分离后第3天完成腺病毒转染。将PBMC调整浓度为1×106个/ml,并用含2% 血清的1640培养基接种于细胞培养瓶中。按不同感染复数(Multiplicity of infection,MOI)比例加入重组病毒颗粒。37℃细胞培养箱中孵育12 h后换液,继续用含10%血清及IL-2的1640培养基培养。抗人TCRα12、TCRβ7荧光抗体染色后,流式细胞术检测目的基因表达比例。转染后3 d完成抗肿瘤功能实验。
1.2.5 钙黄绿素染色法检测T细胞肿瘤杀伤活性
将各组肿瘤细胞(HepG-2,SMMC-7721,MCF-7)浓度调节为1×106个/ml,重悬于含10%FCS的完全培养基中。加入终浓度为15 μmol/L的 Calcein-AM,37℃孵育30 min。含10%血清的完全培养基洗涤两次。完全培养基调节靶细胞至终浓度1×105个/ml。倒置荧光显微镜观察染色效果。将靶细胞接种于V底96孔培养板,100 μl/孔。按不同效靶比(3∶1、10∶1、30∶1)加入以下各组效应细胞:a.PBMC对照组;b.空载体转染组;c.TCR基因转染组。并设自发释放组(只加入完全培养基)、最大释放组(加入2%TritonX-100)。总体积均为100 μl/孔。以上各实验组和对照组均为5个复孔。37℃孵育4 h,离心机离心96孔板,1 000 r/min离心5 min。从各孔中吸取75 μl上清。转移至预先标记好的新的96孔培养板。荧光酶标仪读取各孔荧光值,激发光波长485 nm,发射光波长535 nm。根据以下公式计算各组效应细胞的CTL活性:特异性裂解百分比=(实验组荧光值-自发释放组荧光值)/(最大释放组荧光值-自发释放组荧光值)×100%。
1.2.6 AnnexinV双染法检测肿瘤细胞凋亡率 将肿瘤细胞HepG-2浓度调节至2×105个/ml,接种于六孔板(1 ml/孔)。分别加入各组效应细胞:a.PBMC对照组;b.空载体转染组;c.TCR基因转染组,效靶比30∶1,共培养4 h。按说明书完成样本制备后上机。以FITC单染为早期凋亡细胞,PIFITC双染为晚期凋亡/死亡细胞,PI单染为死亡细胞,双阴性细胞为正常细胞。统计各类细胞比例。
1.2.7 流式细胞术检测T细胞膜表面FasL表达各组效应细胞作用以效靶比30∶1与靶细胞HepG-2共培养4 h后,吸取细胞悬液,加入荧光标记抗人CD8与抗人FasL抗体,完成样本制备后流式检测。
1.2.8 ELISA法检测细胞因子分泌 将肿瘤细胞HepG-2浓度调节至2×105个/ml,接种于96孔培养板,100 μl/孔。分别加入各组效应细胞。效靶比为30∶1,共培养24 h。到达预定培养时间后,收集各组细胞培养上清液,双抗体夹心 ELISA法检测IFN-γ与IL-2含量,操作按ELILSA试剂盒说明书进行。根据酶标仪测量的样本吸光度A450值和标准曲线计算 IFN-γ和IL-2浓度。
1.3 统计学处理 实验数据以均数±标准差来表示。应用SPSSv16.0软件(SPSS Inc.Chicago,USA)进行统计分析。采用单因素方差分析比较各组差异。当P<0.05时,被认为差异具有统计学意义。GraphPad Prism 5.0软件绘图。
2 结果
2.1 重组腺病毒Ad5F35-TRAV-TRBV的构建与鉴定 前期实验发现,脂质体等非病毒载体介导外源性TCR基因转染的转染效率较低。同时,TCR Vα基因和TCR Vβ基因单独转染还存在着与内源性TCR基因错配的可能。本实验室在Ad5型腺病毒的基础上,通过细菌内同源重组的方法,构建了嵌合型腺病毒载体Ad5F35-TRAV-TRBV。对5型腺病毒纤毛基因头节部分进行替换,形成具有35型腺病毒纤毛杆(shaft)和头节(knob)的嵌合型腺病毒载体Ad5/F35(图1)。获得重组质粒pDC315-TCA-12-2-TCB-7.1后,将重组载体pDC315-TCA-12-2-TCB-7.1与Ad5f35骨架载体通过阳离子脂质体转染293细胞。载体转染后12天可在镜下观察到病斑形成。提取重组腺病毒Ad5F35-TRAV-TRBV的基因组DNA,以TCRVα12.2与Vβ7.1特异性引物PCR扩增,产物经琼脂糖凝胶电泳分离后,观察到了目的产物带(图 2,TCR Vα12.2:816 bp,Vβ7.1:942 bp)。产物经测序后比对,与Genbank序列一致。
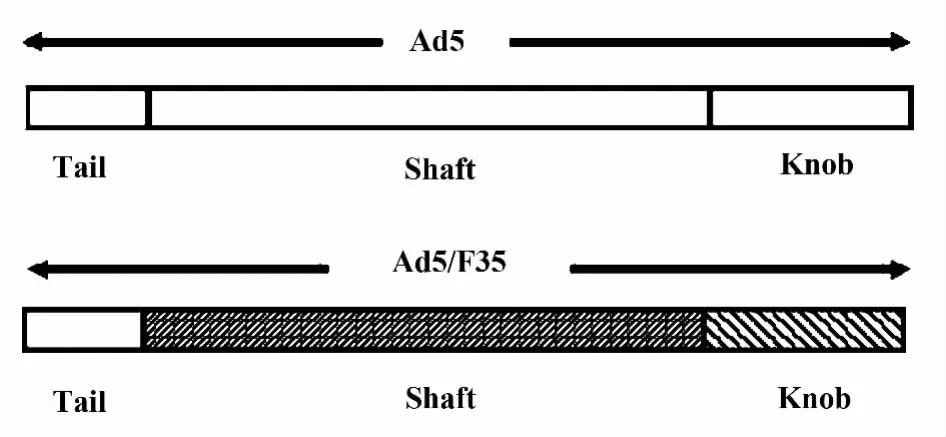
图1 Ad5和Ad5/F35纤毛基因结构图Fig.1 Knob gene structure of Ad5 and Ad5/F35 vector
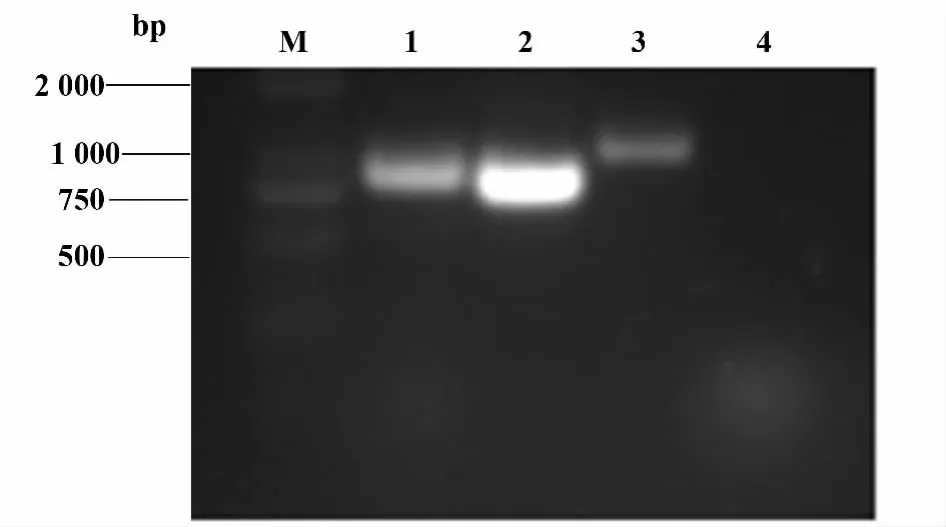
图2 重组腺病毒Ad5F35-TRAV-TRBV PCR扩增与鉴定Fig.2 PCR amplification and identification of recombinant adenovirus Ad5F35-TRAV-TRBV
2.2 重组腺病毒Ad5F35-TRAV-TRBV转染T细胞后目的基因表达效率 通过HEK293细胞包装获得重组TCR腺病毒颗粒后,首先检测了不同MOI条件下腺病毒载体的转染效率。重组TCR腺病毒转染体外培养第3天的 PBMC(按照MOI=50,100,200分成3个转染组,完成5个独立样本实验)。转染后24h流式检测TCRVβ7.1阳性细胞比例,以CD3阳性细胞框选设门。结果表明,对照组TCRVβ7阳性细胞比例较低(图3A,5.2%)。重组腺病毒转染后,TCRVβ7阳性细胞比例明显上升。在MOI=100时,转染后淋巴细胞TCRVβ7阳性细胞比例最高(图 3C,17.8%)。MOI=200时,TCRVβ7阳性细胞比例反而有所降低(图 3D,13.5%)。同时细胞数量有所减少。对不同MOI值转染24 h后TCRVβ7阳性细胞比例结果进行统计学分析(表1)。各实验组与对照组阳性细胞比例差异均有统计学意义(P<0.001)。MOI=100组阳性细胞比例最高,与MOI=50组和MOI=200组阳性细胞比例差异有统计学意义(P<0.001)。以MOI=100转染PBMC 72 h后,TCRα12,TCRVβ7荧光抗体标记后,流式检测了外源TCR基因在T细胞表面的表达情况(图4)。结果显示TCRVα12-Vβ7双阳性细胞比例在25%~30%(图4C)之间,高于未转染对照组(TCRVα12-2 Vβ7.1双阳性细胞比例低于1%,图4A)及空载体转染组(双阳性细胞比例低于1%,图4B),证实外源TCR基因可有效表达于 T细胞。
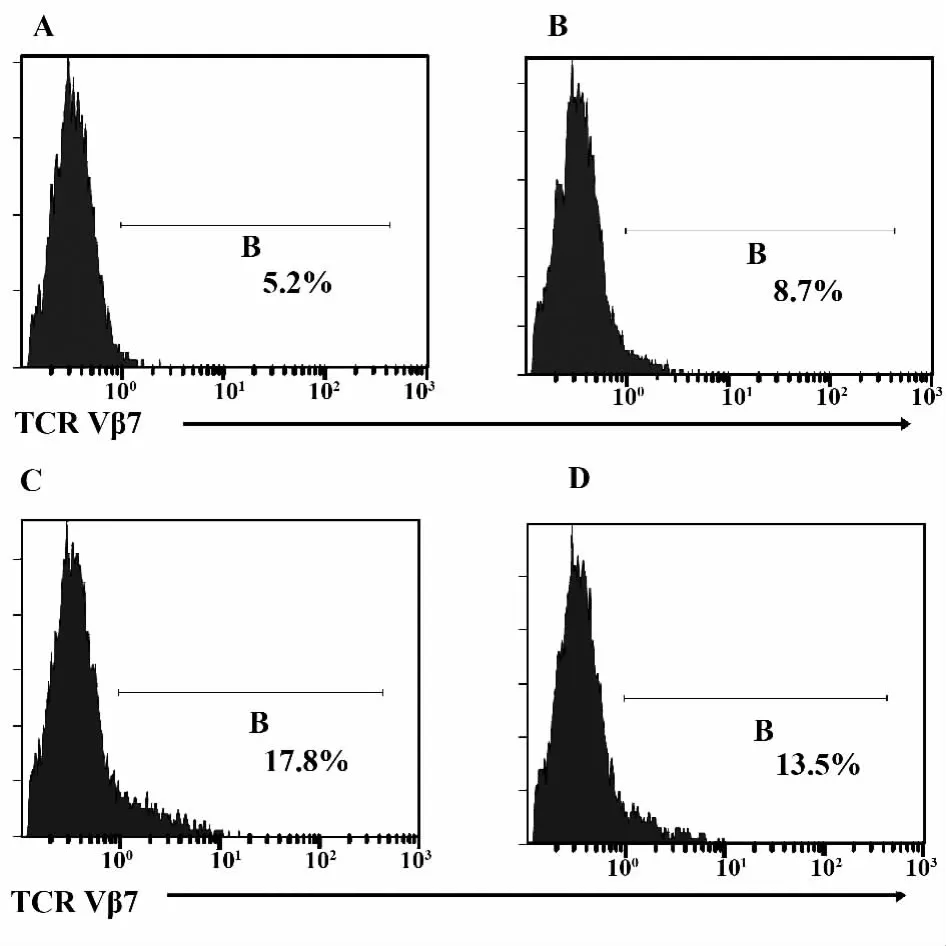
图3 流式细胞术检测重组TCR腺病毒以不同MOI值转染后TCR Vβ7阳性细胞比例Fig.3 Frequency of TCR Vβ7+T cells was detected by FACS 24 h after transduced with recombinant TCR adeno virus at different MOI(24 h)
表1 不同MOI值转染24 h后TCRVβ7阳性细胞比例(,n=5)Tab.1 Frequency of TCR Vβ7+T cells transduced on different MOI 24 h after transduction(,n=5)

表1 不同MOI值转染24 h后TCRVβ7阳性细胞比例(,n=5)Tab.1 Frequency of TCR Vβ7+T cells transduced on different MOI 24 h after transduction(,n=5)
% 239.644 <0.001 MOI=50(8.300±0.696)%MOI=100(17.120±0.983)%MOI=200(12.760%±0.598)%F P Control(5.140±0.688)Groups The frequency of TCR Vβ7+T cells

图4 流式检测重组TCR腺病毒转染后TCRVα12-Vβ7双阳性细胞比例(转染后3 d)Fig.4 Frequency of TCRVα12+Vβ7+cells was analyzed by FACS 3 days after transduction

图5 各组效应细胞以不同效靶比作用于靶细胞后特异性裂解百分比Fig.5 Specific lysis of target tumor cells coculture with different effector T cells at different effector-totarget ratio(E/T ratio)
2.3 特异性TCR转染T细胞的肿瘤杀伤活性 分别将PBMC对照组,空载体转染组,TCR基因转染组以不同效靶比作用于不同肿瘤细胞株。4 h后检测各组效应细胞肿瘤杀伤活性。如图5A所示,空载体转染组和PBMC组在各效靶比对肝癌细胞株HepG-2的肿瘤杀伤活性的差异均无统计学意义(P>0.05)。特异性TCR基因转染后,T细胞的肿瘤杀伤活性上升,在各效靶比与PBMC对照组及空载体转染组差异均具有统计学意义(P<0.00 1)。在各组细胞作用于肝癌细胞株SMMC-7721后也获得了类似的结果(图5B)。特异性TCR基因转染T细胞的肿瘤杀伤活性在各效靶比与PBMC对照组及空载体转染组差异均有统计学意义(P<0.00 1)。而空载体转染组和PBMC组在各效靶比的肿瘤杀伤活性的差异均无统计学意义(P>0.05)。与作用于肝癌细胞系不同的是,各组效应细胞作用于AFP表达阴性的乳腺癌细胞MCF-7之后(图5C),在各效靶比的肿瘤杀伤活性的差异均无统计学意义(P>0.05)。实验同时检测了重组TCR腺病毒载体以不同MOI值感染T细胞引起特异性TCR阳性细胞比例的差异对T细胞杀伤靶细胞的影响。结果显示,特异性TCR阳性细胞比例上升可有效促进T细胞杀伤靶细胞HepG-2(图6)。高TCR阳性细胞比例组(MOI=100)在各效靶比都有最高的靶细胞特异性裂解百分比,与中TCR基因阳性细胞比例组(MOI=200),低TCR基因阳性细胞比例组(MOI=50)及PBMC对照组(MOI=50)相比差异有统计学意义(P<0.001)。
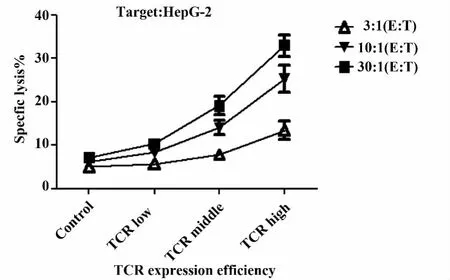
图6 不同MOI值转染T细胞作用于靶细胞HepG-2后特异性裂解百分比(,n=5)Fig.6 Specific lysis of target tumor cells coculture with T cells transduced on different MOI(,n=5)
表2 各组效应细胞诱导HepG-2细胞凋亡比例(,n=4)Tab.2 Frequency of apoptotic cells in HepG-2 after coculture 4 h with different effector T cells(,n=4)

表2 各组效应细胞诱导HepG-2细胞凋亡比例(,n=4)Tab.2 Frequency of apoptotic cells in HepG-2 after coculture 4 h with different effector T cells(,n=4)
Note:Compared with PBMC control group,1)P <0.001;compared with empty vector group,2)P <0.001.
% 130.182 <0.001 Transduced with empty vector(5.525±0.608)%TCR gene transferred(19.158±2.316)%1)2)F P PBMC control group(5.150±0.369)Groups The frequency of apoptotic cells
2.4 靶细胞HepG-2的凋亡比例 以Annexin V-PI双染法进一步检测了不同组效应细胞(PBMC对照组,空载体转染组,TCR基因转染组)以效靶比30∶1与HepG-2共培养4 h后,靶细胞凋亡比例。以PI单染为死亡细胞,Annexin V单染为早期凋亡细胞,Annexin V-PI双染为晚期凋亡/死亡细胞。如图7结果所示。与PBMC对照组(图7A,凋亡细胞比例<6%)及空载体转染组(图7B,凋亡细胞比例<7%)相比,TCR基因转染T细胞作用后靶细胞凋亡比例(图7C,凋亡细胞比例>20%)上升。
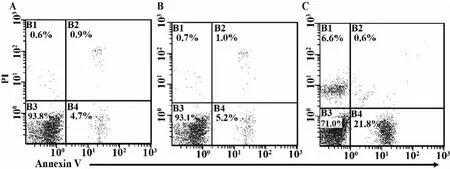
图7 不同组效应细胞作用靶细胞HepG-2 4 h后,靶细胞凋亡比例Fig.7 Frequency of apoptotic cells in HepG-2 4 h after coculture with different T cells

图8 作于靶细胞HepG-2 4 h后,各组效应细胞CD8+T细胞中FasL阳性比例Fig.8 Frequency of FasL+cell in CD8+T cell of different effector cells 4 h after cocluture with target cell HepG-2
对各组效应细胞诱导HepG-2细胞凋亡比例进行统计学分析(表2)。对照组和空载体组靶细胞凋亡比例差异无统计学意义。TCR基因转染组靶细胞凋亡比例最高,与对照组和空载体组相比差异具有统计学意义(P<0.00 1)。
2.5 各组T细胞作用于靶细胞HepG-2后膜表面FasL表达情况 不同组效应细胞(PBMC对照组,空载体转染组,TCR基因转染组)以效靶比30∶1与靶细胞HepG-2共培养4 h后,CD8+细胞框选设门,经抗人FasL荧光抗体染色,检测了各组效应细胞CD8+T细胞膜表面FasL表达情况。如图8结果所示。作用于靶细胞后,与PBMC对照组(图8A,1.2%)及空载体转染组(图8B,4.1%)相比,TCR基因转染组CD8+细胞中Fas阳性比例上升(图8C,31.5%)。对各组效应细胞CD8+T细胞中FasL阳性比例进行统计学分析(表3)。对照组和空载体组FasL阳性细胞比例差异无统计学意义(P>0.05)。TCR基因转染组FasL阳性细胞比例最高,与对照组和空载体组相比差异具有统计学意义(P<0.00 1)。
2.6 各组T细胞作用于靶细胞后细胞因子分泌不同组效应细胞(PBMC对照组,空载体转染组,TCR基因转染组)以效靶比30∶1作用靶细胞HepG-2,SMMC-7721 24 h后,ELISA法检测了各组效应细胞IFN-γ与IL-2的分泌情况。图9A结果显示,TCR基因转染组作用于靶细胞HepG-2后,上清液中IFN-γ含量(27.81±1.85)ng/ml明显高于PBMC对照组(4.20±0.63)ng/ml和空载体转染组(4.46±0.44)ng/ml(P<0.00 1)。各组细胞作用于SMMC-7721后也获得了类似的结果。与PBMC对照组(4.10±0.42)ng/ml和空载体转染组(4.08±0.29)ng/ml相比,TCR基因转染组IFN-γ分泌能力(25.12±2.04)ng/ml明显上升(P<0.00 1)。如图9B所示。TCR基因转染组作用于靶细胞HepG-2后,上清液中IL-2含量(1 755.80±57.33)pg/ml与对照组(1 726.20±61.97)pg/ml及空载体转染组(1 706.80±34.43)pg/ml相比,差异无统计学意义(P>0.05)。各组细胞作用于SMMC-7721后,TCR基因转染组IL-2分泌(1 631.40±47.25)pg/ml与对照组(1 575.60±53.41)pg/ml相比,差异同样无统计学意义(P>0.05)。但高于空载体转染组(1 545.80±40.96)pg/ml(P<0.05)。以上结果提示,TCR基因转染能够有效促进T细胞作用于抗原阳性靶细胞后分泌IFN-γ,而对T细胞IL-2分泌无明显影响。
表3 作用于靶细胞HepG-2 4 h后各组效应细胞CD8+T细胞中FasL阳性比例(n=4,)Tab.3 Frequency of FasL+cell in CD8+T cell of different effector cells 4 h after cocluture with target cell HepG-2(n=4,)

表3 作用于靶细胞HepG-2 4 h后各组效应细胞CD8+T细胞中FasL阳性比例(n=4,)Tab.3 Frequency of FasL+cell in CD8+T cell of different effector cells 4 h after cocluture with target cell HepG-2(n=4,)
Note:Compared with PBMC control group,1)P <0.001;compared with empty vector group,2)P <0.001.
Groups FasL+cell F P PBMC control 1.675±0.457% 323.596 <0.001 Transduced withempty vector 3.425±0.640%TCR gene transferred 27.600±2.677%1)2)
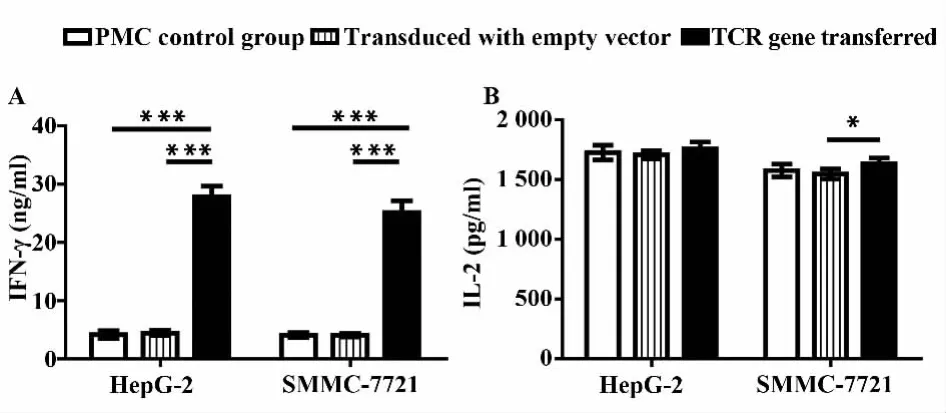
图9 各组效应细胞作用于不同靶细胞24 h后上清中IFN-γ(A)及 IL-2(B)含量Fig.9 IFN-γ(A)and IL-2(B)contents in supernatant of each group of effector T cells 24 h after coculture with different target cells
3 讨论
自上世纪80年代FDA批准首例TCR基因转染的人体实验以来[9],TCR基因修饰T细胞治疗已经在肿瘤抗原特异性TCR筛选、TCR基因转染技术和增强T细胞效应功能等方面取得了重要进展。随着肿瘤特异性抗原和肿瘤相关抗原的不断发现和鉴定,TCR基因修饰T细胞治疗将有望扩展运用于各种不同类型的实体瘤的临床治疗[3]。通过TCR基因转染技术获得肿瘤特异性T细胞的关键策略包括:①筛选获得可特异识别肿瘤抗原的TCR基因;②选择高效的基因转染方法。在本研究中,我们以之前筛选的肝癌抗原特异性TCR基因为肿瘤抗原识别基因,以改造的嵌合型腺病毒载体Ad5F35-TRAV-TRBV为基因转染工具,对T细胞进行了基因修饰,使其获得了良好的肿瘤抗原识别特异性。
在确定了肿瘤特异性TCR基因后,采用合适载体并设计有效的表达盒对外源TCR基因表达效率具有关键作用[5]。在目前TCR基因修饰T细胞治疗的临床实验中,主要使用病毒类载体作为TCR基因传输系统。包括逆转录病毒、腺病毒及慢病毒等。考虑到逆转录病毒应用于人体可能存在的染色体整合风险[10]。我们选择了腺病毒载体作为本研究的TCR基因传输系统。
Ad5型腺病毒是基因治疗的常用载体之一,然而由于摄入Ad5型腺病毒必需的柯萨奇/腺病毒受体(Coxsackie/adenovirus receptors,CAR)及 αV 型整合素在T细胞表面表达水平较低[11],使Ad5型病毒对T细胞的转染效率低下[12]。因此本实验室对传统的Ad5型腺病毒进行了改造。即将Ad35型腺病毒的knob重连至Ad5型腺病毒shaft下游,从而获得了嵌合型Ad5/35型fiber,以利用Ad35型腺病毒的knob靶向结合几乎表达所有人类细胞表面的CD46分子的特性[13]。成功构建嵌合腺病毒载体后,以IRES连结TCR Vα12.2、Vβ7.1基因片段,并将其重组连结入嵌合腺病毒载体。以HEK293细胞包装完整病毒颗粒后感染T细胞。结果显示,重组腺病毒可有效转染T细胞。为获得最佳感染条件。我们设置了MOI梯度实验比较了外源TCR表达水平。结果显示,在MOI=100时,获得了最高的外源性TCR表达效率。当MOI值进一步升高时,外源基因表达效率反而有所下降,同时细胞数与对照组及较低MOI浓度组相比有所减少。这可能是由于纯化的病毒保存于高盐缓冲液中,在转染时加入病毒液体积过多将在病毒和细胞共孵育的过程中影响T细胞生长。
在以肝癌特异性TCR基因修饰后,我们将各组效应细胞分别作用于不同的肿瘤细胞株。实验结果显示,TCR基因转染有效地促进了T细胞针对AFP阳性的肝癌细胞HepG-2、SMMC-7721的特异性裂解百分比。证实肝癌特异性TCR基因转染可有效赋予T细胞肿瘤抗原识别能力,进而充分活化并发挥CTL效应杀伤抗原阳性肿瘤细胞。而TCR基因转染对AFP阴性肿瘤细胞株没有表现类似的促进肿瘤杀伤活性的效果,证实了TCR基因转染良好的抗原特异性。同时,由不同MOI值感染T细胞引起的特异性TCR阳性细胞比例与T细胞杀伤靶细胞能力有较好的对应关系。高特异性TCR阳性细胞组获得了最高的靶细胞凋亡率,证实特异性TCR基因表达水平上升可有效促进T细胞识别和杀伤抗原阳性肿瘤细胞。
分析各组效应细胞诱导AFP阳性肿瘤细胞凋亡情况,获得了与CTL活性类似的结果。在TCR基因转染T细胞后,诱导靶细胞凋亡比例显著增加,与空载体转染组和对照组相比差异有统计学意义。实验同时比较了各组T细胞表面重要的促凋亡分子FasL表达情况。Fas-FasL是T细胞与肿瘤细胞相互作用的关键性分子[14]。T细胞可以通过细胞膜表面表达的FasL直接杀伤 Fas阳性靶细胞[15]。结果提示,在作用于AFP阳性表达的靶细胞HepG-2后,TCR基因转染后T细胞表面FasL表达上调。T细胞表面表达上调的FasL分子将通过与靶细胞表面的Fas结合,激活靶细胞内Caspase系统介导其凋亡[16]。
为分析T细胞抗肿瘤免疫反应机制,实验检测了效应细胞作用于靶细胞后细胞因子的分泌情况。TCR基因转染促进了T细胞作用于AFP抗原阳性靶细胞后分泌IFN-γ的水平。而TCR基因转染对T细胞分泌IL-2的能力没有显著影响。研究显示,IFN-γ是CTL细胞介导抗肿瘤免疫反应的关键细胞因子。而尽管IL-2能够促进T细胞增殖,但是国外研究显示,IL-2在CTL活化过程中主要意义是标记T细胞效应分化,而非介导抗肿瘤免疫[17]。IL-2的缺乏不会影响T细胞抗肿瘤免疫功能。体内实验也证实,在用于过继性回输的T细胞中过表达IL-2不能改善其体内存活能力和疗效[18]。
综上所述,本研究以重组腺病毒载体Ad5F35-TRAV-TRBV介导肿瘤特异性TCR基因成功转染T细胞。在MOI=100时外源基因有最高表达效率。肝癌特异性TCR基因转染可有效促进T细胞识别抗原阳性肿瘤细胞,并通过FasL-Fas途径直接诱导肿瘤细胞凋亡,分泌IFN-γ等机制发挥更为强烈的抗肿瘤免疫效应。
[1]Boon T,Coulie PG,Van den Eynde BJ,et al.Human T-cell responses against melanoma[J].Annu Rev Immunol,2006,24:175-208.
[2]Rosenberg SA.A new era for cancer immunotherapy based on the genes that encode cancer antigens[J].Immunity,1999,10:281-287.
[3]Morgan RA,Dudley ME,Wunderlich JR,et al.Cancer regression in patients after transfer of genetically engineered lymphocytes[J].Science,2006,314:126-129.
[4]Rabinovich GA,Gabrilovich D,Sotomayor EM.Immunosuppressive strategies that are mediated by tumor cells[J].Annu Rev Immunol,2007,25:267-296.
[5]Morgan RA,Dudley ME,Rosenberg SA,et al.Adoptive cell therapy genetic modification to redirect effector cell specificity[J].Cancer J,2010,16:336-341.
[6]黄树林,周继斌,陈维春,等.TCRVβ基因亚家族的优势取用和PTK信号传导途径的激活及体外对肝癌细胞凋亡的诱导[J].中国免疫学杂志,2001,17(5):245-258.
[7]Wu FL,Zhang WF,Shao HW,et al.Human effector T cells derived from central memory cells rather than CD8+T cells modified by tumor-specific TCR gene transfer possess superior traits for adop-tive immunotherapy[J].Cancer Lett,2013,339(2):195-207.
[8]Zhang WF,Wu FL,Shao HW,et al.Chimeric adenoviral vector Ad5F35L containing the Ad5 natural long-shaft exhibits efficient gene transfer into human T lymphocytes[J].J Virol Methods,2013,194:52-59.
[9]Rosenberg SA,Aebersold P,Cornetta K,et al.Gene transfer into humans-immunotherapy of patients with advanced melanoma,using tumor-infiltrating lymphocytes modified by retroviral gene transduction[J].N Engl J Med,1990,323:570-578.
[10]Hacein-Bey-Abina S,von Kalle C,Schmidt M,et al.A serious adverse event after successful gene therapy for X-linked severe combined immunodeficiency[J].N Engl J Med,2003,348:255-256.
[11]Hemminki A,Kanerva A,Liu B,et al.Modulation of coxsackieadenovirus receptor expression for increased adenoviral transgene expression[J].Cancer Res,2003,63:847-853.
[12]Segerman A,Mei YF,Wadell G.Adenovirus types 11p and 35p show high binding efficiencies for committed hematopoietic cell lines and are infective to these cell lines[J].J Virol,2000,74:1457-1467.
[13]Yotnda P,Savoldo B,Charlet-Berguerand,et al.Targeted delivery of adenoviral vectors by cytotoxic T cells[J].Blood,2004,104:2272-2280.
[14]Zeytun A,Hassuneh M,Nagarkatti M,et al.Fas-fas ligand-based interactions between tumor cells and tumor-specific cytotoxic tlymphocytes:a lethal two-way street[J].Blood,1997,90(5):1952-1959.
[15]Kagi D,Ledermann B,Burki K,et al.Molecular mechanisms of lymphocyte-mediated cytotoxicity and their role in immunological protection and pathogenesis in vivo[J].Ann Rev Immunol,1996,14:207-232.
[16]Suzuki A,Tsutomi Y,Akahane K,et al.Resistance to Fas-mediated apoptosis:activation of caspase 3 is regulated by cell cycle regulator p21WAF1 and IAP gene family ILP [J].Oncogene,1998,17(8):931-939.
[17]Hinrichs CS,Borman ZA,Cassard L,et al.Adoptively transferred effector cells derived from naive rather than central memory CD8+T cells mediate superior antitumor immunity[J].PNAS,2009,106:17469-17474.
[18]Gattinoni L,Powell DJ,Rosenberg SA,et al.Adoptive immunotherapy for cancer:building on success[J].Nat Rev Immunol,2006,6:383-393.

