MPB64在杆状病毒系统中的表达纯化及免疫原性鉴定①
徐 丹 姜 潮 陈 昱 艾 君 王晓艳 李校堃
(吉林农业大学生物反应器与药物开发教育部工程研究中心,长春 130118)
结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacteria tuberculosis,MTB)引起的通过空气传播的人兽共患传染病。据世界卫生组织报道,在2011年,约有870万名新增结核病例(13%感染了艾滋病病毒)和140万人死于结核病[1]。结核病已成为我国乃至世界危害最严重的疾病之一。1921年,Calmette和Guérin研制出减毒分枝杆菌Bacille Calmette-Guérin(BCG),BCG是目前应用最广泛的结核分枝杆菌疫苗,但BCG保护力不稳定为0~80%,BCG不能提供有效的免疫保护力来抵抗结核分枝杆菌的感染,尤其对处于潜伏期的结核病患者不会产生任何效果[2,3],所以急需一种有效的疫苗来控制结核病的蔓延,目前研究最多的是重组BCG、DNA疫苗和亚单位疫苗。
MPB64蛋白是MTB基因组RD2区基因编码的蛋白,分子量约为23 kD,只存在于MTB毒株中,不存在于BCG中[4]。MPB64是MTB培养物滤过蛋白的主要成分之一,占分泌蛋白总量的8%,亦是最早被发现的MTB复合群特异性抗原,可诱导肺结核患者的淋巴细胞增殖并可产生高水平的IFN-γ,能引起较强的细胞和体液免疫,具有开发成结核病亚单位疫苗和检测试剂盒的潜力。本研究在杆状病毒表达载体系统中表达MPB64,希望获得具有免疫原性的重组蛋白,为MPB64的表达提供新途径,为结核病的检测和亚单位疫苗的研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 质粒细菌 含有MPB64-His基因序列(昆虫密码子优化)的pUC57载体、E.coli DH5α菌种均由本实验室保存;pFastBac载体、E.coli DH10Bac感受态购自Invitrogen公司。
1.1.2 试剂盒 脂质体转染试剂盒、Bac-to-Bac表达系统试剂盒、Sf 9昆虫细胞、Sf-900II无血清培养基购自 Invitrogen;PCR酶、限制性内切酶、DNA Marker 10 000、DNA连接酶购自大连宝生物;质粒提取试剂盒购自北京索莱宝公司;His标签抗体购自abcom公司;BALB/c小鼠由温州医科大学动物实验中心提供(18只,雌性,6~8周龄);IFN-γ检测试剂盒购自上海巧伊生物技术有限公司。
1.2 方法
1.2.1 设计引物 从pUC57-CFP10-ESAT-6-MPB64-His载体中扩增MPB64-His目的基因片段,运用Primer 5.0软件设计含有BamHⅠ和PstⅠ酶切位点及保护碱基的上游引物和下游引物,通过PCR克隆得到N端含有6个His标签的MPB64基因,上游引物 5'CGGGATCCATGAGGATAA3',下游引物5'CTGCAGCTAGTGATGGTGATG3'。
1.2.2 PCR反应体系 上下游引物各1 μl,模板质粒 1 μl,ExTaq 酶 0.25 μl,dNTP 4 μl,10 × buffer 5 μl,超纯水 37.75 μl,50 μl反应体系。94℃ 预变性 5 min,94℃ 30 s,60℃ 30 s,72℃ 45 s,30 个循环后72℃延伸8 min。
1.2.3 重组pFastBac-MPB64-His载体的构建PCR获得的MPB64-His片段和pFastBac质粒分别用BamHⅠ和PstⅠ酶双酶切并回收需要的片段,目的片段与空载体pFastBac连接后转化DH5α感受态,挑选单菌落进行PCR和酶切验证并由华大基因测序,测序正确的单克隆提质粒进行下一步实验。
1.2.4 重组Bacmid-MPB64-His载体的构建pFastBac-MPB64-His质粒转化含有Bacmid载体的DH10Bac感受态(方法根据说明书),转化后的DH10Bac 菌涂布在五抗(K 50 μg/ml,T 10 μg/ml,G 7 μg/ml,IPTG 40 μg/ml,X-gal 100 μg/ml)固体培养基的平皿上,37℃倒置培养48 h,蓝白斑鉴定阳性菌落,挑取单菌落在五抗平皿中划线培养,至整个平皿中只有白色菌落,挑取单菌落利用Bacmid中的M13片段和目的基因片段两端引物进行PCR鉴定。
1.2.5 重组杆状病毒的制备 取两份100 μl的SF-900Ⅱ培养基,一份加入 8 μl重组 Bacmid-MPB64-His质粒,另一份加入6 μl Cellfectin Reagen试剂,将两份溶液混合均匀并室温孵育45 min,6孔板加入对数生长期的Sf 9细胞,每孔1.0×106个,27℃静止培养1 h,轻轻移去培养基,加入上述混合物,27℃静止培养4 h,移去上述混合溶液,加入2 ml培养基,湿盒中27℃培养72 h后可以看到细胞发生病变,当发生病变的细胞大于50%时,收细胞和培养基,800 r/min离心5 min,取上清即是P1代病毒,P1代病毒加入2%胎牛血清4℃避光储存。P1代病毒连续转染细胞3次获得P4代病毒。
1.2.6 测定P4代病毒滴度 对数生长期的细胞加入6孔板,每孔2 ml 5×105个/ml,贴壁培养过夜,P4代病毒用培养基稀释成103~108,移去上清液,每孔加病毒稀释液1 ml,27℃培养1 h后,移去病毒液,将提前在40℃保温的4%低熔点琼脂和1.3×的培养基按1∶3比例混合,并迅速加入6孔板,自然凝固后置于27℃湿盒中静止培养10~15 d,至每孔中的蚀菌斑数连续2 d不变,选择蚀斑数在3~20个的孔,病毒滴度的计算公式:滴度(pfu/ml)=每孔蚀斑数×稀释倍数/1 ml。
1.2.7 转染条件的优化 用P4代病毒转染对数生长期细胞,细胞密度2×106个/ml,27℃摇床100 r/min 培养,不同时间取样(24、48、60、72、84、96、108、120 h),并取同样细胞设不同感染复数(2,3,4,5,6)组,96 h后取样,SDS-PAGE电泳后,取胶300 mA转膜75 min,5%脱脂奶粉室温封闭1 h,2.5%脱脂奶粉2 000倍稀释anti-his单克隆抗体,室温孵育2 h,TBST洗涤3次,每次5 min,3 000倍稀释二抗,室温孵育1 h,TBST稀释3次,曝光。
1.2.8 蛋白纯化 A液为20 mmol/L PB,pH8.0;B液为20 mmol/L PB+500 mmol/L NaCl,pH8.0;C 液为20 mmol/L PB+400 mmol/L咪唑,pH8.0。收集细胞培养液,调pH至8.0上Q柱100%A液平衡,16%B液冲洗杂蛋白,30%B液洗脱目的蛋白,100%B液再生Q柱。Q柱收集液上Ni柱,A液平衡,7.5%C液冲洗杂蛋白,50%C液洗脱目的蛋白,100%C液再生Ni柱。纯化后蛋白超滤离心除盐,经SDS-PAGE电泳后,利用灰度分析测定纯度,BCA蛋白浓度测定试剂盒检测蛋白浓度,计算蛋白表达量。
1.2.9 免疫小鼠 BALB/c小鼠随机分为三组,每组6只。空白对照组腹腔注射生理盐水,阳性对照组注射卡介苗BCG,实验组采用腹腔注射MPB64蛋白免疫BALB/c小鼠3次,每只每次0.05 mg(生理盐水组0.2 ml/只),每次间隔2周,每次免疫后第3天断尾取血,血清储存在-80℃备用。
1.2.10 血清中抗体滴度的检测 BCG和纯化的蛋白MPB64分别在碳酸盐包被缓冲液中稀释到1.0 μg/ml,100 μl/孔包被酶标板 4℃过夜,PBST 洗3次,分别加入PBS稀释的血清100 μl/孔,20倍稀释起始,依次倍比稀释12个浓度梯度,空白孔用PBS代替,37℃孵育2 h,PBST 洗3次,每孔100 μl加5 000倍稀释的二抗,37℃孵育1 h,PBST洗3次,加底物显色,酶标仪检测490 nm波长下的吸光值。
1.2.11 脾脏细胞分泌IFN-γ的检测 BALB/c小鼠免疫后第9周处死,无菌条件下分离脾脏细胞,每孔40万个细胞铺96孔板。每孔加入10 μg培养基稀释的MPB64蛋白,空白对照加入等量培养基,37℃培养72 h后取上清,ELISA方法检测血清中IFN-γ浓度,实验步骤按照说明书。
1.2.12 重组蛋白MPB64对脾脏细胞的增殖活性
BALB/c小鼠免疫后第9周处死,无菌条件下分离脾脏细胞,每孔40万个细胞铺96孔板。稀释成不同浓度的重组蛋白给药,最高浓度100 μg/孔,连续2倍稀释10个梯度。以 PBS作为空白对照。37℃培养72 h后每孔加25 μl MTT,继续培养4 h,小心的除去上清,每孔加120 μl DMSO,震荡10 min至结晶溶解。在630 nm和570 nm双波长下测定吸光度,计算重组蛋白对脾脏细胞的增殖活性。
2 结果
2.1 Bacmid-MPB64-His表达载体构建示意图 杆状病毒表达载体Bacmid-MPB64-His的构建,如图1所示。克隆的MPB64-His基因插入到杆状病毒转移载体pFastBac的BamHⅠ和 PstⅠ酶切位点之间。重组转移载体pFastBac-MPB64-His转染DH10Bac感受态细胞,并在帮助质粒的作用下与DH10Bac中的表达载体Bacmid在mini-Tn7位点发生转座,获得重组MPB64-His质粒。
2.2 目的基因的PCR扩增 MPB64-His基因包括MPB64的687 bp和其后的His标签以及加两端的酶切位点共744 bp,结果与预期一致,如图2所示。
2.3 重组pFastBac-MPB64-His质粒的双酶切验证提取pFastBac-MPB64-His质粒,用 BamHⅠ和 PstⅠ双酶切,酶切大小片段与预期结果一致,如图3所示。
2.4 重组Bacmid-MPB64-His载体的PCR验证提取Bacmid-MPB64-His质粒,以MPB64-His的上游引物和M13的下游引物做PCR验证,电泳结果与预期值1 223 bp一致,如图4所示。

图1 杆状病毒表达载体的构建Fig.1 Construction of recombinant baculovirus expression vector
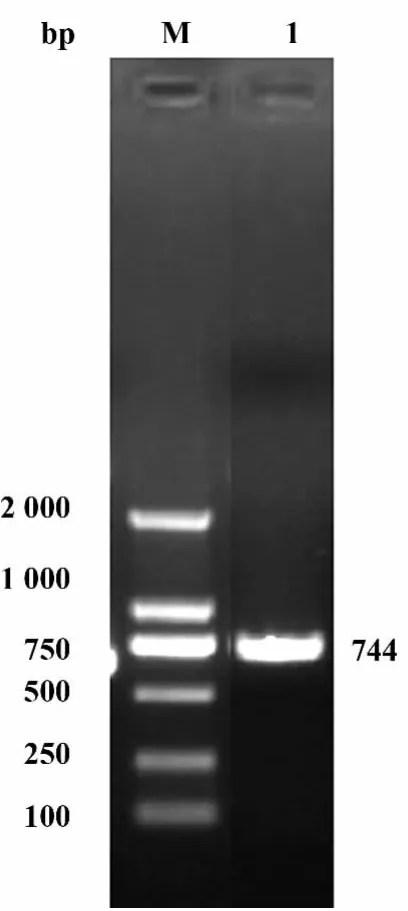
图2 PCR扩增MPB64-His基因Fig.2 PCR product of MPB64-His gene
2.5 昆虫细胞感染病毒后的形态学鉴定 重组Bacmid-MPB64-His载体在转染试剂的介导下转染对数生长期的昆虫细胞,昆虫细胞感染病毒72 h后,在显微镜下观察形态变化,细胞停止生长分裂,细胞内有粒状物出现,细胞表面出芽,出泡,部分细胞裂解,如图5所示。

图3 pFastBac-MPB64-His双酶切鉴定Fig.3 Identification of recombinant plasmid pFastBac-MPB64-His
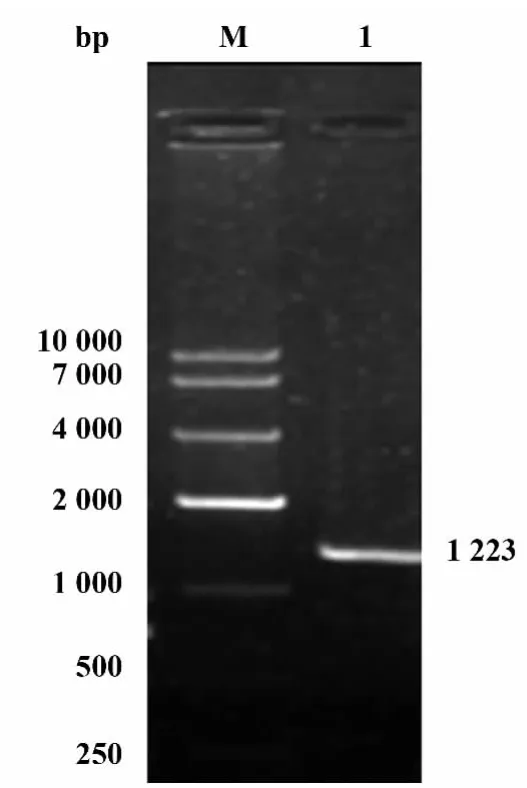
图4 PCR鉴定重组杆状病毒DNAFig.4 Identification of recombinant baculovirus DNA by PCR
2.6 蛋白的表达 P3代病毒转染对数生长期的昆虫细胞,72 h后收集上清经15%SDS-PAGE电泳显示在23 kD有蛋白表达,如图6所示。P4代病毒转染对数生长期的昆虫细胞,收集上清做Western blot鉴定,证明细胞感染病毒48 h后有蛋白表达,96 h时蛋白表达量最高,感染复数(MOI)为4时蛋白收获最高,如图7所示。
2.7 蛋白的纯化 收集上清上样于Q柱,洗脱样品在SDS-PAGE电泳显示目的条带在含0.15 mol/L NaCl的PB缓冲液中洗脱,洗脱样品上样于Ni亲和层析柱,用含咪唑的PB缓冲液洗脱,样品经12%SDS-PAGE电泳显示目的蛋白在含0.2 mol/L咪唑的PB缓冲液中洗脱。灰度分析测定蛋白纯度为91%。洗脱样品除盐后测定蛋白浓度,计算上清中蛋白收量为35 mg/L,如图8所示。
2.8 血清中抗体效价测定 MPB64免疫组血清中抗体效价的测定在20~5 120倍间呈S形曲线,最佳稀释倍数为2 000倍。MPB64免疫组明显高于BCG对照组,结果如图9所示。
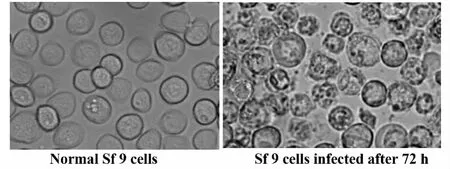
图5 正常及感染后的Sf 9细胞形态Fig.5 Normal Sf 9 and Sf 9 cells infected after 72 h
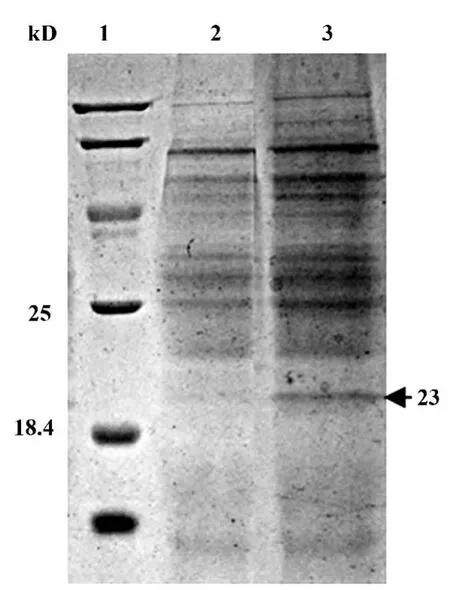
图6 病毒感染细胞后的蛋白表达Fig.6 Protein expression after virus infected cells
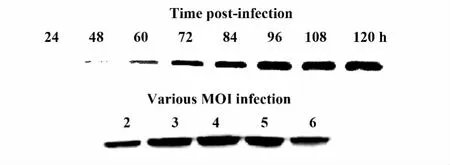
图7 Western blot检测不同时间和感染复数表达蛋白表达情况Fig.7 Detection of expression of recombinant MPB64-His protein in different infection time and various MOI infection by Western blot

图8 MPB64蛋白纯化结果Fig.8 Purification of MPB64

图9 血清抗体的滴度Fig.9 Serum antibody titer
2.9 脾脏细胞分泌IFN-γ的检测 免疫后的第9周,取小鼠脾脏细胞培养在96孔板,加入10μg蛋白MPB64刺激,72 h后培养基中IFN-γ的含量为35.75 pg/ml,明显高于空白对照组的1.28 pg/ml,如图10所示。
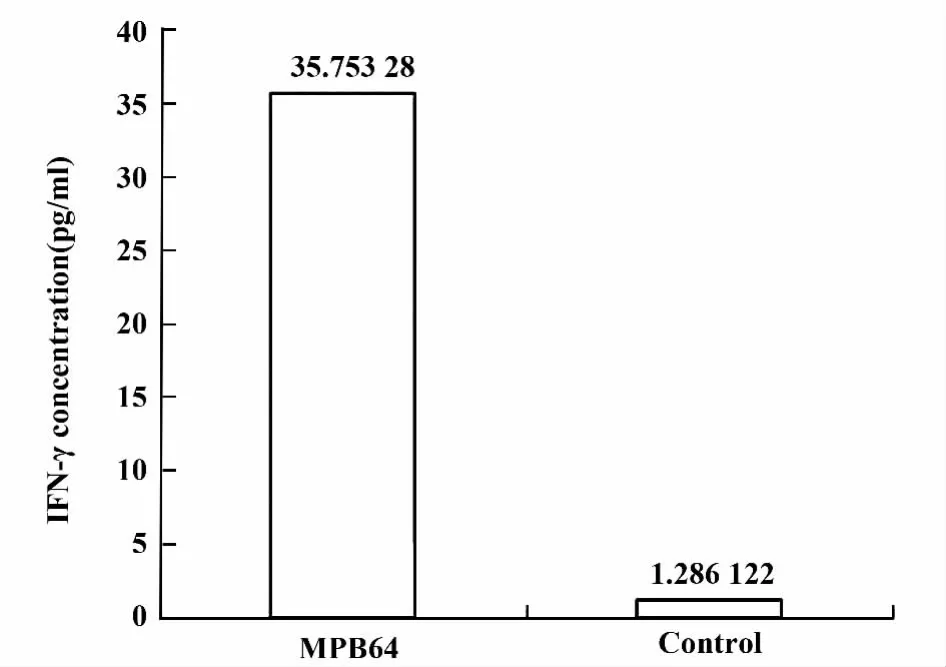
图10 培养基上清中IFN-γ的含量Fig.10 Supernatant levels of IFN-γ

图11 MPB64促脾脏细胞增殖研究Fig.11 MPB64 promoted splenic lymphocytes cells proliferation
2.10 重组蛋白对脾脏细胞的增殖活性验证 酶标仪检测570 nm波长下的吸光值,数据如图11所示,由数据显示重组蛋白对免疫过的小鼠脾脏细胞有明显的促增殖作用,在蛋白浓度0.2~100 μg/ml之间呈剂量依赖性。
3 讨论
自1990年以来,TB已经受到世界各国的重视,每年新增病例以及死亡人数持续减少,但由于耐药TB的出现以及结核病例感染艾滋病毒,使得TB控制的进展极为缓慢。我国在全球22个TB重灾区中仅次于印度排名第二[5,6]。TB的治疗费用高,且因耐药甚至耐多药株的出现使TB的多种药物作用降低,尤其是耐多药TB的治疗副作用较大,治疗周期延长。
BCG仍是目前预防TB唯一可用的疫苗。BCG的制备和传代过程中丢失了部分与保护力相关的基因。接种BCG可显著降低儿童TB的发病率和死亡率,但对成人的免疫效果极不稳定,保护力为0~80%,而且BCG仍存在一定毒力,最近研究显示BCG与临床致病结核分枝杆菌有很大不同,BCG对流行的临床菌株北京株缺乏有效作用[7]。
亚单位疫苗与BCG相比,具有组分明确、生产周期短、价格低廉、无毒安全等优点,已受到国内外众多学者的青睐,目前已知的保护性抗原有MTB早期分泌蛋白ESAT6、CFP10、MPB64和Ag85B复合物等[8]。
杆状病毒表达载体系统(BEVS)是1983年由Smith等[9]建立,具有蛋白表达水平高、周期短、对目的蛋白有翻译后修饰作用等优点[10,11]。它几乎可以表达任何生物(从细菌到人体组织)的基因产物和进行任何细胞定位(细胞内、细胞外周质),已广泛用于生物制药、基因工程及疫苗的研究及生产,其中在该系统中生产的流感疫苗和猪瘟亚单位疫苗具有良好的效果[12,13]。
本实验在杆状病毒表达载体系统成功地表达了结核分枝杆菌蛋白MPB64并进行纯化,又进一步验证重组蛋白MPB64的免疫原性,证明重组蛋白可以刺激BALB/c小鼠产生抗体,提高BALB/c小鼠血清中IFN-γ的含量。IFN-γ可激活巨噬细胞,增强巨噬细胞杀伤能力,抑制MTB生长,最终产生抗TB的保护效应。
目前,我国结核感染皮试诊断及流行病学调查主要采用PPD(结核杆菌精致纯蛋白衍生物)皮试。但PPD中存在致病性分枝杆菌、环境中的分枝杆菌及BCG所共有的抗原,因而不能区分BCG接种、非致病性分枝杆菌感染和结核杆菌感染,特异性和敏感性均不理想。因MPB64只存在于致病性结核分枝杆菌,不存在于作为疫苗的BCG中,纯化后的重组蛋白除可作为疫苗外,可用于制备检测试剂盒,检测接种人群的抗体表达量。对比PPD检测可以区别BCG免疫和MTB感染。本课题组在以上实验的基础之上,将继续对MPB64免疫原性进一步检测,并对重组蛋白MPB64进行保护力的探究和尝试,利用重组蛋白MPB64对TB检测进行开发。
[1]赵 钢,杜 芳.结核性脑膜炎临床诊断思路[J].中国现代神经疾病杂志,2013,13(1):1-4.
[2]Skeiky YA,Sadoff JC.Advances in tuberculosis vaccine strategies[J].Nat Rev Microbiol,2006,4(6):469-476.
[3]Fine PE.Variation in protection by BCG:implications of and for heterologous immunity [J].Lancet,1995,346(8986):1339-1345.
[4]Kamath AT,Feng CG,Macdonald M,et al.Differential protective efficacy of DNA vaccines expressing secreted proteins of Mycobacteria tuberculosis[J].Infect Immun,1999,67(4):1702-1707.
[5]Centers for Disease Control and Prevention.Development of new vaccines for tuberculosis,recommendations of the advisory council for the elimination of tuberculosis(ACET)[J].Morb Mortal Wkly Rep,1998,47:1-6.
[6]Floyd K,Blanc L,Raviglione M,et al.Resources required for global tuberculosis control[J].Science,2002,295(3):2040-2041.
[7]Tsenova L,Harbacheuski R,Sung N,et al.BCG vaccination confers poor protection against M.tuberculosis HN878-induced central nervous system disease[J].Vaccine,2007,25(28):5126-5132.
[8]Doherty TM,Andersen P.Tuberculosis vaccine development[J].Curr Opin Pulm Med,2002,8(3):183-187.
[9]Smith GE,Fraser MJ,Summers MD.Molecular engineering of the Autographa californica nuclear polyhedrosis virus genome:deletion mutations within the polyhedrin gene[J].J Virol,1983,46(2):584-593.
[10]Schmidt FR.Recombinant expression systems in the pharmaceutical industry[J].Appl Microbiol Biotechnol,2004,65:363-372.
[11]Van ND,Fortunati E,Ehlert E,et al.Baculovirus infection of nondividing mammalian cells:mechanisms of entry and nuclear transport of capsids[J].J Virol,2001,75:951-970.
[12]Blanchard P,Mahe D,Cariolet R,et al.Protection of swine against post-weaning multisystemic wasting syndrome(PMWS)by porcine circovirus type 2(PCV2)proteins[J].Vaccine,2003,21:4565-4575.
[13]Cox MJ,Hollister JR.FluBlok,a next generation influenza vaccine manufactured in insect cells[J].Biologicals,2009,37:182-189.

