PPAR-γ配体对绒癌细胞系JEG- 3体外增殖、分泌和侵袭能力的影响
丁 峰,崔新红,钮 彬,邢福祺
(1.解放军第456医院 妇产科, 山东 济南 250031; 2.南方医科大学 附属南方医院 生殖中心, 广东 广州 510515)
研究论文
PPAR-γ配体对绒癌细胞系JEG- 3体外增殖、分泌和侵袭能力的影响
丁 峰1,崔新红1,钮 彬1,邢福祺2*
(1.解放军第456医院 妇产科, 山东 济南 250031; 2.南方医科大学 附属南方医院 生殖中心, 广东 广州 510515)
目的观察PPAR-γ配体吡格列酮(PGZ)调节绒癌细胞系JEG- 3的增殖、分泌hCG和体外侵袭、转移能力。方法用MTT法和IEMA测定细胞的增殖和分泌hCG。Matrigel侵袭模型分析细胞的迁徙和侵袭能力。结果小剂量PGZ对JEG- 3有增殖抑制作用,随PGZ浓度的增加,JEG- 3透过Matrigel膜的细胞数明显减少(Plt;0.01)。结论PGZ明显抑制JEG- 3肿瘤细胞的生长和侵袭能力,提示PPAR-γ途径可能是妊娠滋养细胞肿瘤治疗的新方向。
妊娠滋养细胞疾病; 过氧化物酶增殖体激活受体; 增殖; 绒毛膜促性腺激素; 肿瘤侵袭力
过氧化物酶增殖体激活受体(peroxisome proliferators-activated receptor, PPAR)是核激素受体超家族成员之一,参与脂质、葡萄糖代谢、感染、血管形成及肿瘤发生等过程[1- 3],其3种亚型α、 γ、 β/δ在人滋养细胞均有表达,可能与先兆子痫、妊娠期糖尿病、胎儿宫内发育迟缓密切相关[4- 5]。PPAR在母胎界面具有侵蚀能力的绒毛外细胞滋养细胞表达,提示PPAR可能调节滋养细胞的侵润行为。在胎盘形成过程中,滋养细胞侵润内膜不足可导致早期流产、先兆子痫和胎儿宫内发育迟缓;侵润过度可能发生妊娠滋养细胞疾病[6]。本研究观察PPAR-γ配体-吡格列酮(Pioglitazone,PGZ)是否能调节恶性滋养细胞的生物学行为。
1 材料与方法
1.1 实验试剂
胰蛋白酶(Amresco公司),胶原蛋白酶和PGZ(Sigma公司),MTT(Gibco公司),鼠抗人细胞角蛋白7 抗体(武汉博士德生物制品公司),细胞侵袭分析试剂盒(matrigel chamber)(Chemicom公司)。
1.2 标本来源及实验方法
1.2.1 研究对象: JEG- 3细胞系(ATCC HTB36)(中国科学院动物研究所计划生育生殖生物学国家重点实验室赠送)。另取自愿人工流产术后正常早孕绒毛组织(12周以内)作为对照(患者知情同意,妊娠后未服用甾体类药物)。
1.2.2 标本采集:
1)组织块培养法培养人绒毛膜滋养层细胞:方法见文献[7]。
2)人绒毛外滋养细胞的鉴定,将绒毛外滋养细胞制成细胞悬液(4×104/mL), 接种到事先放置有载玻片的培养板中, 制备细胞爬片。细胞免疫组化法,观察CK7在滋养细胞中的表达。光学显微镜观察阳性细胞率gt;95%,证明细胞纯度超过95%,可用于实验(图1)。

图1 培养的滋养细胞CK7 免疫细胞化学染色Fig 1 CK7 immunocytochemistry in cultured trophoblastcells(×200)
3)JEG- 3细胞培养及传代,JEG- 3细胞(MEM培养液)贴壁邮票样生长,长满瓶壁的80%~90%(约7 d),进行传代,2%乙二胺四乙酸二钠消化传代。
1.2.3 实验方法:
1)MTT法测定细胞增殖能力,单细胞悬液(4×105/mL)按每孔100 μL接种于96孔平板,再加入200 μL含20%小牛血清MEM培养液,37 ℃,5% CO2培养24 h,再无血清培养24 h后,设空白对照组及0.1、1.0、10和100 μmol/L PGZ处理组各3孔。培养48 h,加入MTT(2 g/L,200 μL/孔),继续培养4 h。吸出孔内培养液(分装于艾本德离心管中,-20 ℃冻存,用于人绒毛促性腺激素hCG测定)。96孔板加入DMSO液(150 μL /孔),室温下将平板置于微孔板振荡器上振荡10 min,使结晶物溶解。酶标仪检测各孔A值(A=570 nm),记录结果,绘制细胞活力曲线图。
2)磁性微粒分离的免疫酶联法(IEMA)测定细胞分泌hCG能力,前述培养液及各浓度标准液、对照液各2份加入试管,分别加入0.2 mL凝血酶原抗绒毛膜促性腺激素试剂,孵育后用分离液进行磁性分离,去掉上清液并清洗试管后强烈振荡, 磁性颗粒沉淀,加入基质液第2次孵育,终止液终止反应。用空白管在550 nm波长校正光度计零点,在550 nm和492 nm波长测标准液、对照液及标本的吸收率。
3)细胞侵袭能力测定,实验分组及处理按实验方法1,培养48 h后收集各组细胞,分别将各组细胞用PBS洗涤2次, 按试剂盒操作说明, 将细胞悬液200 μL加入细胞侵袭分析试剂盒小室的上室, 而在下室加入500 μL含100 mL/L小牛血清的MEM培养液, 继续常规培养24 h。取出滤膜, 拭去滤膜表面残留细胞, 固定后经试剂盒提供的专用染液染色,200倍光镜下随机选取6个视野, 计数侵袭到滤膜背面的穿膜细胞数, 以穿膜细胞的相对数目表示细胞侵袭力的大小。
1.3 统计学分析
2 结果
2.1PGZ对人绒毛膜滋养层细胞和JEG-3细胞增殖能力的影响
PGZ对滋养细胞的抑制作用不明显。小剂量PGZ对JEG- 3细胞有抑制作用,细胞数量减少、生存能力下降、细胞的生长受到抑制,浓度越大抑制作用越强(Plt;0.01)(表1)。
2.2PGZ对人绒毛膜滋养层细胞和JEG-3细胞分泌hCG的影响
PGZ对滋养细胞及JEG- 3细胞分泌hCG有一定抑制作用,无剂量依赖性,亦无明显差异(表2)。
2.3PGZ对人绒毛膜滋养层细胞和JEG-3细胞体外侵袭/迁移能力的影响
PGZ处理后,JEG- 3细胞透过Matrigel膜的细胞数减少,随PGZ浓度的增加,透过Matrigel膜的细胞数明显减少,有剂量-效应关系,与滋养细胞相比有显著性差异(Plt;0.01)(表3)。
3 讨论
在胎盘形成过程中,滋养细胞增生和对子宫内膜的侵蚀是受滋养细胞-子宫内膜微环境中多种因子的严格调控。绒癌细胞的增殖和侵蚀不同于正常滋养细胞,无节制性的增殖是恶性肿瘤最重要特征。在人胎盘中,PPAR γ特异性地在绒毛细胞滋养细胞、合体滋养细胞及绒毛外细胞滋养细胞(EVCTs)表达。
PPAR-γ自然配体15-d-PGJ2能刺激滋养细胞侵蚀相关基因adipophilin (adipose differentiation-ralated protein,ADRP)和osteopontin(OPN)的表达,减弱细胞增殖并诱导细胞分化[8]。本资料显示,PPAR合成配体PGZ抑制正常滋养细胞的生长,但作用不明显,对JEG- 3的增殖产生负调节作用,生长曲线呈明显下降趋势,发挥抑制JEG-3肿瘤细胞生长和增殖的作用,说明PPAR能特异抑制绒癌细胞的生长,且有剂量依赖关系,PGZ剂量越大抑制肿瘤生长的能力越强,对肿瘤的生长有抑制作用。肿瘤细胞的生长是一个复杂的过程,PPAR通过什么途径控制JEG- 3的生长,尚不明确。PPAR调节多种细胞的增殖、分化,参与多种组织的生理、病理过程[9- 10]。PPAR-γ具有抗炎性反应和MMP抑制剂(TIMP)的作用[11],与早期的资料相吻合[12],在恶性滋养细胞肿瘤中TIMPs较MMPs表达明显较弱,不能发挥阻抑MMP- 2的作用,加速细胞外基质降解、细胞转移的过程。TIMPs与相应的MMPs酶原及其活化形式结合,从而抑制MMPs的活性,是肿瘤发生恶变与转移的阻抑基因。
hCG是妊娠滋养细胞疾病诊断、监测和预后的重要指标, JEG- 3、BeWo细胞分泌hCG的功能均可受外源性KGF的调节,能明显促进JEG- 3、BeWo分泌hCG,调控绒癌细胞分泌功能[13]。但本资料显示PGZ对绒癌细胞JEG- 3和滋养细胞分泌hCG影响不明显,与PGZ的剂量无关,可能PPAR对绒癌、滋养细胞的保护作用并不是通过调节hCG实现的。
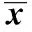
表1 15- d-PGJ2对滋养细胞和绒癌细胞系JEG- 3体外增殖能力的影响
*Plt;0.01 compared with tropoblast.
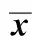
表2 15-d-PGJ2对滋养细胞和绒癌细胞系JEG- 3体外分泌hCG的影响Table 2 Effect of pioglitazone on secretion of trophoblast and choriocarnoma cell line in vitro (±s, A value,n=3)

表3 15-d-PGJ2对滋养细胞和绒癌细胞系JEG- 3体外侵袭能力的影响
*Plt;0.01 compared with tropoblast.
PPAR-γ抑制滋养细胞的侵蚀行为,同时PPAR-γ降调节具有侵蚀能力的EVCTs分泌的hCG,侵蚀性滋养细胞分泌的hCG启动了滋养细胞的侵蚀过程[14]。体外实验已证实PPAR在葡萄胎和绒癌组织降表达,间接说明PPAR在滋养细胞肿瘤发展中可能发挥保护作用。对绒癌细胞的体外侵袭能力,PPAR-γ配体PGZ对滋养细胞的侵袭力无明显保护作用,说明PPAR在正常妊娠过程中,不影响滋养细胞对子宫内膜的侵袭。对绒癌细胞,小剂量PGZ就能减少JEG- 3细胞通过Matrigel膜的数量,随剂量增大,通过Matrigel膜的数量明显减少,说明PGZ能降低绒癌细胞的体外侵袭能力,抑制肿瘤细胞的侵袭,从而抑制肿瘤的转移,具体的调节机制尚不清楚。
早期绒癌经化疗后预后好,晚期与复发者预后仍恶劣,虽然化疗能明显提高滋养细胞肿瘤患者的生存率,但化疗的不良反应常是患者的致命因素。肿瘤的生物治疗和基因治疗是目前治疗的新方向。PGZ明显抑制JEG- 3肿瘤细胞的生长,并一定程度抑制肿瘤细胞的侵袭能力,提示PPAR-γ途径可能是妊娠滋养细胞肿瘤治疗的新方向。
[1] Takiko D, Susanne T, Anindita C,etal.Extracellular signal-regulated kinase is a target of cyclooxygenase-1-peroxisome proliferator-activated receptor-signaling in epithelial ovaria cancer[J]. Cancer Res,2007, 67: 5285- 5292.
[2] Suwaki N,Masuyama H,Masumoto A,etal. Expression and potential role of peroxisome proliferation-activated receptor gamma in the placental of diabetic pregnancy[J].Placenta,2007,28:315- 323.
[3] Froment P, Gizard F, Defever D,etal.Peroxisome proliferator-activated receptors in reproductive tissues: from gametogenesis to parturition[J]. Endocrinology, 2006,189:199- 209.
[4] Bodnar LM, Catov JM, Klebanoff MA,etal. Prepregnancy body mass index and the occurrence of severe hypertensive disorders of pregnancy[J]. Epidemiology, 2007,18:234- 239.
[5] Fritz W, Leslie W, Christophe D,etal. PPAR action in human placental development and pregnancy and its complications[J]. PPAR Res, 2008, 2008: 527048- 527052.
[6] Paiva P,Salamonsen LA,Manuelpillai U,etal. Interleukin- 11 promotes migration, but not proliferation, of human trophoblast cells, implying a role in placentation[J]. Endocrinology, 2007,148:5566- 5572.
[7] Dong YL,Reddy DM, Green KE,etal.Calcitonin gene-related(CALCA) is a proangenic growth factor in the human placental development[J]. Biol Reprod,2007,76:892- 899.
[8] Desmarais JA,Lopes FL,Zhang H,etal.The peroxisome proliferator-activated receptor gamma regulates trophoblast cell differentiation in mink (Mustela vison) [J]. Biol Reprod, 2007,77:829- 839
[9] Hou X,Zhang Y,Shen YH,etal.PPAR-γactivation by rosiglitazone suppresses angiotensin Ⅱ-mediated proliferation and phenotypictransition in cardiac fibroblasts via inhibition of activation of activator protein 1[J].Eur Pharmacol,2013,18:428- 437.
[10] Yu YH,Chang YC,Su TH,etal. Prostaglandin reductase- 3 negatively modulates adipogenesis through regulation of peroxisome proliferator-activated receptor γ activity[J]. J Lipid Res, 2013,54:2391- 2399.
[11] Sadeghian M,Marinova-M,Broom L,etal.Full and partial peroxisome proliferation-activation receptor-γ agonists,but not δagonist,rescue of dopaminergic neurons in the 6-OHDA parkinsonian model is associated with inhibition of microglial activation and MMP expression[J]. Neuroimmunol, 2012,246:69- 77.
[12] 丁峰,张秋实,邢福祺. MMP- 2/TIMP- 7在妊娠滋养细胞疾病组织中的表达及意义[J].南方第一军医大学学报,2007,27:150- 152.
[13] 丁峰,吴晓英,钮彬. KGF对绒癌细胞系JEG- 3,BeWo体外增殖和分泌功能的影响[J].实用医药,2008,25:1362- 1364.
[14] Handschuh K,Guibourdenche J,Tsatsaris V,etal. Human chorionic gonadotropin produced by the invasive trophoblast but not the villous trophoblast promotes cell invasion and is down-regulated by peroxisome proliferator-activated receptor-gamma[J]. Endocrinology, 2007,148:5011- 5019.
The effect of PPAR-γ ligand on proliferationand secretion and invasion of JEG- 3 choriocarnoma cells in vitro
DING Feng1, CUI Xin-hong1, NIU Bin1, XING Fu-qi2*
(1.Dept. of Obstetrics and Gynecology, 456 Hospital of PLA, Jinan 250031; 2.Dept. of Reproductive Center, Nanfang Hospital, Nanfang Medical University,Guangzhou 510515, China)
ObjectiveTo observe the effect of ligand of peroxisome proliferators-activated receptor gamma (PPAR gamma) on the proliferation and secretion of trophoblast and choriocarnoma cells (JEG- 3) and to study the role played by PPAR gamma during the process of JEG- 3 activation.MethodsWe employed MTT assay to observ the growth of the cells and IEMA the secretion of hCG in the cells. Matrigel invision chambers were performed to analyse the cell migration and invasion.ResultsThe proliferation of JEG- 3 was suppressed by PGZ with a low dose-dependent manner. The numbers of JEG- 3 was obviously inhibited by PGZ(Plt;0.01)with increasing concentration.ConclusionsThe results obtained with thisinvitrosystem demonstrated that PPAR gamma activation may inhibit JEG- 3 proliferation and invasiveness. PPAR gamma may be a new therapeutic target for gestational trophoblastic tumor in humans.
gestational trophoblastic tumor (GTT); peroxisome proliferator-activated receptors (PPARs); proliferation; chorionic gonadotropin(hCG); neoplasm invasion
2013- 12- 12
2014- 04- 21
国家科技部“973”课题(G1999055903)
*通信作者(correspondingauthor):dfsyw@sina.com
1001-6325(2014)10-1344-04
R 737.33
A

