HO- 1减轻吸烟大鼠血清引起的HUVEC氧化损伤
杨根欢,吴 为,李砚川,倪 冷,王占启,王超楠,刘昌伟*
(中国医学科学院 北京协和医学院 1.北京协和医院 血管外科, 北京 100730;2.医学分子生物学国家重点实验室, 北京 100005)
研究论文
HO- 1减轻吸烟大鼠血清引起的HUVEC氧化损伤
杨根欢1,吴 为2,李砚川2,倪 冷1,王占启1,王超楠1,刘昌伟1*
(中国医学科学院 北京协和医学院 1.北京协和医院 血管外科, 北京 100730;2.医学分子生物学国家重点实验室, 北京 100005)
目的探讨血红素氧化酶- 1(HO- 1)是否能够减轻吸烟大鼠血清引起的人脐静脉内皮细胞(HUVEC)的氧化损伤。方法15只雄性SD大鼠随机分为正常对照组、吸烟组、吸烟并注射锌原卟啉(ZnPP)组。建立大鼠吸烟模型。Western blot检测各组大鼠颈动脉中HO- 1的表达。体外培养HUVEC,分为加入正常大鼠血清、吸烟大鼠血清和吸烟并注射ZnPP大鼠血清。Western blot检测各组HO- 1的表达。将吸烟大鼠血清加入HO- 1过表达及HO- 1低表达的HUVEC中,应用二氢溴化乙啶检测各组活性氧的含量。结果吸烟可以明显诱导大鼠颈动脉中HO- 1的表达(Plt;0.01)。吸烟大鼠血清及吸烟并注射ZnPP大鼠血清均可诱导HUVEC中HO- 1的表达,但后者作用更强(Plt;0.01)。吸烟大鼠血清能使HUVEC内活性氧含量增多(Plt;0.01),HO- 1能减轻此氧化损伤(Plt;0.01)。结论吸烟大鼠血清可以造成HUVEC的氧化损伤,H0- 1能够减轻此氧化损伤作用。
吸烟; 血红素氧化酶- 1;内皮细胞; 氧化损伤
吸烟是动脉粥样硬化最主要的危险因素之一。它可以引起组织及细胞的氧化损伤,进而影响细胞的正常功能[1]。血红素氧化酶- 1(HO- 1)是血红素在体内代谢的限速酶,是体内重要的抗氧化物质。HO- 1是诱导型的血红素氧化酶,细胞在缺氧、氧化应激、重金属和内毒素等刺激下其表达会增高[2]。已有研究表明HO- 1对血管内皮细胞起重要的保护作用[3]。本研究阐明了吸烟血清对人脐静脉内皮细胞的氧化损伤作用及HO- 1能够减轻此氧化损伤作用。
1 材料与方法
1.1 材料
限制性核酸内切酶和T4 DNA连接酶(NEB公司),DNA聚合酶(Transgene生物技术有限公司),引物合成(Invitrogen公司),FuGENE HD转染试剂(Roche公司),高糖-DMEM培养基(Hyclone公司),胎牛血清(Gibco公司), HUVEC及内皮细胞培养基(ScienCell 公司),HO- 1 siRNA(CST公司),鼠抗人Heme Oxygenase- 1抗体(BD公司),锌原卟啉- 9(Sigma公司),细胞内氧化应激活性氧红色荧光检测试剂盒(上海杰美基因医药科技有限公司)。
1.2 慢病毒载体pLenti-HO- 1的构建和鉴定
针对HO- 1的CDS区设计引物,两端加上酶切位点MluⅠ和BamHⅠ。PCR扩增HO- 1,产物经1.0%琼脂糖凝胶电泳回收。引物序列:正向:5′-TAAG AATTCGCCACCATGGAGCGTCCGCAACC-3′,反向:5′-AATACGCGTCATGGCATAAAGCCCTACAGC-3′。分别对PCR产物和改造的病毒空载体Plentilox3.7行MluⅠ和BamHⅠ双酶切。经纯化、连接和转化后,将感受态大肠埃希菌涂于LB平板并孵育。PCR鉴定阳性的克隆。用重组质粒转染HEK293T,Western blot检测HEK293T中HO- 1的表达。
将重组质粒与辅助质粒(plp1、plp2和VSVG)共同转染HEK293T,12 h后换液。24和48 h后分别收集上清并过滤,4 ℃、18 000 r/min离心3 h。弃掉上清后,用冷PBS重悬病毒并分装冻存于-80 ℃。同时用病毒悬液感染HEK293T及HUVEC,Western blot检测HO- 1的表达。
1.3 动物实验及吸烟大鼠血清的制备
15只SPF级雄性SD大鼠,平均体质量350 g[北京维通利华实验动物技术有限公司,合格证号:SCXK(京)20120001 ]。将动物随机分为吸烟组、吸烟并注射ZnPP(HO- 1抑制剂)组和正常对照组,每组5只。吸烟动物置于自制的大鼠吸烟装置中吸烟[4]。每天上下午各1次,每次吸烟20支(焦油量:13 mg/支,烟碱量:1.2 mg/支,CO量:14 mg/支)。每次同时点燃4支香烟,燃烧完后休息5 min再继续吸烟。隔天腹腔注射ZnPP1次,15 mg/kg。吸烟7 d后,取各组颈动脉标本置于液氮中保存,同时经腹主动脉尽量采取全部血液。所取血液于4 ℃过夜。将上层析出的血清再次离心后收集上清,并将其置于60 ℃中20 min灭活补体后置于-20 ℃保存。
1.4 Western blot检测HO- 1的表达
将颈动脉标本从液氮中取出后置于研钵中,加入200 μL SDS组织裂解液后研磨成组织匀浆。测定蛋白浓度后,传统方法行Western blot。用AlphaEaseFC软件测量条带的吸光度值,将各组的吸光度值行统计学分析。
1.5人脐静脉内皮细胞的培养及吸烟血清对其氧化性的检测
将HUVEC传至6孔板中,细胞铺展80%时换液。分别换为正常培养基、10%正常大鼠血清、5%吸烟大鼠血清、10%吸烟大鼠血清、5%吸烟并注射ZnPP组大鼠血清、10%吸烟并注射ZnPP组大鼠血清。孵育18 h后,行Western blot检测HO- 1的表达。
将HUVEC传至12孔板中。细胞达50%汇合时分别用携带HO- 1的慢病毒载体感染3个孔的细胞和HO- 1 siRNA转染3个孔的细胞。48 h后取慢病毒和siRNA干预过的细胞及正常细胞行Western blot检测HO- 1的表达。留取3个孔加入含40%正常大鼠血清的培养基做对照,其余孔加入含40%吸烟大鼠血清的培养基。3 h后按试剂盒说明书操作检测各组中活性氧的含量并于荧光显微镜下观察。荧光的强弱代表细胞内活性氧的含量即细胞被氧化的程度。用Image-ProPlus 6.0软件测量各组的荧光强度并进行统计学分析。
1.6 统计学分析
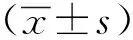
2 结果
2.1 慢病毒载体pLenti-HO- 1构建成功
扩增的目的基因片段大小与预期的相符。HEK293T能够成功表达重组质粒。慢病毒感染的HEK293T及HUVEC有绿色荧光出现且慢病毒感染两种细胞的效率均较高。两种细胞均成功表达HO- 1,表明慢病毒载体pLenti-HO- 1构建成功且能有效感染HEK293T和HUVEC。
*Plt;0.01 compared with ZnPP+smoking; #Plt;0.01 compared with control图1 不同处理组大鼠颈动脉HO- 1表达情况Fig 1 The expression of HO- 1 in carotid arteriestreated differently
2.2 不同处理组大鼠颈动脉HO- 1含量的检测
吸烟组大鼠颈动脉中HO- 1含量明显高于正常对照组大鼠(Plt;0.01)和吸烟并注射ZnPP组大鼠(Plt;0.01)(图1)。
2.3不同处理组大鼠血清对HUVEC中HO-1表达的影响
正常大鼠血清对HUVEC中HO- 1的表达无明显影响。吸烟大鼠血清能够明显诱导HO- 1的表达(Plt;0.01),且表达成剂量依赖性(10%组高于5%组)。吸烟并注射ZnPP组的大鼠血清也能够明显诱导HO- 1的表达(Plt;0.01),且表达成剂量依赖性(10%组高于5%组)。同时其诱导HO- 1的表达明显高于各个浓度的吸烟大鼠血清(Plt;0.05)(图2)。

*Plt;0.01 compared with control; #Plt;0.01 compared with 10% smoking图2 不同处理组大鼠血清对HUVEC细胞中HO- 1表达的影响Fig 2 The expression of HO- 1 in HUVEC incubatedin serum of rats treated differently
2.4吸烟大鼠血清对HUVEC的氧化作用及HO-1的抗氧化作用
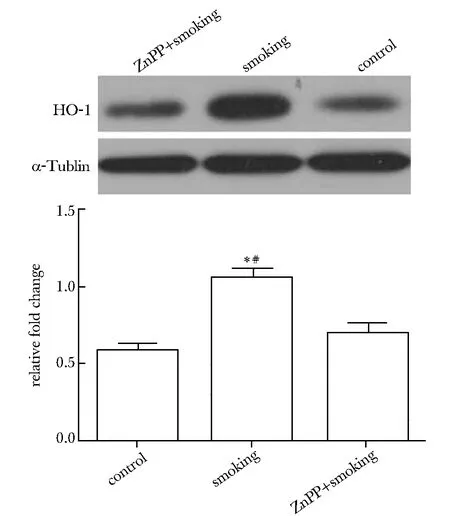
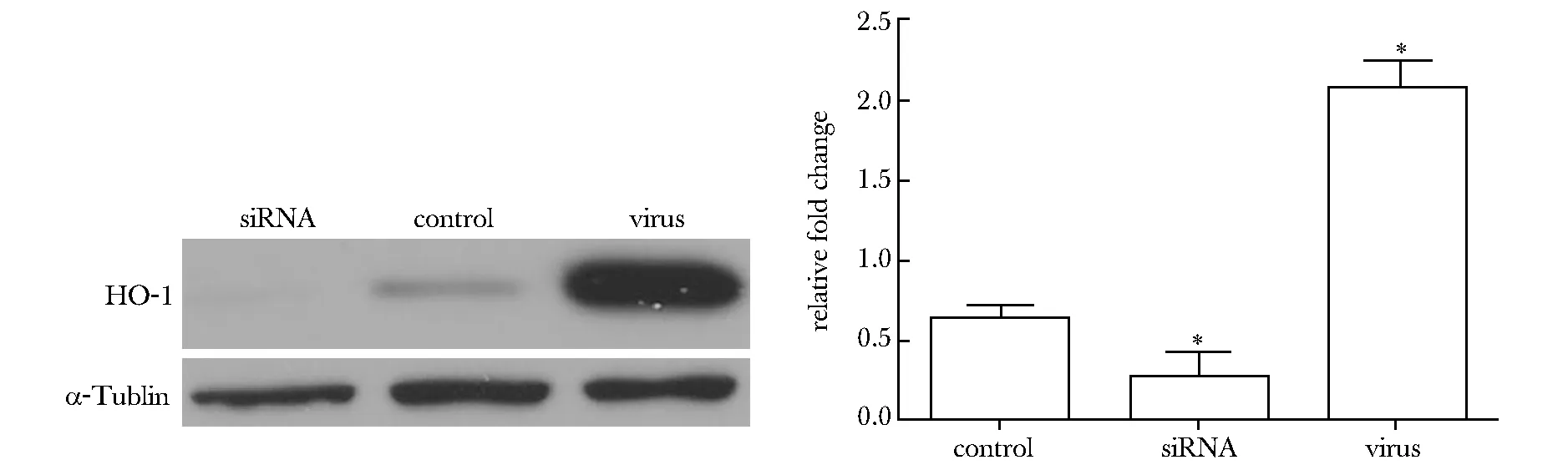
慢病毒载体和siRNA能够成功使HO- 1基因过表达和抑制(Plt;0.01)(图3)。加入吸烟大鼠血清的正常HUVEC组细胞内活性氧含量明显多于加入正常大鼠血清组(Plt;0.01)及HO- 1过表达组(Plt;0.01),HO- 1抑制组高于加入吸烟大鼠血清的正常HUVEC组(Plt;0.05)(图4)。
*Plt;0.01 compared with control图3 病毒感染组和siRNA转染组HUVECs中HO- 1表达情况Fig 3 The expression of HO- 1 in virus infecting and siRNA transfecting HUVECs
A.HUVECs incubated in the serum of normal rats; B. HUVECs incubated in the serum of smoking rats; C.HUVECs(infected by virus) incubated in the serum of smoking rats; D.HUVECs(transfected by siRNA) incubated in the serum of smoking rats;*Plt;0.01 compared with A or C;#Plt;0.05 compared with B
图4吸烟大鼠血清对HUVECs细胞的氧化作用及HO-1的保护作用
Fig4TheoxidativeroleoftheserumofsmokingratsandtheantioxidanteffectofHO-1(×100)
3 讨论
据统计香烟的烟雾中含有的毒害物质有4 000多种[5],包括高浓度的活性氧、NO、过(氧化)亚硝酸盐及多种有机化合物[6- 7]。这些物质中很多是水溶性的,可以直接进入血液循环,进而可以对组织细胞造成包括氧化损伤在内的多种损伤[8]。吸烟造成氧化损伤的机制主要包括,烟雾中的活性氧等成分可以直接对组织细胞造成氧化损伤,烟雾中某些成分可以激活细胞内氧化应激相关的酶进而引起氧化损伤,烟雾可以引起机体的炎性反应进而导致氧化损伤[9- 10]。因此氧化损伤是吸烟造成组织损伤的主要形式之一。减轻吸烟造成的氧化损伤对于保护吸烟状态下的血管具有重要意义。
本研究中吸烟可以明显诱导大鼠颈动脉中HO- 1的表达。这表明吸烟可以引起血管的氧化损伤,进而诱导抗氧化物质HO- 1的表达。吸烟大鼠血清能够诱导HUVEC中HO- 1的表达,且表达成剂量依赖性。这间接表明吸烟大鼠血清能够造成HUVEC的氧化损伤。吸烟并注射ZnPP组大鼠血清也能够明显诱导HUVEC中HO- 1的剂量依赖性的表达,且表达量明显高于吸烟大鼠血清。这说明抑制了吸烟大鼠体内HO- 1的表达后,机体组织受到了更强的氧化损伤,其血清中能造成氧化损伤的物质更多,能够对HUVEC造成更强的氧化损伤。同时间接表明HO- 1能够减轻吸烟诱导的氧化损伤。用DHE直接检测加入吸烟大鼠血清的HUVEC中活性氧的含量,结果显示HO- 1低表达组最多,其次是正常HUVEC组,HO- 1过表达组最少。这直接说明吸烟大鼠血清对HUVEC具有明显的氧化损伤作用,HO- 1能够减轻这种氧化损伤作用。
[1] Davies KJ. Oxidative stress, antioxidant defenses, and damage removal, repair, and replacement systems[J]. IUBMB Life,2000,50:279- 289.
[2] Neubauer JA, Sunderram J. Heme oxygenase- 1 and chronic hypoxia[J]. Respir Physiol Neurobiol, 2012,184:178- 185.
[3] Wilson SJ, Keenan AK. Role of hemin in the modulation of H2O2-mediated endothelial cell injury[J]. Vascul Pharmacol, 2003,40:109- 118.
[4] Hautamaki RD, Kobayashi DK, Senior RM,etal. Requirement for macrophage elastase for cigarette smoke-induced emphysema in mice[J]. Science,1997,277:2002- 2004.
[5] Csiszar A, Podlutsky A, Wolin MS,etal. Oxidative stress and accelerated vascular aging: implications for cigarette smoking[J]. Front Biosci (Landmark Ed),2009,14:3128- 3144.
[6] Pryor WA, Stone K, Zang LY,etal. Fractionation of aqueous cigarette tar extracts: fractions that contain the tar radical cause DNA damage[J]. Chem Res Toxicol,1998,11:441- 448.
[7] Zang LY, Stone K, Pryor WA. Detection of free radicals in aqueous extracts of cigarette tar by electron spin resonance[J]. Free Radic Biol Med,1995,19:161- 167.
[8] Orosz Z, Csiszar A, Labinskyy N,etal. Cigarette smoke-induced proinflammatory alterations in the endothelial phenotype: role of NAD(P)H oxidase activation[J]. Am J Physiol Heart Circ Physiol, 2007,292:130- 139.
[9] Ambrose JA, Barua RS. The pathophysiology of cigarette smoking and cardiovascular disease: an update[J]. J Am Coll Cardiol,2004,43:1731- 1737.
[10] Burke A, Fitzgerald GA. Oxidative stress and smoking-induced vascular injury[J]. Prog Cardiovasc Dis,2003,46:79- 90.
Heme oxygenase- 1 alleviates the oxidative damagecaused by serum of smoking rats on human umbilical vein endothelial cells
YANG Gen-huan1,WU Wei2, LI Yan-chuan2, NI Leng1, WANG Zhan-qi1, WANG Chao-nan1, LIU Chang-wei1*
(1.Dept. of Vascular Surgery, PUMC Hospital, CAMS amp; PUMC, Beijing 100730;2.State Key Laboratory of Medical Molecular Biology, CAMS amp; PUMC,Beijing 100005,China)
ObjectiveTo study whether heme oxygenase- 1(HO- 1) may alleviate the oxidative damage caused by serum of smoking rats on human umbilical vein endothelial cell(HUVEC).MethodsFifteen male sprague-dawley rats were randomized into control group,smoking group and smoking with Zincprotoporphyrin(ZnPP) group.Western blot was used to detect the expression of HO- 1 in carotid arteries of the rats.Also the expression of HO- 1was detected in HUVEC cultured in the serum of normal rats,smoking rats and smoking with ZnPP rats.The reactive oxygen species were detected in HO- 1-overexpressing and HO- 1-lowexpressing HUVEC,cultured in the serum of smoking rats.ResultsThe expression of HO- 1 in carotid arteries of smoking rats was significantly higher than that of normal rats(Plt;0.01).Both the serum of smoking rats and HO- 1depressed smoking rats induced the expression of HO- 1 in HUVEC,and the role of the latter was more significant(Plt;0.01).The reactive oxygen species of HUVEC cultured in the serum of smoking rats were more than that cultured in the serum of nornal rats(Plt;0.01),also the HO- 1 may release the oxidative damage(Plt;0.01).ConclusionsSmoking can cause the oxidative damage to HUVEC,and HO- 1 alleviates the damage.
smoking; heme oxygenase- 1; endothelial cell; oxidative damage
2014- 04- 25
2014- 05- 27
北京市自然科学基金(7122145)
*通信作者(correspondingauthor):liucw@vip.sina.com
1001-6325(2014)10-1358-05
Q 554
A

