NaCl胁迫对结球甘蓝幼苗生长及体内离子分布的影响
顾闽峰, 王乃顶, 王伟义, 费月跃, 彭亚明, 王 军, 王神云, 李建斌
(1.盐城市新洋农业试验站,江苏 盐城 224049;2.江苏省农业科学院蔬菜研究所,江苏 南京 210014)
中国的盐碱地面积约9.91×107hm2,占世界盐碱地面积的26.3%[1],其中江苏省盐碱地面积大,沿海滩涂资源丰富,是中国最大面积的沿海滩涂[2-3]。江苏省沿海滩涂盐碱地的开发利用是沿海开发战略的重要内容,在盐碱地上种植种类丰富的植物资源,生物治盐是改良滩涂盐碱地的主要途径之一[4]。因此,研究植物的耐盐特性,培育耐盐植物,利用耐盐植物开发滩涂盐碱地资源,是发展现代盐土农业的重要选择,也是加快推进江苏省沿海滩涂盐碱地开发利用的关键。
结球甘蓝(Brassica oleracea var.capitata)又称洋白菜、卷心菜,是十字花科芸薹属植物,是中国重要的蔬菜作物之一[5],有较丰富的钾元素、维生素C等营养物质,具有和胃、健脾、止痛、防衰老等功效[6-9]。目前国内外关于结球甘蓝的研究主要集中在栽培技术、成分分析和抗虫病害等方面,有关其在盐胁迫下的幼苗生长、生理特性、离子分布运输的报道较少[10-11]。本试验以结球甘蓝为材料,研究不同NaCl浓度处理对结球甘蓝幼苗的生长和体内离子吸收分配的影响,以期为筛选耐盐结球甘蓝品种提供依据。
1 材料与方法
1.1 材料的培养和处理
供试结球甘蓝种子采自南京农业大学江苏大丰“863”试验基地,试验于2013年12月初将经过低温沙藏并萌动露白的种子播种到装有蛭石的营养钵中。每盆播种1粒,置于温室中育苗。待幼苗生长至5片或6片叶龄,选取长势一致的幼苗定植到塑料容器中进行水培。当长至第8片叶子时,施以1/2 Hoagland营养液,盐胁迫前,对幼苗进行为期18 d的预培养,以使其适应水培条件,正常生长。试验设7 个 NaCl浓度:0 mmol/L(对照)、17 mmol/L、34 mmol/L、51 mmol/L、68 mmol/L、85 mmol/L和 102 mmol/L。每个浓度水平重复3次,每个重复12株,营养液每2 d更换一次。为避免对幼苗造成渗透休克,采取每2 d增加NaCl的方式递增NaCl浓度。试验期间,温室内昼夜温度保持在22~28℃,相对湿度70% ~80%,经过21 d的NaCl胁迫处理,收集植物样品用于分析。
1.2 鲜质量和干质量的测定
试验结束时,将结球甘蓝幼苗从塑料盆中取出,每个处理随机选取甘蓝幼苗12株,用去离子水冲去砂粒,然后迅速用吸水纸吸干,采集结球甘蓝幼苗的根、茎、叶,分别称其鲜质量,随后放在105℃下杀青30 min,放入烘箱进行烘干。温度为65~70℃,经检查样品烘干后,关掉烘箱,待温度降到室温后,分别测得各组分的生物量,并计算冠生物量(茎生物量+叶生物量)、全株总生物量(根生物量+冠生物量)、相对生物量(某处理的平均总生物量/对照的平均总生物量×100%)以及根冠比值(根生物量/冠生物量)。
1.3 无机离子含量的测定
在电子天平(精确至0.000 1 g)上用牛角勺称取待测样品0.1 g左右,将样品小心转移至干净且干燥的消煮管内,放在管架上。向消煮管内加入2 ml优级纯的浓HNO3,摇匀后,拧紧盖子,进行消煮。消煮完毕后,取出消煮管并放在管架上,冷却30 min。消煮液转移至50 ml洗净的容量瓶中,用高纯水清洗消煮管2次(少量多次)并转移入容量瓶中,再用高纯水洗小漏斗后再定容后摇匀。静置1 h以上后转移上清液至15 ml离心管内保存(可以先用定容液润洗离心管)。经微波消煮过的样品直接用电感耦合等离子体发射光谱仪ICP-OES(Inductively coupled plasma optical emission spectrometer,Optima 2100DV,Pekin-Elmer,USA)测定甘蓝幼苗根、茎、叶中 K+、Na+、Ca2+和 Mg2+含量,每次测定取3个重复,并计算各组中的 K+/Na+、Ca2+/Na+、和Mg2+/Na+值及无机离子累积量,无机离子累积量=离子浓度×质量。
1.4 数据处理
利用Microsoft Excel软件、SPSS 19软件进行试验数据的统计,采用Duncan’s新复极差法进行显著性分析。
2 结果与分析
2.1 NaCl胁迫对甘蓝幼苗生物量累积与分配的影响
经不同浓度NaCl胁迫后,根部生物量在17 mmol/L和34 mmol/L处理下均略高于对照的生物量,51 mmol/L、68 mmol/L、85 mmol/L和 102 mmol/L处理下的生物量均低于对照。所有NaCl胁迫处理的结球甘蓝幼苗的茎、叶以及全株总生物量均不同程度的低于对照(表1),且均随着NaCl胁迫浓度的升高结球甘蓝幼苗的茎、叶以及全株总生物量呈下降趋势,说明NaCl胁迫抑制了植株生物量的积累。植株的相对生物量随着NaCl浓度的升高而下降。7个NaCl胁迫处理间的根冠比无显著差异。
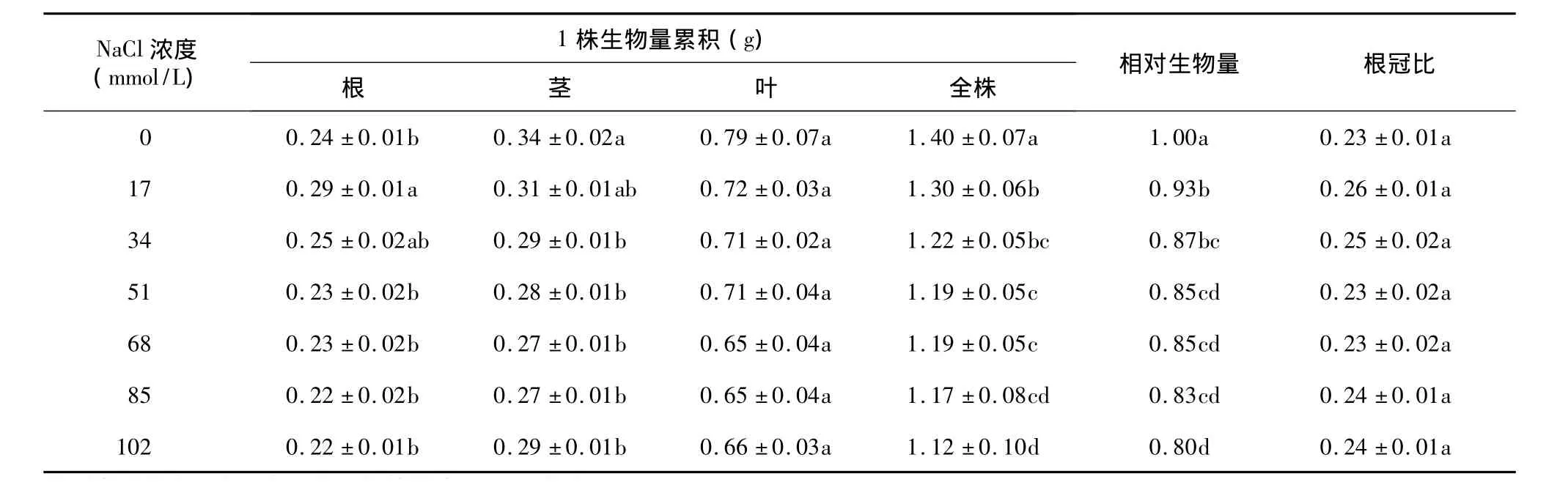
表1 不同浓度NaCl对结球甘蓝幼苗生物量累积和根冠比的影响Table 1 Effects of NaCl concentrations on biomass accumulation and root and shoot ratio of Brassica oleracea var.capitata seedlings
2.2 NaCl胁迫对结球甘蓝幼苗不同组织离子含量的影响
由图1A可以看出,随着NaCl浓度的增加,结球甘蓝幼苗体内各器官中的Na+含量均呈逐渐升高的趋势;不同NaCl浓度处理下,甘蓝幼苗各器官中的Na+含量分布均为:茎>叶>根。与对照相比,在17 mmol/L处理下,根、茎、叶中的Na+含量均显著增加,分别是对照植株的1.61、1.66和2.10倍。在102 mmol/L处理下,各器官中的Na+含量达到最大值,根、茎、叶中的Na+含量分别是对照植株的2.40、2.71和4.18倍。上述结果表明,当结球甘蓝幼苗受到NaCl胁迫时,Na+大量进入植物体中,并将大部分的Na+滞留在茎部,根部Na+积累少,从而减轻盐离子对根部的毒害。
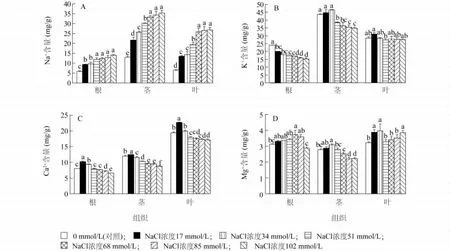
图1 不同浓度NaCl对甘蓝幼苗各组织K+、Na+、Ca2+和Mg2+含量的影响Fig.1 Effects of NaCl concentrations on K+,Na+,Ca2+and Mg2+contents in different tissues of B.oleracea var.capitata seedlings
由图1B可以看出,随着NaCl浓度的升高,结球甘蓝幼苗根中的K+含量呈逐渐下降的趋势,而K+含量在茎和叶中则呈先上升后下降的趋势。在17 mmol/L和34 mmol/L NaCl处理下,幼苗茎中K+含量均高于对照,而随着 NaCl浓度的增加,从51 mmol/L处理开始,茎中K+含量均显著低于对照。叶中K+含量只有17 mmol/L处理下高于对照,其余各处理下均低于于对照。不同NaCl浓度处理下,结球甘蓝幼苗各器官中的K+含量分布均为:茎>叶>根。
不同NaCl浓度处理下,结球甘蓝各组织Ca2+含量由大到小依次为:叶、茎、根(图1C)。随着NaCl浓度的升高,Ca2+含量在各组织中都是呈先升高后下降的趋势,在17 mmol/L处理下,根、茎、叶的Ca2+含量分别是对照的0.05、0.03和0.15倍;在34 mmol/L处理下,根和叶的Ca2+含量也高于对照;随着盐浓度的增加,从51 mmol/L处理开始,结球甘蓝幼苗各器官中的Ca2+含量均低于对照。
由图1D可以看出,在不同浓度NaCl胁迫下,结球甘蓝幼苗各组织中Mg2+含量最高的是叶,其次是根和茎。随着NaCl浓度的升高,根和茎中Mg2+含量均先升高然后下降,在17~85 mmol/L NaCl处理下,根部Mg2+含量均高于对照,在17~51 mmol/L NaCl处理下,结球甘蓝茎部Mg2+含量均高于对照。在17~34 mmol/L和102 mmol/L NaCl处理下,叶部Mg2+含量均显著高于对照,而51~85 mmol/L NaCl处理下,叶部Mg2+含量与对照差异不显著。
2.3 NaCl胁迫对结球甘蓝幼苗K+/Na+、Ca2+/Na+和Mg2+/Na+值的影响
由表2可以看出,不同浓度NaCl处理下,结球甘蓝幼苗各器官中的K+/Na+、Ca2+/Na+和Mg2+/Na+值均低于对照,且随着NaCl浓度的升高呈逐渐下降的趋势。在17 mmol/L处理下,结球甘蓝幼苗根、茎、叶的K+/Na+值,比对照分别下降了48%、38%和48%,Ca2+/Na+值分别下降了21%、37%和44%,Mg2+/Na+值分别下降了34%、38%和43%;在102 mmol/L处理下,K+/Na+、Ca2+/Na+和Mg2+/Na+值的降幅最大。在不同盐浓度处理下,甘蓝叶中Ca2+/Na+值高于根中相应比值,根中Ca2+/Na+值高于茎;Mg2+/Na+值在根中最高,其次是叶和茎。
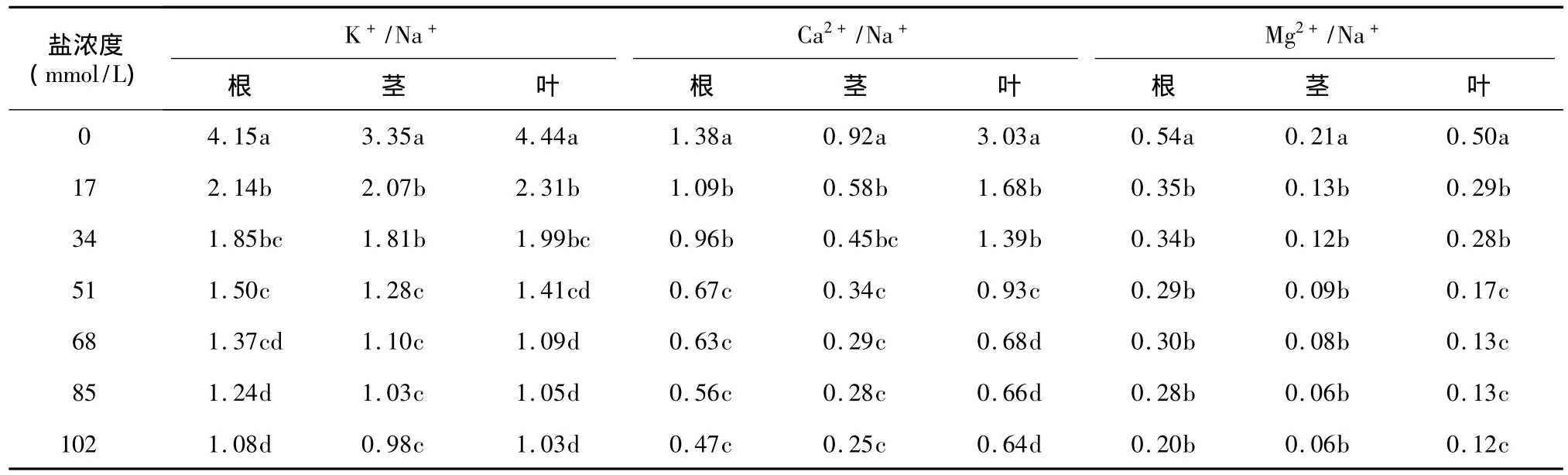
表2 NaCl胁迫对结球甘蓝幼苗K+/Na+、Ca2+/Na+和Mg2+/Na+值的影响Table 2 Effects of NaCl concentrations on K+/Na+,Ca2+/Na+and Mg2+/Na+of B.oleracea var.capitata seedlings
2.4 NaCl胁迫对结球甘蓝幼苗 K+、Na+、Ca2+和Mg2+离子积累的影响
由图2A可以看出,随着NaCl浓度的升高,结球甘蓝幼苗Na+累积量呈现逐渐升高的趋势。17 mmol/L、34 mmol/L、51 mmol/L和 68 mmol/L处理间,甘蓝幼苗对Na+的吸收分配存在显著性差异,4个处理下的整个植株的Na+累积量分别是对照的1.76、1.96、2.43 和 2.82 倍,而 68 mmol/L、85 mmol/L和102 mmol/L处理间差异性不显著。各处理茎中Na+含量在整个植株中所占的比例均最大,分别占52%、49%、52%、49%、47%、47%和46%,而叶占25%、30%、29%、32%、36%、36%和35%,根占23%、21%、20%、19%、17%、17%和18%。
由图2B可以看出,不同NaCl浓度处理下,结球甘蓝K+累积量均显著低于对照,分别是对照的74%、84%、74%、72%、68%和65%,且除17 mmol/L外,随着NaCl浓度的升高,结球甘蓝中的K+累积量逐渐下降。在不同NaCl浓度处理下,茎中的K+含量在整个植株中所占比例最大,其次是叶、根,其中34 mmol/L处理下,茎中K+含量所占比例最大。
由图2C可以看出,在不同NaCl浓度处理下,结球甘蓝幼苗Ca2+累积量均低于对照。且随着NaCl浓度的升高,在34 mmol/L至102 mmol/L处理下,幼苗体中的Ca2+累积量呈下降的趋势。17 mmol/L至102 mmol/L处理下,结球甘蓝体中Ca2+累积量分别是对照的86%、91%、78%、76%、72%和66%。
由图2D可以看出,对照Mg2+均高于NaCl处理,NaCl浓度最高时,Mg2+在植株中的累积量最低,是对照的79%。在51~102 mmol/L处理间,结球甘蓝幼苗的Mg2+累积量无显著差异。幼苗茎中Mg2+含量显著低于根和叶。
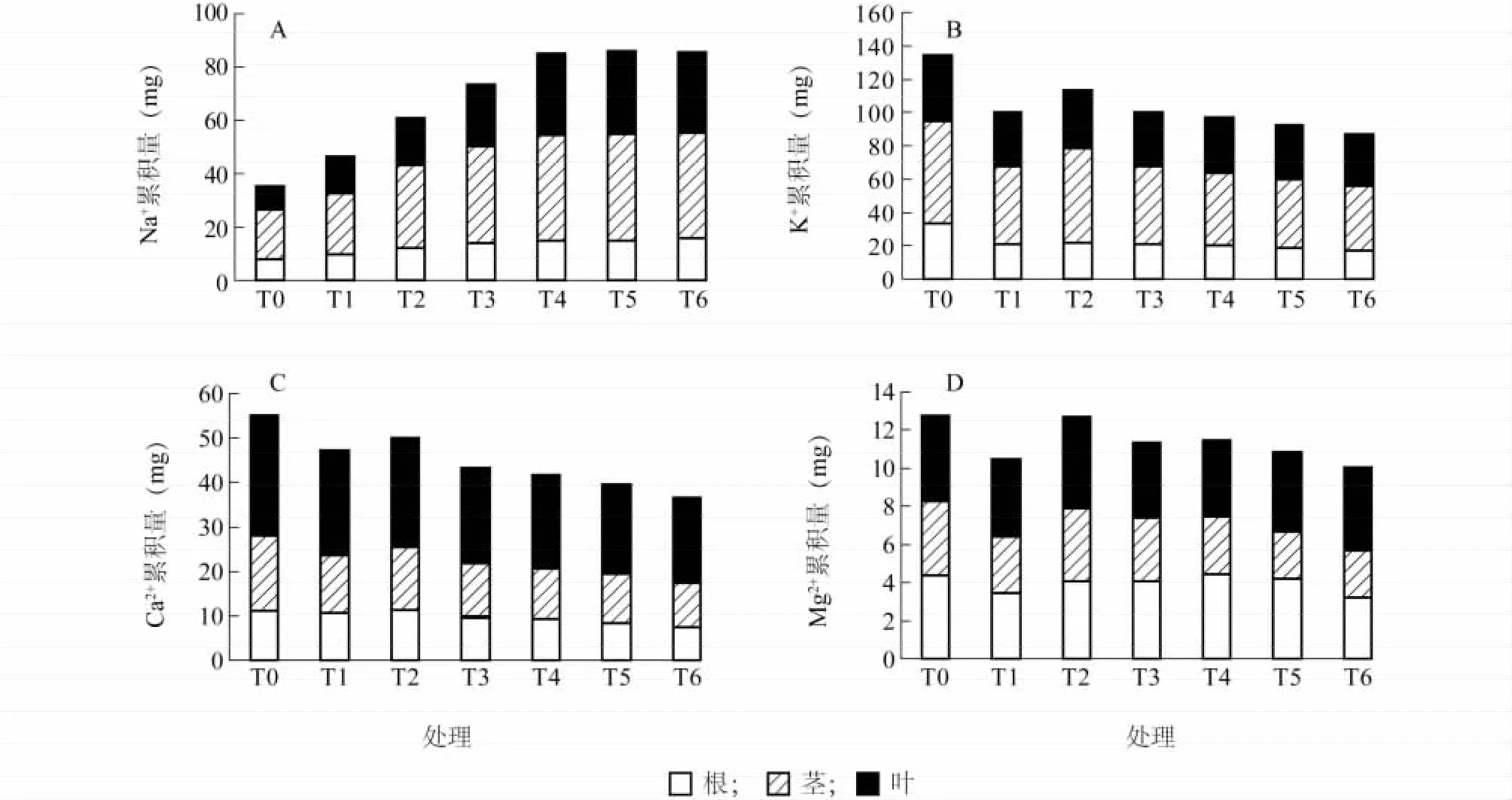
图2 NaCl胁迫对单株结球甘蓝幼苗K+、Na+、Ca2+和Mg2+积累的影响Fig.2 Effects of NaCl stress on K+,Na+,Ca2+and Mg2+accumulations in B.oleracea var.capitata seedlings
3 讨论
盐分通过多种胁迫方式对植物产生伤害,如渗透胁迫中土壤水势的降低会导致细胞脱水,造成植物体的生理性缺水;离子胁迫会造成对植物细胞膜的损伤,丧失对离子选择性吸收的功能,致使细胞内离子稳态失衡,影响植物生长发育[12-14],此外盐胁迫还可能引发氧化胁迫致使植物体内积累过多的活性氧,这些活性氧自由基会启动膜脂过氧化进程,从而产生氧化胁迫,改变细胞膜通透性,最终引起植物细胞死亡[15]。盐胁迫对植物生长发育最普遍和最显著的效应就是抑制植物的生长,降低植物的生物量[16-18]。本研究中随着 NaCl浓度的升高,根、茎、叶和整株的生物量呈下降的趋势。植物根冠的大小和功能在正常的条件下是保持平衡的,当植物受到某种资源限制时就会调节生物量分配来适应这种环境的变化,根冠比值是植物在逆境下生物量分配的一种策略,也是植物各器官对盐胁迫敏感程度的一种表达方式[19-20]。本研究结果显示,不同处理下甘蓝幼苗根冠比间差异不显著。说明在盐胁迫下甘蓝根系生长的敏感性要低于地上部分。
土壤中盐分过多就会造成植物的渗透胁迫,并影响营养离子的平衡,导致植物的生理过程发生改变,进而影响到植物的新陈代谢,限制植物生长和发育[21-22]。本研究结果表明:在一定NaCl胁迫下,甘蓝幼苗各器官中的Na+含量不断增加,且不同组织中的增加幅度不一致,这与谭会娟等[23]研究结果一致。随着NaCl胁迫浓度增加,结球甘蓝幼苗各器官中的Na+含量分布均为:茎>叶>根,这说明茎具有较强的贮盐能力,这可以减少Na+在叶片中的积累,对避免细胞受到离子胁迫和渗透胁迫,维持细胞正常的生理功能起到重要作用。K+是植物在生长发育中必须的大量元素和渗透调节物质,涉及许多生理过程,包括酶活性调节、蛋白质合成及渗透调节等,而且是唯一一种植物所必需的以相对高浓度存在的阳离子[24]。在本研究中,随着NaCl胁迫浓度的增加,根部K+含量呈逐渐下降,茎和叶中K+含量则先上升后下降,且结球甘蓝幼苗各器官中的K+含量分布均为:茎>叶>根,这可能是因为Na+和K+离子半径和水合能相似,Na+对K+的吸收往往呈现出明显的竞争性抑制作用[25],所以Na+往往利用K+的途径进入植物体中,从而使Na+和K+之间相互竞争,造成结球甘蓝根中K+含量下降,叶和茎中K+含量先升后降。Ca2+对于保持植物细胞膜结构完整性和功能稳定性具有重要的作用[26]。本研究发现,在低浓度NaCl处理下,各个器官中Ca2+含量弱微增加,而后随着盐浓度的升高开始下降,且各个器官中的下降趋势不一致(图1C)。Mg2+在作物耐盐性中的报道较少,镁也是植物生长必不可少的营养元素[27],本试验结果表明,NaCl胁迫后,叶片中的Mg2+含量高于根和茎,从而有利于增强植株对盐胁迫的抵御能力。
K+、Ca2+和Mg2+在植物的生长过程中具有重要的生理功能,Na+在植物气孔调节、C4和CAM植物磷酸烯醇式丙酮酸的催化再生、盐生植物的渗透调节等生理活动中发挥着重要的作用。这些离子只有在保持相对平衡的状态下才能发挥正常的生理作用,当它们之间的平衡被打破,将对生理作用产生不良的影响[28]。本研究结果表明,结球甘蓝幼苗各器官中的 K+/Na+、Ca2+/Na+和 Mg2+/Na+值均低于对照,且随着NaCl浓度的升高呈逐渐下降的趋势,主要是由于结球甘蓝幼苗积累的Na+含量不断增加,而其他离子含量有所减少造成的。
植物的不同器官具有积累不同离子的作用,在NaCl胁迫下,茎部对Na+的累积最高,其次是K+,而叶中则主要积累Ca2+和Mg2+,这与王冉等对黑籽南瓜幼苗受NaCl胁迫后的离子分布大体一致[29],说明结球甘蓝幼苗主要将Na+积累在茎部,从而减轻Na+对根部和叶部的盐害,而叶片中积累较多的Ca2+和Mg2+有利于甘蓝幼苗的生长发育。
[1] 贾敬敦,张 富.依靠科技创新推进我国盐碱地资源可持续利用[J].中国农业科技导报,2014,16(5):1-7.
[2] 陈建平.江苏省沿海地区发展盐碱地植棉战略思考[J].中国棉花,2014,41(4):14-15.
[3] 张培通,郭文琦,李春宏.枸杞在江苏沿海滩涂盐碱地的应用前景及实用栽培技术[J].江苏农业科学,2014,42(3):197-199.
[4] 刘正祥,张华新,杨 升,等.NaCl胁迫对沙枣幼苗生长和光合特性的影响[J].林业科学,2014,50(1):32-40.
[5] 黄小云,陶 鹏,王五宏,等.结球甘蓝离体叶片不定芽的再生研究[J].浙江农业科学,2014(1):34-38.
[6] 董 辉,顾爱侠,轩淑欣,等.大白菜—结球甘蓝单体异附加系AC3营养成分分析及评价[J].营养学报,2014,36(4):401-402.
[7] 王肖红,曾爱松,高 兵,等.结球甘蓝不定芽诱导及遗传转化的影响因子[J].江苏农业学报,2013,29(4):918-920.
[8] 刘俊波,范凤翠,李志宏,等.不同根土空间对结球甘蓝生长贡献率的影响[J].江苏农业科学,2014,42(10):147-149.
[9] 吴国平,王建华,王丽娟,等.幼苗春化特性对结球甘蓝开花及繁种的影响[J].江苏农业科学,2013,41(6):121-122.
[10] VERMA R,MAURYA B R,MEENA V S.Integrated effect of bio-organics with chemical fertilizer on growth,yield and quality of cabbage(Brassica oleracea var.capitata)[J].Indian Journal of Agricultural Sciences,2014,84(8):914-919.
[11] CHOI S H,PARK S,LIM Y P,et al.Metabolite profiles of glucosinolates in cabbage varieties(Brassica oleracea var.capitata)by season,color,and tissue position[J].Horticulture,Environment,and Biotechnology,2014,55(3):237-247.
[12]夏尚光,张金池,梁淑英.NaCl胁迫对3种榆树幼苗生理特性的影响[J].河北农业大学学报,2008,31(2):52-56.
[13]尤 佳.盐胁迫对盐生植物黄花补血草幼苗生理生化特性的影响[D].兰州:西北师范大学,2012.
[14]王家源.苦楝种苗耐盐胁迫的生理响应机制研究[D].南京:南京林业大学,2013.
[15]孟繁昊,王 聪,徐寿军.盐胁迫对植物的影响及植物耐盐机理研究进展[J].内蒙古民族大学学报:自然科学版,2014,29(3):315-318.
[16]王宝山.逆境植物生物学[M].北京:高等教育出版社,2010:209-215.
[17]谢英赞,何 平,王朝英,等.外源 Ca2+、SA、NO对盐胁迫下决明幼苗生理特性的影响[J].西南大学学报:自然科学版,2013,35(3):36-43.
[18] PARIDA A K,DAS A B,MITTRA B.Effects of salt on growth,ion accumulation,photosynthesis and leaf anatomy of the mangrove,Bruguiera parviflora [J].Trees,2004,18(2):167-174.
[19] BERNSTEIN N,MEIRI A,ZILBERSTAINE M.Root growth of avocado is more sensitive to salinity than shoot growth[J].Journal of the American Society for Horticultural Science,2004,129(2):188-192.
[20]王树凤,胡韵雪,孙海菁,等.盐胁迫对2种栎树苗期生长和根系生长发育的影响[J].生态学报,2014,34(4):1021-1029.
[21]谭会娟,李新荣,赵 昕.红砂愈伤组织适应盐胁迫的渗透调节机制研究[J]. 中国沙漠,2011,31(5):1119-1123.
[22]张丽丽,张 战,赵一洲,等.NaCl胁迫对水稻苗期生长及离子吸收和转运的影响[J].北方水稻,2014,44(3):10-13.
[23]谭会娟,贾荣亮,刘玉冰,等.NaCl胁迫下红砂愈伤组织中主要离子累积特征的研究[J].中国沙漠,2010,30(6):1305-1310.
[24]王树凤,胡韵雪,李志兰,等.盐胁迫对弗吉尼亚栎生长及矿质离子吸收、运输和分配的影响[J].生态学报,2010,30(17):4609-4616.
[25] WEI W,BILSBORROW P E,HOOLEY P,et al.Salinity induced differences in growth,ion distribution and partitioning in barley between the cultivar Maythorpe and its derived mutant golden promise[J].Plant and Soil,2003,250(2):183-191.
[26]杨立飞,朱月林,胡春梅,等.NaCl胁迫对营养液栽培嫁接黄瓜生物量及离子分布的影响[J].西北植物学报,2007,26(12):2500-2505.
[27]刘正祥,张华新,杨秀艳,等.NaCl胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性[J].生态学报,2014,34(2):326-336.
[28]周俊国,朱月林,杨立飞,等.NaCl胁迫下中国南瓜杂交种和黑籽南瓜植株离子吸收与积累特性研究[J].植物营养与肥料学报,2008,14(3):546-551.
[29]王 冉,陈贵林,宋 炜,等.NaCl胁迫对两种南瓜幼苗离子含量的影响[J].植物生理与分子生物学学报,2006,32(1):94-98.

