产木聚糖酶海洋微生物的筛选与诱变育种
黄小云,林娟,林小洪,王国增,叶秀云
(福州大学生物科学与工程学院,福建省海洋酶工程重点实验室,福建福州 350116)
0 引言
木聚糖是植物细胞壁半纤维素的主要成分,包括由β-1,4糖苷键形成主链结构和不同的侧链取代基,常见的取代基包括4-O-甲基葡萄糖醛酸(4-O-Met-Hylglucuronic)、α-阿拉伯糖(α-arabinofuranose)及O-乙酰基(O-Acetyl group)等[1].木聚糖的完全降解需要多种水解酶的协同作用[2].木聚糖酶(EC 3.2.1.8)通过随机切割木聚糖主链骨架上的β-1,4糖苷键产生不同长度的低聚木糖[3],是木聚糖降解酶系中最为关键的酶.
木聚糖酶的来源较广泛,包括陆地植物组织、细菌、真菌和原生动物等[3],但大部分来源于陆地,对于海洋微生物的研究还比较少.海洋微生物所产的酶具有突出的特点和优势:具有显著的耐压、耐碱、耐盐、耐冷和多物种等特性,这些优越的性质使得海洋酶资源在工业应用和基础研究等方面具有价值,从而赋予海洋微生物酶独特的应用前景[4].木聚糖酶可作为食品添加剂用于改善焙烤食品的风味[5],在饲料中添加木聚糖酶可提高动物的生产性能[6],用木聚糖酶对纸浆的预处理会大大减少化学漂白剂的用量[7].由于其在各领域的重要作用,选育高产木聚糖酶的菌株成为目前木聚糖降解菌选育研究的热点.
1 材料与方法
1.1 样品
样品分别来自北极泥样,福州市平潭海域的水样和泥样,宁德市三都澳海域的泥样和海藻,以及鲍鱼内脏等.
1.2 培养基
1)初筛培养基:自制甘蔗渣木聚糖15 g,NH4NO35 g,K2HPO42 g,MgSO4·7H2O 0.5 g,琼脂20 g,人工海水[8]1 000 mL,pH 7.0;
2)种子培养基:3 g牛肉膏,10 g蛋白胨,5 g NaCl,人工海水1 000 mL,pH 7.0;3)基础产酶培养基:20 g麸皮,10 g酵母膏,人工海水1 000 mL,pH 7.0.
1.3 主要仪器设备
超净工作台(SW-CJ-2FD型,上海博迅实业有限公司医疗设备厂);生化培养箱(MJX-250S型,宁波海曙赛福实验仪器厂);恒温气浴摇床(DHZ-DA型,太仓市实验设备厂);双光束分光光度计(U-2910型,日立有限公司);pH计(PHS-3C型,上海精密科学仪器有限公司).
1.4 实验方法
1.4.1 自制木聚糖
取粉碎过的甘蔗渣加入60 g·L-1NaOH溶液中,固液比为1∶15,100℃条件下浸泡2 h.过滤后的滤液用36% ~38%(质量分数)HCl调pH值至7.0,按滤液 ∶乙醇为1∶0.8的比例(体积分数),加入浓度为95%(体积分数)的工业酒精,所得棕褐色或棕黄色沉淀即为木聚糖.4 000 r·min-1下离心10 min得沉淀,置于75℃条件下烘干后研磨至粉末状即可使用[9].
1.4.2 样品处理及木聚糖酶产生菌的筛选
称取1.1所示的几份样品(海藻和鲍鱼内脏先用无菌搅拌器研磨)于无菌生理盐水中进行梯度稀释.将10-1、10-6、10-7和10-8这4个梯度的样品悬液分别涂布于木聚糖酶筛选平板,将纯化后的单菌落点种于初筛培养基上,测定透明圈直径(H)和菌落直径(C)的大小,计算HC值.将初筛获得的菌株在平板上活化后,转接至种子培养基中,30℃、200 r·min-1培养12 h,取种子液以10%(体积分数)的接种量接入基础产酶培养基中,30℃、200 r·min-1培养72 h,发酵液离心后取上清进行酶活测定.
1.4.3 木聚糖酶活力测定
1.4.3.1 木糖标准曲线绘制
配制1.5 μmol·mL-1木糖标准溶液,分别量取 0、0.20、0.25、0.30、0.35、0.40、0.45、0.50、0.60 mL木糖标准溶液,用pH6.0的柠檬酸-磷酸氢二钠缓冲液补至1 mL,再加入1 mL DNS,沸水浴10 min,冷却至室温后在540 nm测定OD值,绘制木糖标准曲线.
1.4.3.2 木聚糖酶活力测定
取0.9 mL含1%(质量分数)木聚糖的底物,加入0.1 mL适当稀释的酶液,55℃准确反应10 min后加入1 mL DNS溶液终止反应,煮沸10 min显色,冷却至室温后于540 nm测定OD值.一个酶活力单位(U)定义为每min释放1μmol还原糖所需的酶量.
1.4.4 形态学观察及16S rDNA序列分析
依据《伯杰细菌鉴定手册》进行菌落特征和细胞形态的鉴定[10].菌株的分子鉴定以16SrDNA作为指标.以基因组为模板,选用细菌通用引物27F(AGAGTTTGATCMTGGCTCAG)和1492R(TACGGYTACCTTGTTACGACTT)进行16SrDNA扩增,扩增条件为:94℃ 5 min,94℃ 30 s,48℃ 30 s,72℃ 2 min,30个循环;72℃ 10 min.
1.4.5 紫外及微波诱变
吸取5 mL菌悬液(浓度为(107~108)cfu·mL-1)于装有转子的无菌培养皿内,紫外诱变是将菌悬液经紫外灯(15 W,照射距离30 cm)照射30、60、90、120、150、180、210 s,微波诱变则是将菌悬液在微波炉最小功率下分别辐照0、1、2、3、4、5、6、7 min.对菌悬液进行梯度稀释,分别取10-5、10-6、10-7三个稀释度涂布于筛选平板,以未诱变的菌悬液作为对照.将上述所有平板(紫外诱变的平板需避光培养)在30℃恒温箱中培养48 h后取出计算平板上的菌落数,绘制致死率曲线.致死率计算公式如下:
致死率(%)=(1-诱变后的菌落数/对照组的菌落数)×100%.
1.4.6 遗传稳定性实验
将筛选到的木聚糖酶活力提高较多的正突变菌株,连续传代5代以上,并通过摇瓶发酵测定其产酶能力,选择产酶能力较高且稳定遗传的木聚糖酶正突变株进行后续的实验.
2 结果与讨论
2.1 平板初筛结果
从采集的各样品中分离到能降解木聚糖底物产生透明圈且菌落形态和细胞形态有差异的菌株60株(见表1),其中菌株编号为B459~B663的来自福州平潭海域的水样和泥样;菌株编号为Y的来自鲍鱼内脏;菌株编号为Z的来自宁德三都澳海域的海藻;菌株编号为M和N的来自宁德三都澳海域的泥样;菌株编号为MOR、BOB和BBO的是来自北极的泥样.
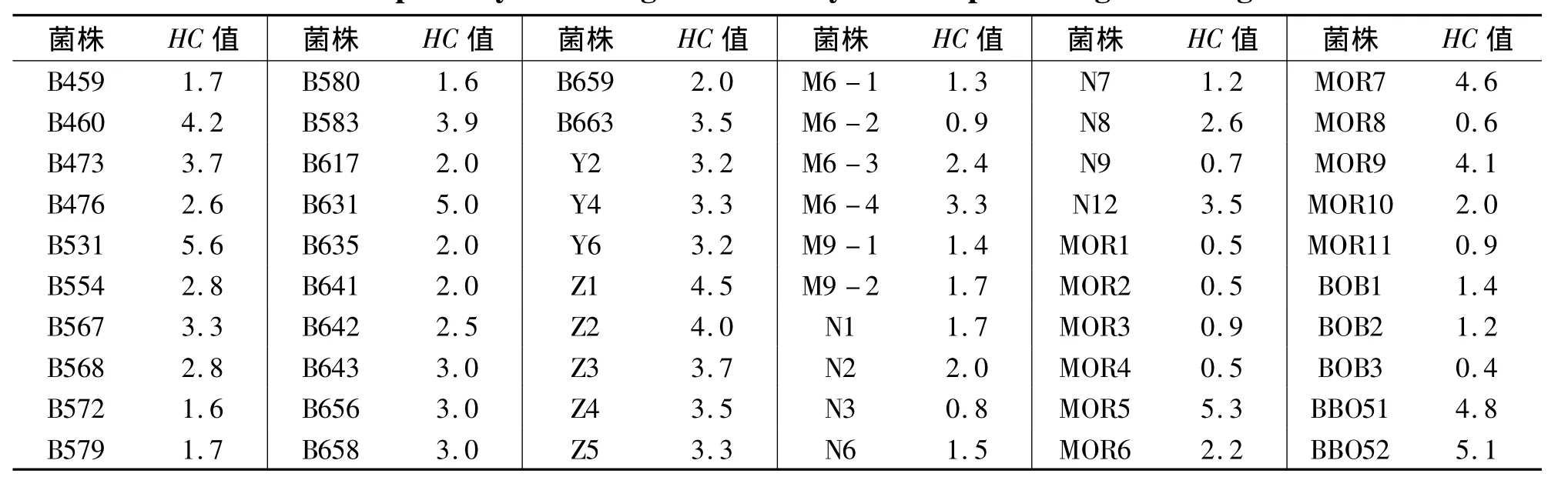
表1 产木聚糖酶微生物的初筛结果Tab.1 The primary screening results of xylanase-producing microorganisms
2.2 发酵复筛结果
对初筛得到的60株菌进行摇瓶发酵测定木聚糖酶活力,结果显示,有22株菌不具有产木聚糖酶的能力,38株菌能产木聚糖酶(见表2).
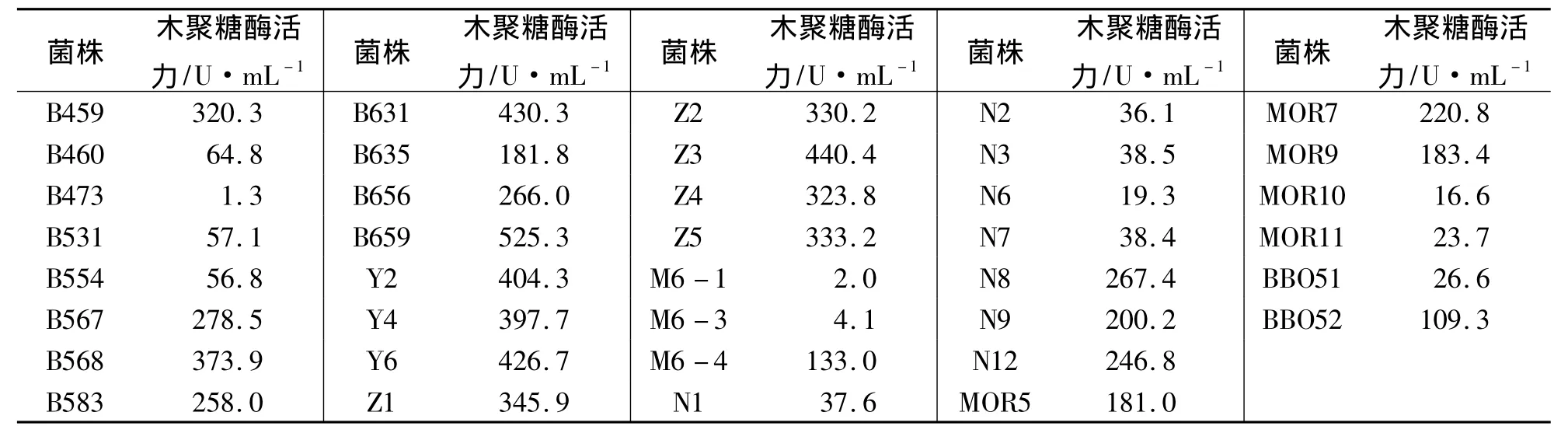
表2 产木聚糖酶微生物的复筛结果Tab.2 The secondary screening results of xylanase-producing microorganisms
产酶能力在0~100 U·mL-1的有14株菌,100~200 U·mL-1的有5株菌;200~300 U·mL-1的有7株菌;大于300 U·mL-1的有12株菌,其中B659菌株的木聚糖酶活力最高,达到525.3 U·mL-1.
2.3 木聚糖酶的酶学性质初步研究
选取酶活力相对较高的6株菌(B250、B631、B659、Y6、Z3和MOR7),对其所产的木聚糖酶进行酶学性质的初步研究,包括最适反应pH值和最适反应温度.实验结果见图1.由图1可知,这6株菌所产的木聚糖酶的最适反应pH值均为6.0,最适反应温度也很相近,分别是55℃和60℃;而且酶的pH值和温度作用范围也都相差不大.因此,选择产酶能力最高的B659菌株作为下一步研究的实验菌株.
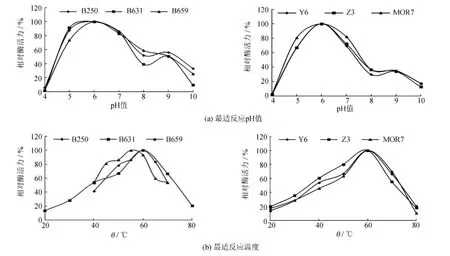
图1 反应pH值和温度对木聚糖酶活力的影响Fig.1 Effect of pH and temperature on xylanase activity
2.4 菌株B659的形态鉴定及16S r DNA鉴定结果
B659菌株在筛选培养基平板上30℃培养48 h,菌落呈乳白色,小而突起,表面湿润皱褶,边缘圆整(图2(a)).显微镜下观察,细胞呈短杆状,随机分散不成链状,细胞中有椭圆形芽孢,位置中生(图2(b)).经形态观察初步鉴定B659菌株为芽胞杆菌属.
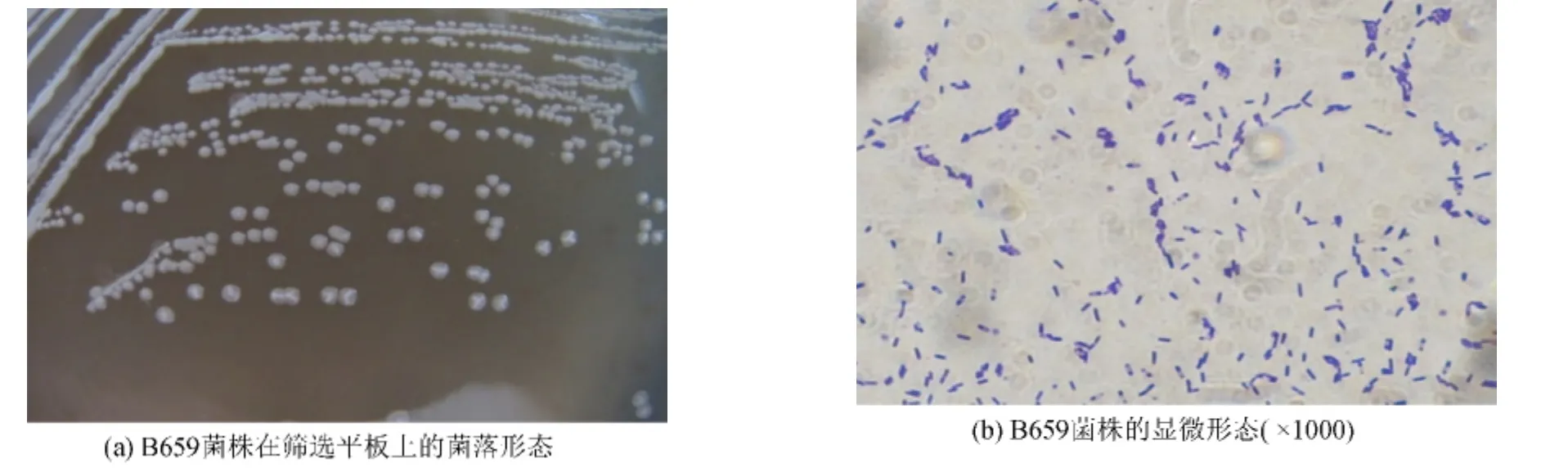
图2 B659菌株的形态观察Fig.2 The morphology of strain B659
基于BLAST分析,菌株B659的部分16S rDNA(1 510 bp)与Bacillus stratosphericus strain MCCC 1A08157(序列号:JX680139)的16SrDNA一致性为99%,构建其系统发育树(见图3),发现与同温层芽胞杆菌(Bacillus stratosphericus)、嗜气芽胞杆菌(Bacillus aerophilus)、短小芽胞杆菌(Bacillus pumilus)和沙福芽胞杆菌(Bacillus safensis)的亲缘关系最近,因此鉴定B659菌株属于Bacillus属.

图3 B659菌株的系统发育树Fig.3 The phylogenetic tree of strain B659
2.5 菌株B659的诱变育种
2.5.1 紫外诱变
2.5.1.1 诱变剂量的选择
绘制B659菌株的生长曲线.由图4可知,菌株B659在10~14 h时处于对数生长期的中期,此时细胞数量多且生长速率恒定、细胞各成分平衡增长、整个菌群的生理特性比较一致[11],因此选择培养12 h的B659菌株制备菌悬液进行诱变.
不同照射剂量所对应的致死率如图5所示.当照射时间为150 s时,致死率达到了79.4%;照射时间为180 s时,致死率达到94.1%;210 s时,致死率达到了100%.致死率在70% ~80%时有利于正突变的产生[12],故实验选用150 s作为照射剂量对菌株进行紫外诱变处理.
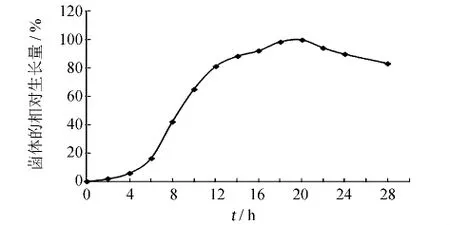
图4 B659菌株的生长曲线Fig.4 The growth curve of strain B659
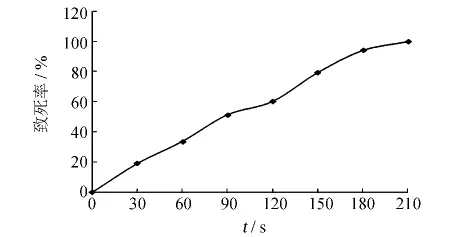
图5 B659菌株的紫外诱变曲线Fig.5 The UV mutation curves of strain B659
2.5.1.2 正突变菌株的筛选
出发菌株B659在150 s的照射剂量下,经过2轮紫外诱变在初筛平板上共得到了236株菌,挑选118株菌通过摇瓶发酵测定其酶活力.结果表明,118株突变菌株中有5株菌的产木聚糖酶能力高于出发菌株,详见表3.
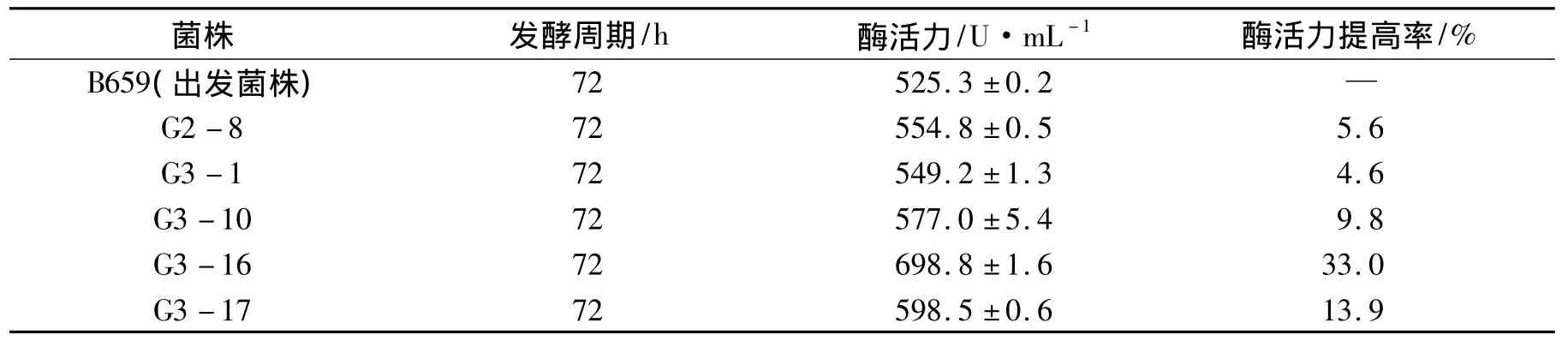
表3 出发菌株与突变菌株的木聚糖酶活力比较Tab.3 The comparison of xylanase activity between the original and the mutant strain
其中G3-16菌株的产酶能力最高,可达到698.8 U·mL-1,比出发菌株B659提高33.0%;其次是G3-17和G3-10菌株,其产酶能力分别是598.5 U·mL-1和577.0 U·mL-1,较出发菌株分别提高了13.9%和 9.8%.
2.5.1.3 突变菌株的遗传稳定性
将酶活提高相对较多的突变菌株G3-10、G3-16和G3-17进行5次传代培养,取第1代、第3代和第5代的菌株于产酶培养基中进行摇瓶发酵,72 h后取样测定各菌株的酶活力,结果如表4所示.由表可知,G3-16菌株虽然诱变后酶活力提高最多,但很不稳定,到第3代时酶活力大幅度下降,甚至低于出发菌株;G3-10菌株和G3-17菌株具有较好的遗传稳定性,而G3-17菌株的产酶能力高于G3-10菌株,因此最后确定G3-17菌株作为下一轮诱变的出发菌株.
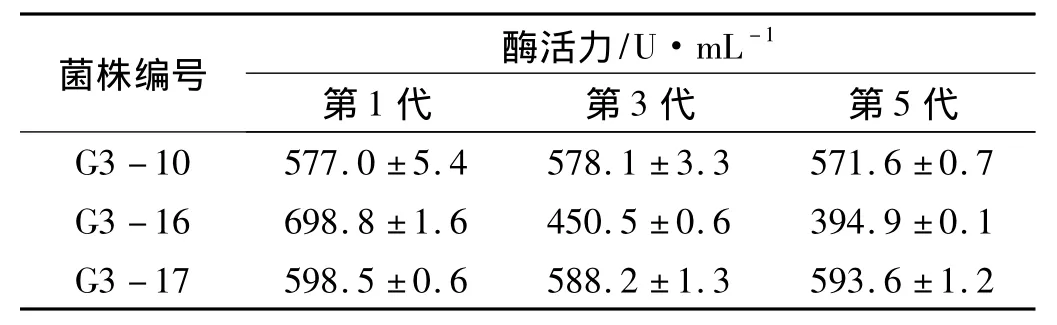
表4 突变菌株的遗传稳定性Tab.4 Genetic stability of mutant strain
2.5.2 微波诱变
2.5.2.1 诱变剂量的选择
本轮诱变以紫外诱变所得突变菌株G3-17作为出发菌株,对其进行微波诱变,不同剂量所对应的致死率曲线如图6所示.由图6可知,出发菌株G3-17的致死率随着诱变时间的延长而增加.在辐射时间为4 min时,致死率达到83.2%;辐射时间为5 min时,致死率达到90.1%;辐射6 min以后,致死率达到100%.本实验选用4 min作为辐射剂量对G3-17菌株进行微波诱变处理.
2.5.2.2 出发菌株与正突变菌株的酶活力比较
出发菌株G3-17在4 min的辐射剂量下,经过2轮的微波辐射后在初筛平板上共得到了183株菌,挑选92株突变菌株全部进行摇瓶发酵测定其产酶能力.结果表明,92株突变菌株中有6株菌的产木聚糖酶能力高于出发菌株G3-17,见表5.其中W1-40菌株的产酶能力最高,可达到662.8 U·mL-1,比出发菌株G3-17提高了11.6%;W1-28和 W1-41次之,分别达到了654.3 U·mL-1和646.8 U·mL-1,其余3株菌酶活提高幅度较小.
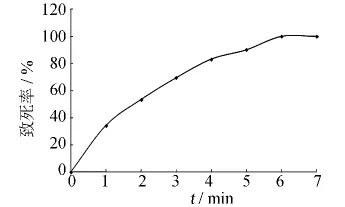
图6 微波诱变的致死率曲线Fig.6 The lethality rate of microwave mutagenesis
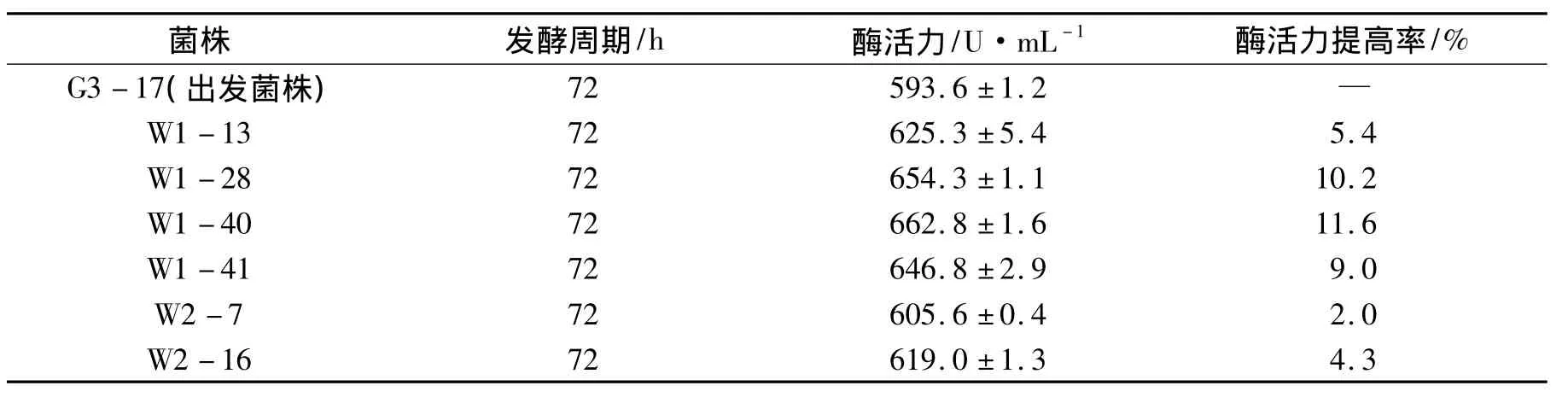
表5 出发菌株与突变菌株的木聚糖酶活力比较Tab.5 The comparison of xylanase activity between the original and the mutant strain
2.5.2.3 突变菌株遗传稳定性分析
将酶活提高相对较多的突变菌株W1-13、W1-28、W1-40和W1-41进行5次传代培养,结果如表6所示.
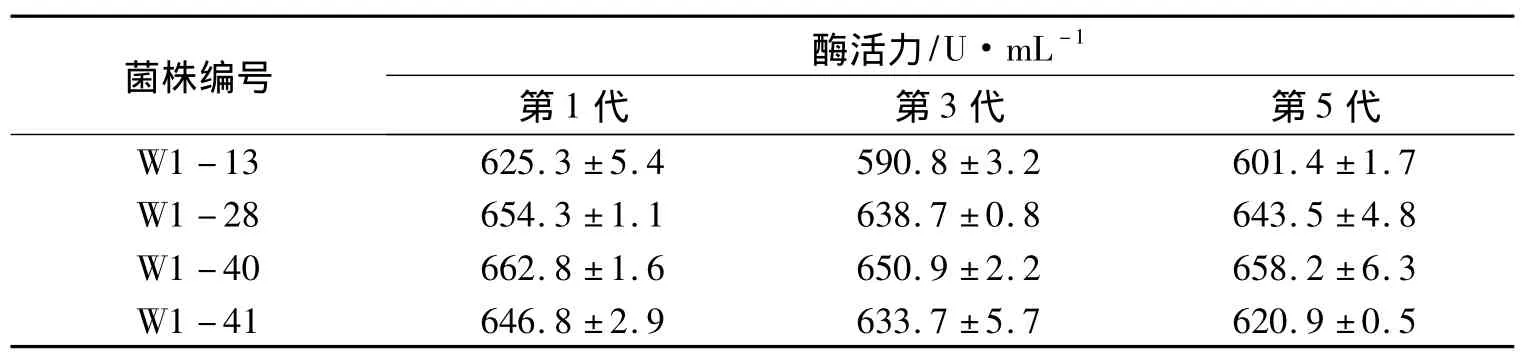
表6 遗传稳定性的测定Tab.6 Genetic stability of mutant strain
这4株菌中W1-13遗传不稳定,其它3株都具有较好的遗传稳定性.其中W1-40的产酶能力最高,达到658.2 U·mL-1,且遗传稳定性良好,因此确定W1-40菌株作为后续实验的研究对象.
2.5.3 原始菌株和突变菌株的产酶曲线比较
把原始菌株B659和突变菌株W1-40分别接入产酶培养基进行发酵试验,每隔12 h取样测定酶活,比较2株菌的产酶变化,绘制产酶进程曲线.由图7可知,B659菌株和W1-40菌株的酶活都是随着发酵时间的延长而上升,在12~36 h时上升最快,72 h时产酶量达到最高(B659菌株和W1-40菌株分别为517.9和645.2 U·mL-1);72 h之后可能由于木聚糖酶失活速率高于产酶速率,酶活力开始下降.
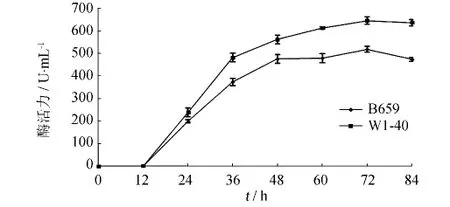
图7 B659菌株和W1-40菌株的产酶曲线Fig.7 Effect of incubation time on xylanase production by strain B659 and strain W1-40
3 结论
采用透明圈法从多个海洋来源的样品中共筛到60株有透明圈的菌株,从中复筛得到38株具有产木聚糖酶能力的菌株,其中经鉴定为芽孢杆菌属的菌株B659产酶能力最高(酶活力为525.3 U·mL-1).对菌株B659进行紫外诱变得到遗传稳定且酶活提高13.9%的突变菌株G3-17,对突变菌株G3-17进行微波诱变得到遗传稳定且酶活较菌株G3-17提高11.6%的突变菌株W1-40.发酵72 h时,突变菌株W1 -40的酶活力(645.2 U·mL-1)比原始菌株 B659(酶活为517.9 U·mL-1)提高24.6%.
[1]Biely P.Microbial xylanolytic systems[J].Trends in Biotechnology,1985,3(11):286 -290.
[2]Beg Q K,Kapoor M,Mahajan L,et al.Microbial xylanases and their industrial applications:a review[J].Applied Microbiology and Biotechnology,2001,56(3/4):326-338.
[3]Collins T,Gerday C,Feller G.Xylanases,xylanase families and extremophilic xylanases[J].FEMS Microbiology Reviews,2005,29(1):3-23.
[4]侯运华.适冷海洋青霉纤维素酶和半纤维素酶的分子生物学研究[D].济南:山东大学,2006.
[5]Camacho N A,Aguilar O G.Production,purification,and characterization of a low -molecular-mass xylanase from Aspergillus sp.and its application in baking[J].Applied Biochemistry and Biotechnology,2003,104(3):159 -172.
[6]Wong K K,Tan L U,Saddler JN.Multiplicity of beta-1,4-xylanase in microorganisms:functions and applications[J].Microbiological Reviews,1988,52(3):305 -317.
[7]Bajpai P.Application of enzymes in the pulp and paper industry[J].Biotechnology Progress,1999,15(2):147 -157.
[8]Takai K,Sugai A,Itoh T,et al.Palaeococcus ferrophilus gen.nov.,sp.nov.,a barophilic,hyperthermophilic archaeon from a deep - sea hydrothermal vent chimney[J].International Journal of Systematic and Evolutionary Microbiology,2000,50(2):489-500.
[9]李秀婷,孙宝国,宋焕禄,等.玉米芯水不溶性木聚糖的碱法提取及酶解分析[J].中国食品学报,2010,5(10):171-176.
[10]R.E.布坎南,N.E.吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:729-758.
[11]周德庆.微生物学教程[M].北京:高等教育出版社,2002:152-159.
[12]雷肇祖,钱志良,章健.工业菌种改良述评[J].工业微生物,2004,34(1):39-51.

