PPARα转基因小鼠在药物毒性评价中的应用
贺银丽,郭珣,赵显莉,裴彦宇,孙井江,高虹
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
过氧化物酶体增殖激活受体α(peroxisome proliferator-activated receptor-α,PPARα)是脂肪酸氧化酶基因的主要转录调控子,PPARα 激动剂临床上主要用于高甘油三酯血症的治疗。氯贝丁酯(clofibrate)属于贝特类药物,是PPARα 激动剂,通过调节脂肪β-氧化降低血脂[1],在临床上主要用于以甘油三酯增高为主的高脂血症,但因其毒副作用较大,现临床已淘汰此药物。本实验所使用的PPARα 转基因小鼠体内高表达人PPARα 基因,我们将其应用在PPARα 激动剂氯贝丁酯的毒理学评价中,期望能更加敏感的发现其毒性,为PPARα 激动剂类药物的临床前毒理学评价寻找更加快速、灵敏、准确的动物模型。
1 材料和方法
1.1 实验动物
清洁级8 周龄C57BL/6J 小鼠购自北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】。清洁级PPARα 转基因小鼠,由中国医学科学院医学实验动物研究所遗传中心构建【SCXK(京)2009-007】,遗传背景为C57BL/6J 小鼠,在本实验室繁育【SYXK(京)20130014】。
1.2 主要试剂及仪器
实验药品:氯贝丁酯(百灵威科技有限公司),羧甲基纤维素钠(广东汕头市西陇化工厂有限公司);主要仪器:日立7100 生化自动分析仪。
1.3 动物分组及给药方法
8 周龄PPARα 转基因小鼠(Tg)和C57BL/6J 野生小鼠(WT)各28 只,每组雌雄各半,体重18 ~22 g,分组及给药剂量见表1。溶媒对照为1%甲基纤维素钠,灌胃给药28d,每只动物灌胃体积为0.2 mL/10 g 体重。各组小鼠在同等的屏障环境中饲养,自由摄食、饮水,并按实验动物使用的3R 原则给予人道的关怀。
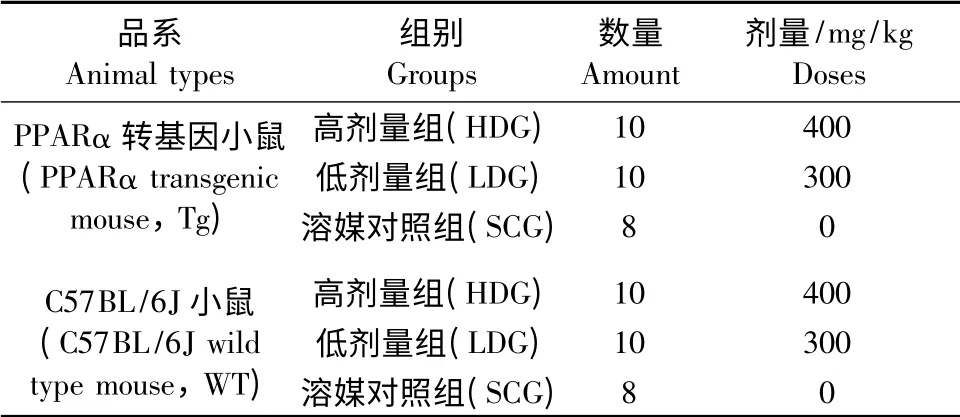
表1 实验小鼠分组及给药方法Tab.1 The medication method and grouping of laboratory mice
1.4 观察指标与方法
1.4.1 大体观察与体重测定
每天观察一次,观察指标包括小鼠外观和行为(包括小鼠的皮肤毛发,眼和黏膜的变化,呼吸,中枢神经系统,四肢活动及其他表现)、排泄物等。每周测定小鼠体重,计算每周的体重增长率。
1.4.2 血生化指标测定
末次给药禁食不禁水12 ~18 h 后,取全血0.3~0.4 mL,收集血清,在日立7100 生化自动分析仪上测定。主要测定肝功能和肾功能指标,包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素(UN)、总蛋白(TP)、白蛋白(ALB)、肌酐(CREA)、甘油三酯(TG)。
1.4.3 脏器系数测定与组织病理学检查
采血结束后脱颈椎处死动物,取动物心脏、肝脏、肾脏,脏器称重后以10%中性福尔马林固定,组织经修块,梯度酒精脱水,石蜡包埋,切片厚度5 μm,HE 染色,光镜下检查。脏器系数=脏器重量/动物体重 × 100%。
1.5 统计学分析
2 结果
2.1 一般体征观察
整个实验过程中动物眼睛与黏膜无异常分泌物,呼吸平稳,活动正常,无抽搐震颤等异常现象发生。给药组大便较稀,但仍成形。
2.2 体重变化
PPARα 转基因小鼠和C57BL/6J 小鼠在给药28d 后,Tg 组与WT 组比较,体重变化率差异无显著性(P >0.05)。但是Tg 雄性高剂量组在给药第3周、第4 周体重持续下降,而WT 雄性高剂量组体重在第3 周出现短暂下降后第4 周又增加(图1)。该结果提示Tg 雄性小鼠对氯贝丁酯毒性更加敏感。
2.3 血生化指标变化
参考本中心C57BL/6J 小鼠和PPARα 转基因小鼠背景数据[2],并与本实验溶媒对照组比较,有显著性差异的生化指标见表2。
从表2 可以看出,①各给药组肌酐(CREA)均显著高于对照组(P <0.01),②Tg 雄性高、低剂量组肌酐值高于WT 雄性高、剂量组(P <0.05)。对于天门冬氨酸氨基转移酶(AST),①Tg 雄性高、低剂量组AST 显著高于对照组(P <0.01,P <0.05);②Tg 雄性高、低剂量组AST 值显著高于WT 雄性高、剂量组(P <0.01,P <0.05)。Tg 雄性的肾脏损伤指标CREA、肝脏损伤指标AST 较WT 雄性升高更多,提示Tg 雄性小鼠肾脏损伤、肝脏损伤更严重。
2.4 脏器系数
①心脏系数:各给药组与对照组比,差异无显著性。②肝脏系数:Tg 和WT 各高、低剂量组均显著高于对照组(P <0.01,P <0.05)(图2A)。③肾脏系数:Tg 高、低剂量组均显著高于对照组(P <0.01,P <0.05);WT 高剂量组显著高于对照组(P <0.05)(图2B)。WT 低剂量组肾脏系数并没有显著性增加,提示WT 小鼠的肾脏损伤没有Tg 小鼠严重。
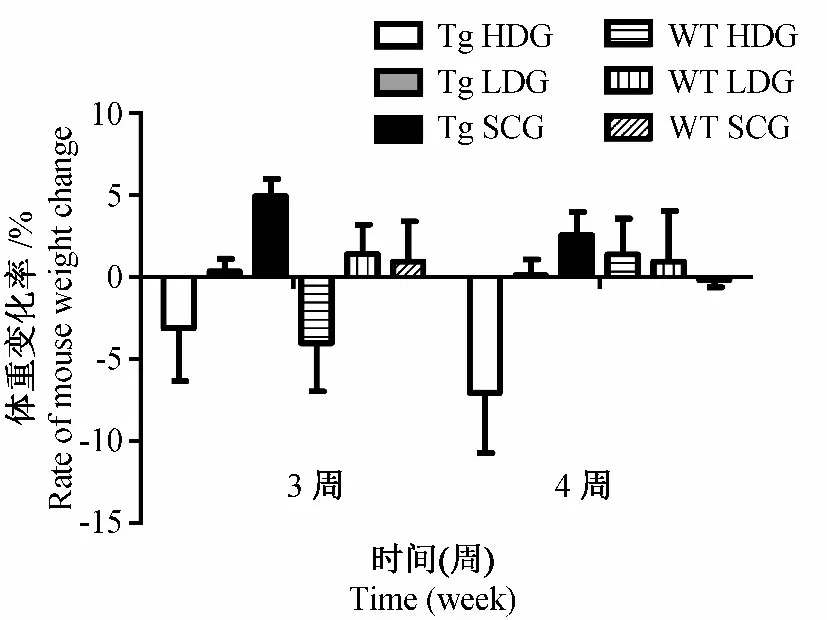
图1 给予氯贝丁酯后雄性小鼠体重变化率Fig.1 The change rate of mouse body weight after the clofibrate administration
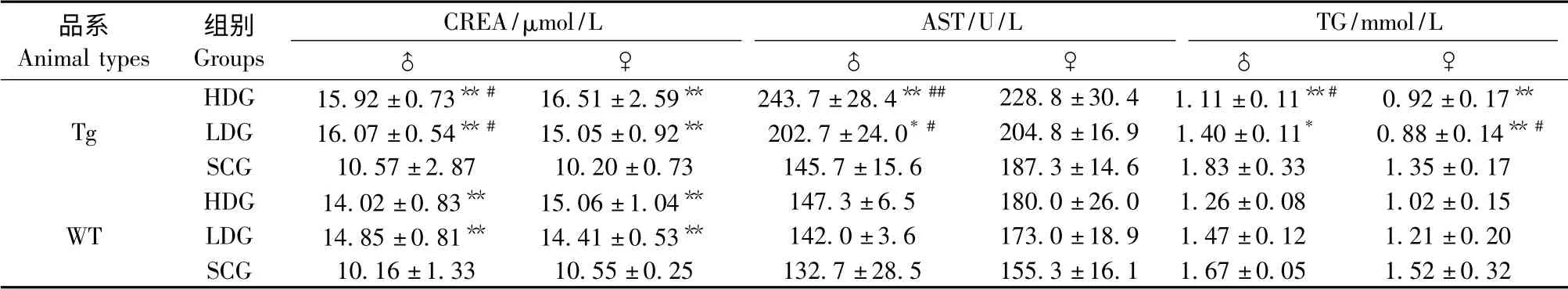
表2 给予氯贝丁酯后血生化指标变化Tab.2 Changes of serum biochemistry in the mice after clofibrate administration
2.5 病理组织学变化
Tg 高剂量组:50%发生肝细胞溶解坏死,伴有再生,100%发生肾小球上皮细胞空泡变性。Tg 低剂量组:50%发生肝细胞再生,50%发生肾小管上皮细胞脂肪变性、肾小管上皮细胞核固缩。WT 高剂量组:50%发生肾小球上皮细胞空泡变性,肝脏未见病变。WT 低剂量组:50%发生小灶性肝细胞坏死炎细胞浸润,50%发生肾小球上皮细胞空泡变性肾小管上皮细胞脂肪变性。Tg、WT 对照组各受检脏器未见明显病理改变。
从病理组织学结果可以看出氯贝丁酯对Tg 小鼠肝脏、肾脏的病理损伤程度比WT 小鼠更严重。
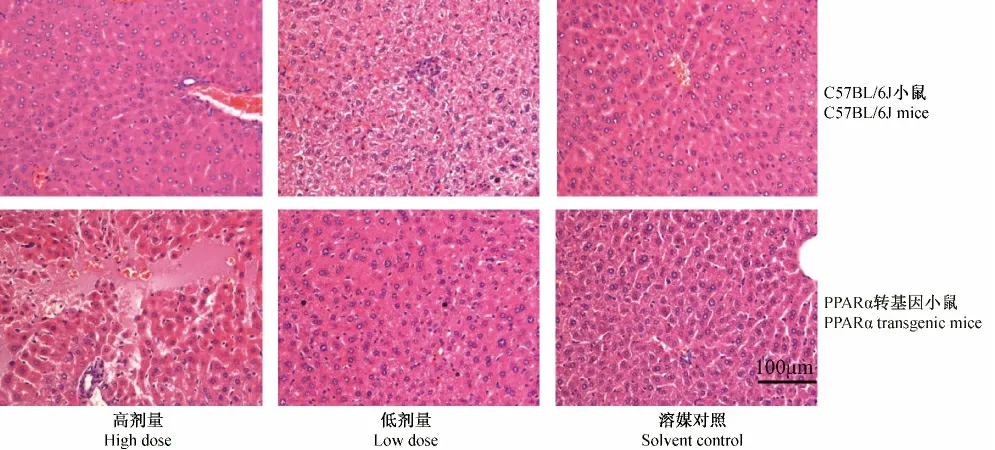
图3 给予氯贝丁酯后肝脏病理变化(HE 染色,标尺=100 μm)Fig.3 Histological changes of the liver after clofibrate administration.HE staining.Bar=100 μm
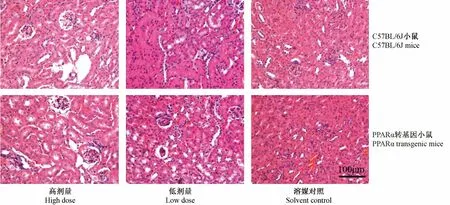
图4 给予氯贝丁酯后肾脏病理变化(HE 染色,标尺=100 μm)Fig.4 Histological changes of the kidney after clofibrate administration.HE staining.Bar=100 μm
3 讨论
过氧化物酶体增殖激活受体(peroxisome proliferator-activated receptors,PPARs)是核受体家族中的配体激活受体,PPARs 与配体结合激活后,与视黄醇类X 受体(RXR)形成异二聚体,形成的异二聚体与靶基因启动子上游结合,最终调节靶基因的转录[3]。PPARs 有三个不同 亚型,包括α、β、γ。PPARα 通过基因转录控制氧化物酶、线粒体的β-氧化途径、脂肪酸摄取和甘油三脂的分解,从而影响脂质代谢[4-7],主要分布在代谢活性较高的组织中,如肝、肾、心脏,是脂类代谢分子基础的研究热点[8]。
在新药研发过程尤其是临床试验阶段中,大量候选药物因为安全性问题被迫终止开发[9]。阿斯利康公司研发的PPAR-α/γ 双重激动剂Tesaslitazar在1 个II 期和4 个III 期临床试验后,终止了对Tesaslitazar 的研究,因为在III 期临床研究中发现该药使血中肌酐升高,存在肾毒性。转基因动物模型是基因组中含有外来遗传物质的动物,可建立敏感动物品系及人类相同疾病的动物模型[10],在药物安全评价中,与传统动物模型比较,具有敏感性高、结果真实可靠、外推行强、时间短、花费小等优势[11]。目前,PPARα 转基因小鼠在国内外有用于心肌病的研究[12],肝癌的发生机制的研究[13]等。本实验使用PPARα 转基因小鼠评价PPARα 激动剂氯贝丁酯的毒性,期望能更加敏感的发现其毒性。
CREA 是评价肾功能的重要生化指标,增高多见于肾功能不全、急慢性肾小球炎等,肾脏代谢废物的能力下降。给药结束后,Tg 雄性小鼠CREA 值显著高于WT 雄性小鼠,提示PPARα 转基因雄性小鼠对该药物产生的肾脏损伤更加敏感,与阿斯利康公司研发的PPAR-α/γ 双重激动剂Tesaslitazar 在临床试验中所产生的副作用一致。AST 是评价肝功能的重要生化指标,主要存在于肝细胞线粒体内,当肝脏发生严重坏死或破坏时,血清中浓度会偏高,增高常见于肝炎、脂肪肝、肝癌等疾病[14]。Tg 雄性小鼠AST 显著高于WT 雄性小鼠,提示PPARα 转基因雄性小鼠对该药物产生的肝脏损伤更加敏感。从表2中可以看出,Tg 雄性小鼠给药组AST 与对照组比较有升高,但未见显著性差异,可能是因为雌性小鼠的生理周期导致酶水平的变化,也可能是性激素影响药物代谢转化的结果[15]。此外,本实验结果中还发现Tg 给药组甘油三脂(TG)与Tg 对照组比有显著下降(P <0.01,P <0.05),而WT 组并没有显著下降,说明PPARα 转基因小鼠在评价PPARα 激动剂类药物的药效时,也是一个更加敏感的动物模型,与本课题组前期所做的药效学研究结果一致[16]。
脏器重量变化是药物毒性反应的敏感指标之一,从病理学角度,当脏器出现细胞肿胀、出血、积水、增生等病理变化时,该脏器的重量可能增加[17]。本实验中,各给药组肝脏系数、肾脏系数均有显著性增加,而心脏系数并没有显著性增加,与病理结果一致。根据本试验血生化、脏器系数和病理检测结果提示,PPARα 转基因小鼠与C57BL/6J 野生小鼠相比,在评价PPARα 激动剂毒性方面是一个新的、敏感的动物模型。
[1]Van Raalte DH,Li M,Pritchard PH,et al.Peroxisome proliferator-activated receptor (PPAR)-alpha:a pharmacological target with a promising future[J].Pharm Res,2004,21 (9):1531-1538.
[2]尉明晓,陈威,高洁,等.PPARα 转基因对小鼠的生理、生化等影响研究[J].中国比较医学杂志,2013,23 (05):5 -11,0,2.
[3]Bensinger SJ,Tontonoz P.Integration of metabolism and inflammation by lipid-activated nuclear receptors[J].Nature,2008,454(7203):470 -477.
[4]Kersten S,Desvergne B,Wahli W.Roles of PPARs in health and disease[J].Nature,2000,405 (6785):421 -424.
[5]Goto T,Takahashi N,Kato S,et al.Phytol directly activates peroxisome proliferator-activated receptor alpha (PPARalpha)and regulates gene expression involved in lipid metabolism in PPARalpha-expressing HepG2 hepatocytes [J].Biochem Biophys Res Commun,2005,337 (2):440 -445.
[6]Qiu L,Ye H,Chen L,et al.Red clover extract ameliorates dyslipidemia in streptozotocin-induced diabetic C57BL/6 mice by activating hepatic PPARalpha [J].Phytother Res,2012,26(6):860 -864.
[7]Zeng T,Zhang CL,Song FY,et al.Garlic oil alleviated ethanolinduced fat accumulation via modulation of SREBP-1,PPAR-alpha,and CYP2E1[J].Food Chem Toxicol,2012,50 (3 -4):485 -491.
[8]Everett L,Galli A and Crabb D.The role of hepatic peroxisome proliferator-activated receptors (PPARs)in health and disease[J].Liver,2000,20 (3):191 -199.
[9]Boverhof DR,Zacharewski TR.Toxicogenomics in risk assessment:applications and needs[J].Toxicol Sci,2006,89 (2):352 -360.
[10]Vijg J,van Steeg H.Transgenic assays for mutations and cancer:current status and future perspectives[J].Mutat Res,1998,400 (1 -2):337 -354.
[11]张峻,戴宇飞.转基因动物模型在毒理学中的应用[J].卫生研究,2012,41 (05):868 -873.
[12]Hopkins TA,Sugden MC,Holness MJ,et al.Control of cardiac pyruvate dehydrogenase activity in peroxisome proliferator-activated receptor-alpha transgenic mice[J].Am J Physiol Heart Circ Physiol,2003,285 (1):H270 -276.
[13]Yang Q,Nagano T,Shah Y,et al.The PPAR alpha-humanized mouse:a model to investigate species differences in liver toxicity mediated by PPAR alpha[J].Toxicol Sci,2008,101 (1):132 -139.
[14]Damsgaard T,Clausen N,West-Nielsen E,et al.Early diagnosis of acute myocardial infarction by means of aspartate aminotransferase,creatine kinase and creatine kinase isoenzyme MB[J].Dan Med Bull,1979,26 (6):298 -302.
[15]李兰芳,李国风,解丽君.大、小鼠口服腰痛宁胶囊的急性毒性研究[J].实验动物科学与管理,2004,(04):12 -15.
[16]魏明晓,秦超,陈威,等.PPARα 转基因小鼠在药物评价中的应用研究[J].中国比较医学杂志,2013,23 (01):18 -22.
[17]袁本利.药物安全评价中脏器系数的意义及不足[J].中国新药杂志,2003,12 (11):960 -963.

