紫锥菊提取物对大菱鲆(Scophthalmus maximus)的非特异性免疫功能的影响*
秦志华 董文宾 姜令绪 王仁杰 张启迪单 虎 ① 雷霁霖
(1. 青岛农业大学 青岛 266109; 2. 中国水产科学研究院黄海水产研究所 青岛 266071)
大菱鲆(Scophthalmus maximus)是中国北方沿海地区的重要海水养殖品种, 但是随着水产养殖业不断发展, 特别是集约化、规模化程度的不断提高, 给鱼类疾病防治提出了新的挑战。在养殖生产过程中由于抗生素等药物的不正当使用, 不仅使病原微生物产生抗药性, 耐药菌株不断增加, 水产动物免疫功能下降, 同时也造成了巨大的经济损失, 如“多宝鱼药残事件”使整个大菱鲆产业受到了沉重打击。因此,如何提高大菱鲆的健康养殖水平, 促进大菱鲆养殖业的可持续健康发展, 成为当前的首要任务。
中草药作为免疫增强剂符合发展无公害渔业、生产绿色水产品的需求。国内外很多研究证明, 中草药免疫增强剂可显著增强水产动物的抗病能力。国外学者以单方中草药牛膝和旱莲草分别投喂露斯塔野鳗和罗非鱼, 结果表明能显著提高机体的免疫力(Rao et al, 2005; Christybapita et al, 2007)。国内学者用复方中草药投喂罗非鱼(张照红等, 2011)、牙鲆(李霞等,2011)、草鱼(李超等, 2011)等, 均能有效地提高机体非特异性免疫力。在我国, 紫锥菊作为非传统中草药,近几年的研究越来越多, 但在水产养殖中的研究较少。仅有任永林(2008)关于紫锥菊对鲤鱼的生产性能和免疫功能的影响研究。
大菱鲆是近年来推广的养殖品种, 有关紫锥菊对它的作用效果尚未见报道。本研究通过给大菱鲆注射不同浓度的紫锥菊提取物, 测定其非特异性免疫指标以及机体的抗病力, 研究其对大菱鲆的免疫效果, 进而为其在大菱鲆养殖生产过程中推广应用提供科学依据。
1 材料与方法
1.1 试验材料
试验药物紫锥菊提取物(有效成分为5.4%菊苣酸)由青岛市康地恩药业有限公司提供。试验用鱼购买于胶南通用水产有限公司。
1.2 试验设计
试验用鱼分为 4个组, 对照组(注射生理盐水),低剂量组(10mg/mL)、中剂量组(20mg/mL)、高剂量组(40mg/mL), 每组10尾鱼, 每组设4个重复。
1.3 试验动物及饲养管理
试验大菱鲆体重 250±20g, 以重复为单位饲养于水循环室内, 保持水温在 14—15 °C之间。盐度为31—33, pH为7.8—8.3, 24h不间断充氧, 驯化及试验期间足量投喂基础饲料, 定时除去残饵。进行为期7d驯化, 再进行28d试验。
每天上午10点对大菱鲆注射不同浓度的紫锥菊0.2mL, 观察大菱鲆的摄食量、精神活动状态并记录。
1.4 试验方法
1.4.1 样品采集 在试验过程中的7、14、21、28d分别对各组大菱鲆取样(n=12), 取样前 1h停止注射紫锥菊提取物。分别用无菌采血器从大菱鲆尾静脉中抽血, 每尾采血样1.0mL, 其中10尾的血液置于离心管中, 通过冻融法破碎细胞, 在3000r/min, 离心15 min,取血清进行溶菌酶活力和超氧化物歧化酶活力的测定。
在注射试验的第28天对各组大菱鲆取样(n=10),取样前1h停止注射紫锥菊提取物。分别从尾静脉中采血, 每尾采血样 1.0mL, 进行体外细胞培养, 测定呼吸爆发活力。
1.4.2 溶菌酶活力测定 根据王雷等(1994)的方法略做修改, 用0.067mo1/L的磷酸盐缓冲液(pH 6.4)将溶壁微球菌配制成 0.2mg/mL的菌悬液, 每个样品取 3mL菌悬液, 加入 40μL血清, 混匀后立即在540nm下测定反应液的吸光值 A, 然后在 28°C水浴中放置 30min, 立即取出转入 4°C冰浴以中止反应,再在540nm下测定B值。按公式计算溶菌酶的活力U= (B–A)/B 。
1.4.3 吞噬细胞吞噬活力的测定 参照刘红等(2006)的方法, 在0.5mL抗凝血中加入0.2mL迟缓爱德华氏菌(含菌量 1×108CFU/mL), 置于 25°C 培养箱中振荡培养1h, 3000r/min离心15min, 取沉淀底层物抹片, 甲醇固定 5—10min, 瑞氏染色 30s, 姬母萨氏染色10 min, 蒸馏水冲洗, 吹干。在油镜下观察100个吞噬细胞的吞噬情况, 计数并计算吞噬细胞的吞噬百分比(PP)。

1.4.4 超氧化物歧化酶活性的测定 SOD活力的测定采用连苯三酚自氧化法(邓碧玉等, 1991), 以每毫升反应液中, 每分钟抑制连苯三酚自氧化速率达50%的酶量定义为一个活力单位。
1.4.5 大菱鲆原代细胞的培养 在大菱鲆肌肉注射紫锥菊提取物溶液后的第4周取样。取样之前鱼禁食 24h。从每个处理随机选取6尾鱼, 重击鱼的头部使其昏迷, 解剖分离头肾, 迅速转移到 L-15 培养基中(含有1%双抗和2%血清) 。在无菌条件下, 用100目筛绢将头肾组织研磨成细胞悬液, 用51%的percoll溶液在 2200r/min下进行离心 30min, 以分离巨噬细胞, 并用血细胞计数器检测细胞存活数, 将细胞浓度调整至 107个/mL。在 96孔板的每孔加入 100μL 调好浓度的头肾巨噬细胞于18°C下培养2h (Ortuño et al, 2000)。
1.4.6 呼吸爆发活力的测定 实验方法参考Dolmatova(2004)的方法并略作改动。在96孔板培养的贴壁巨噬细胞悬液去掉上清液后, 在每孔中加入100μL的1mg/mL氯化硝基四氮唑蓝溶液(NBT), 18°C下孵育2h。弃去上清液, 再加入200μL 100%的甲醇固定巨噬细胞, 室温反应10min后, 再用70%的甲醇溶液洗 2次, 然后将 96孔板自然风干。风干后在每孔中加入120mL 2mol/L的 KOH和140μL的二甲基亚砜(DMSO)。用振荡器缓慢振荡5min后, 室温下在620nm波长处测定吸光度值。
1.5 攻毒试验
注射试验28d后进行攻毒试验, 攻毒试验每组10尾鱼, 共4组。试验用迟缓爱德华氏菌由中国水产科学研究院黄海水产研究所提供, 预试验确定攻毒浓度为1 × 108CFU/mL, 每尾注射0.2mL, 连续观察7d,统计每组的死亡率, 计算免疫保护率。

1.6 数据处理
采用SPSS 20.0软件对数据进行单因素方差分析,进行Duncan多重比较。
2 结果与分析
2.1 肌肉注射紫锥菊提取物对大菱鲆超氧化物歧化酶(SOD)活力的影响
如图 1所示, 注射 7、15、21、28d紫锥菊提取物对大菱鲆超氧化物歧化酶(SOD)活力的影响极显著(P<0.01), 高剂量组与中剂量组差异不显著(P>0.05),与其它两个剂量组差异极显著(P<0.01), 低剂量组与空白对照组差异不显著(P>0.05)。

图1 紫锥菊提取物对大菱鲆超氧化物歧化酶(SOD)活力的影响Fig.1 Effects of E. purpurea extract on superoxide dismutase(SOD) activity of turbot
2.2 肌肉注射紫锥菊提取物对大菱鲆溶菌酶(LSZ)活力的影响
如图 2所示, 注射 7、15、21、28d后紫锥菊提取物对大菱鲆溶菌酶活力的影响极显著(P<0.01), 高剂量组与中剂量组差异不显著(P>0.05), 而与其它两个剂量组差异极显著(P<0.01), 低剂量组与空白对照组差异不显著(P>0.05)。

图2 紫锥菊提取物对大菱鲆溶菌酶活力的影响Fig.2 Effects of E. purpurea extract on turbot lysozyme activity
2.3 肌肉注射紫锥菊提取物对大菱鲆吞噬细胞呼吸爆发活力的影响
图3所示, 注射28d后紫锥菊提取物对大菱鲆吞噬细胞的呼吸爆发活力的影响极显著(P<0.01), 高剂量组与空白组差异极显著(P<0.01), 而与其它两个剂量组差异不显著(P>0.05), 低剂量组和中剂量组与空白对照组差异不显著(P>0.05)。
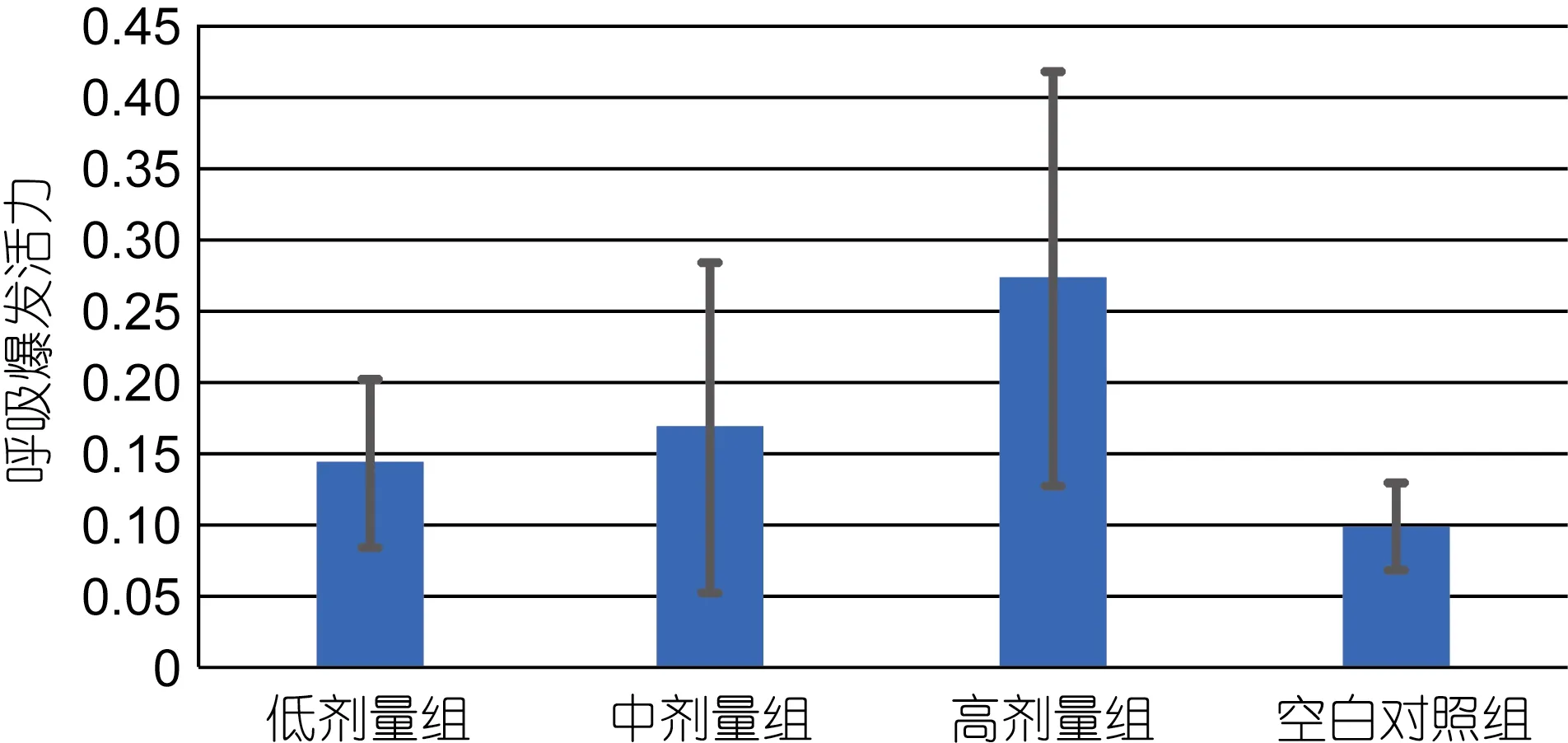
图3 注射紫锥菊提取物28d对大菱鲆吞噬细胞呼吸爆发活力的影响Fig.3 Effects of injection of E. purpurea extract 28d on turbot phagocytic respiratory burst activity
2.4 肌肉注射紫锥菊提取物对大菱鲆吞噬细胞吞噬率(PP)的影响
图 4所示, 注射 15d、28d后紫锥菊提取物对大菱鲆吞噬细胞的吞噬活力的影响显著(0.01<P<0.05),高剂量组与其它 3个试验组差异显著(0.01<P<0.05),低剂量组和中剂量组与空白对照组差异不显著(P>0.05)。

图4 紫锥菊提取物对大菱鲆吞噬细胞吞噬率的影响Fig.4 Effects of E. purpurea extract on phagocyte phagocytosis rate of turbot
2.5 攻毒试验
从表 1中看出肌肉注射射紫锥菊提取物能显著提高大菱鲆的免疫保护率, 其中高剂量组与中剂量组差异不显著(P>0.05)。高剂量组、中剂量组与低剂量组、空白对照组差异极显著(P<0.01)。
3 讨论
3.1 紫锥菊提取物对大菱鲆溶菌酶和吞噬细胞吞噬活力的影响
鱼类由于其特异性免疫机制尚不完善, 非特异性免疫在其防御体系中具有重要作用。其中溶菌酶和吞噬细胞在鱼类抵抗各种病原微生物中发挥重要作用。溶菌酶是存在于溶酶体内的水解酶, 是吞噬细胞杀菌的物质基础和重要的非特异性免疫因子, 能使吞噬细胞的吞噬活性增强(Amar et al,2004; 孟小亮等, 2009)。因此, 通过测定鱼类血液中吞噬细胞吞噬能力以及血清中的溶菌酶活性, 可以从一定程度上衡量鱼类非特异性免疫力(刘勇等,2007)。徐歆(2014)研究表明, 紫锥菊提取物能够能够通过增强小鼠机体的抗体分泌和非特异性免疫,来增强机体的免疫功能, 并且能够提高小鼠抗沙门氏菌感染的能力。纪简常等(2002)研究表明, 中草药能显著提高建鲤的溶菌酶活力。本研究表明, 紫锥菊提取物能显著的提高大菱鲆溶菌酶活力, 整个试验过程, 高剂量组与中剂量组对溶菌酶活力提升比较显著, 低剂量组对溶菌酶活力的影响不显著,而高剂量紫锥菊提取物对吞噬细胞吞噬活力影响比较显著, 其它剂量组不是很显著, 综上所述, 紫锥菊提取物能有效的提高大菱鲆的非特异免疫因子的活力。
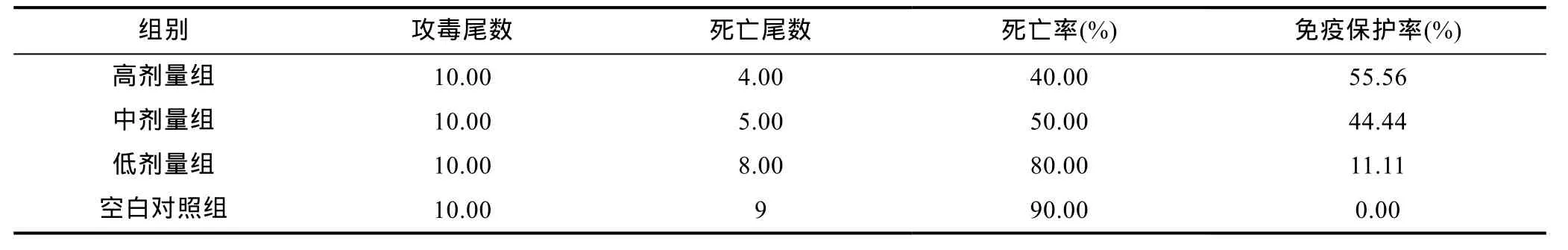
表1 攻毒后的死亡率和免疫保护率Tab.1 The survival rate and relative percent survival rate after challenged by E. tarda
3.2 紫锥菊提取物对大菱鲆超氧化物歧化酶(SOD)活力的影响
超氧化物歧化酶是生物体内抗氧化酶系的重要酶类, 对生物体内活性氧自由基的清除起着至关重要的作用, 检测抗氧化指标可以反映机体的抗氧化能力和免疫情况。研究表明, 紫锥菊提取物对能显著的提高大菱鲆超氧化物歧化酶(SOD)活力, 注射到第7天时, 高剂量组与中剂量组对超氧化物歧化酶(SOD)活力提升比较显著, 低剂量组没有显著变化,随着试验的进行, 注射 15、21、28d, 高剂量组对超氧化物歧化酶(SOD)活力的影响弱于中剂量组, 但是差异不是很显著。说明紫锥菊提取物在短时间内对大菱鲆的超氧化物歧化酶(SOD)活力维持在一个比较高的水平。陈孝煊等(2003)用 1%金银花的饲料喂养异育银鲫, 血清中 SOD的活性增强, 这与本试验的研究结果类似。
3.3 肌肉注射紫锥菊提取物对大菱鲆吞噬细胞呼吸爆发活力的影响
吞噬细胞的呼吸爆发活力功能在宿主防御及炎症反应中起着重要的作用, 在吞噬过程或受刺激产生呼吸爆发, 消耗氧气释放大量活性氧自由基(邢宇坤等, 2004)。呼吸爆发增强后能增加氧化水平以此来刺激吞噬细胞, 在鱼类非特异性免疫中被认为是一个重要的指标(Miyazaki, 1998), 注射28d后测试表明高剂量组显著的提高大菱鲆吞噬细胞呼吸爆发活力,而其它剂量组没有显著变化。说明随着紫锥菊提取物浓度的提高, 对大菱鲆吞噬细胞呼吸爆发活力也有所增强。
3.4 攻毒试验
攻毒试验结果显示, 高剂量组对大菱鲆的免疫保护率最高, 中剂量组次之, 低剂量组较差, 结合对大菱鲆的非特异性免疫指标的测定, 基本符合试验预期结果。说明紫锥菊提取物能显著的提高大菱鲆非特异性免疫力及机体抗病力。
4 结论
本试验研究了紫锥菊提取物对大菱鲆非特异性免疫力的影响。结果表明, 紫锥菊提取物可提高大菱鲆鱼体非特异性免疫功能, 增强抗病力。因此, 将紫锥菊提取物应用为大菱鲆免疫刺激剂具有广阔的前景。但是, 紫锥菊提高鱼体免疫力的机理还不甚清楚,不同浓度紫锥菊提取物对大菱鲆免疫力的影响也有待于进一步研究。
王 雷, 李光友, 毛远兴等, 1994. 口服免疫型药物对养殖中国对虾病害防治作用的研究. 海洋与湖沼, 25(5): 486—492
邓碧玉, 袁勤生, 李文杰等, 1991. 改良的连苯三酚自氧化测定超氧化物歧化酶活性的方法. 生物化学与生物物理进展, 18(2): 163
刑宇坤, 张 伟, 2004. 中性粒细胞呼吸爆发的产生机制及其炎症效应. 基础医学与临床, 24(1): 1—6任永林, 2008. 紫锥菊提取物对鲤生产性能和免疫功能的影响.雅安: 四川农业大学硕士学位论文
刘 勇, 贾永红, 2007. 免疫增强剂对河鲫鱼白细胞吞噬和溶菌酶活性的影响. 安徽农业科学, 35(1): 111—113
刘红柏, 卢彤岩, 张春燕等, 2006. 黄芪对史氏鲟抗氧化能力及免疫力的影响. 大连水产学院学报, 21(3): 231—235
李 超, 张其中, 杨莹莹等, 2011. 不同剂量复方中草药免疫增强剂对草鱼生长性能和免疫功能的影响. 上海海洋大学学报, 20(4): 534—540
李 霞, 马驰原, 李雅娟等, 2011. 中草药对牙鲆免疫力的影响. 东北农业大学学报, 42(3): 60—67
张照红, 林 旋, 张伟妮等, 2011. 复方中草药对奥尼罗非鱼血液非特异性免疫功能的影响. 水产科学, 30(1): 1—5
陈孝煊, 吴志新, 殷居易等, 2003. 大黄、穿心莲、板蓝根和金银花对异育银鲫非特异性免疫机能的影响. 中国水产科学, 10(1): 36—40
孟小亮, 陈昌福, 吴志新等, 2009. 嗜水气单胞菌 3种疫苗对斑点叉尾鮰免疫原性比较研究. 淡水渔业, 39(4): 49–53徐 歆, 2014. 紫锥菊提取物对小鼠免疫和抗沙门氏菌感染能力的影响及其机理研究. 杭州: 浙江大学博士学位论文
简纪常, 吴灶和, 2002. 中草药对建鲤非特异性免疫功能的影响. 大连水产学院学报, 17(2): 114—119
Amar E C, Kiron V, Satoh S et al, 2004. Enhancement of innate immunity in rainbow trout (Oncorhynchus mykiss Walbaum)associated with dietary intake of carotenoids from natural products. Fish & Shellfish Immunolgy, 16(4): 527—537
Christybapita D, Divyagnaneswari M, Michael R D, 2007. Oral administration of Eclipta alba leaf aqueous extract enhances the non-specific immune responses and disease resistance of Oreochromis mossambicus. Fish & Shellfish Immunology,23(4): 840—852
Dolmatova L S, ELiseikina M G, Romashina V V, 2004. Antioxidant enzymatic activity of coelomocytes of the far east sea cucumber Eupentacta fraudatrix. Journal of Evolutionnary Biochemistry and Physiology, 40(2): 126—135
Miyazaki T, 1998. A simple method to evaluate respiratory burst activity of blood phagocytes from Japanese flounder. Fish Pathology, 33(3): 141—142
Ortuño J, Esteban M A, Meseguer J, 2000. High dietary intake of α-tocopherol acetate enhances the non-specific immune response of gilthead seabream (Sparus aurata L.). Fish &Shellfish Immunology, 10(4): 293—307
Rao Y V, Chakrabarti R, 2005. Stimulation of immunity in Indian major carp Catla catla with herbal feed ingredients. Fish &Shellfish Immunology, 18(4): 327—334

