雷公藤甲素对类风湿关节炎患者滑膜成纤维样细胞增殖的体外抑制作用研究Δ
叶 蕾,贾 霜,潘文萍(.山东省千佛山医院药学部,济南 25004;2.山东省千佛山医院风湿免疫科,济南 25004)
类风湿关节炎(RA)以关节慢性侵蚀性炎症为特征,基本病理变化为滑膜炎,表现为成纤维样滑膜细胞(Fibroblast-like synoviocytes,FLS)过度增生、大量T 淋巴细胞和巨噬细胞浸润以及血管翳的形成。FLS 作为炎症性滑膜炎中组织损伤和基质重塑的直接效应细胞,可通过诱导炎症反应、介导骨基质降解、促进破骨细胞分化或增殖等途径参与RA 患者关节软骨、骨质的破坏[1-3]。因此,抑制FLS的异常增殖或诱导FLS分化成熟成为治疗RA的新策略。
雷公藤是卫茅科植物,具有抗炎、抑制免疫的作用,临床上常用于治疗RA、肾病综合征、支气管哮喘等,但其作用机制尚不完全清楚[4]。雷公藤甲素(Triptolide,TP)又称雷公藤内酯醇,是中药雷公藤的有效单体成分,是雷公藤中活性最高的环氧化二萜内酯化合物,临床上常用于治疗RA。有研究表明,TP 体外可诱导RA 患者FLS 的凋亡[5],但相关的试验数据较少,故本试验研究TP 对RA 患者体外FLS 增殖和细胞周期的影响,并探讨其可能的作用机制,以期为TP治疗RA提供试验依据。
1 材料
1.1 仪器
3100 SeniesⅡ水套CO2细胞培养箱、Labofuge 400 高速离心机、Multiskan MK3酶标仪(美国Thermo 公司);Epics XL流式细胞仪(美国Beckman coulter公司);X70倒置显微镜[Olympus(中国)有限公司]。
1.2 药品与试剂
雷公藤甲素(上海融禾医药科技发展有限公司,批号:071206,纯度:99.92%);高糖DMEM 培养基(美国Gibco BRL公司);胎牛血清(FBS,美国Gibco BRL公司),Ⅲ型胶原酶(美国Sigma 公司,批号:30H6812);胰蛋白酶(上海华美公司);二甲基亚砜(DMSO,上海生工生物工程有限公司)。
1.3 滑膜组织来源
滑膜组织取自山东省千佛山医院骨关节科经关节镜行膝关节置换术或滑膜切除术的5 例RA 患者,RA 诊断均符合1987年美国风湿病学会修订的类风湿关节炎分类标准。患者均为女性,年龄59~72 岁,平均年龄61 岁,X 线分期均为Ⅳ期。5 例患者均于术中切取膝关节滑膜组织。本试验经山东省千佛山医院伦理委员会批准。
2 方法
2.1 FLS的分离、培养与鉴定
采用组织块原代培养法进行FLS 原代培养,具体方法见文献[5]。倒置显微镜下观察细胞生长情况,当细胞生长至覆盖底面>80%时,吸弃培养液,用无菌磷酸盐缓冲液(PBS)冲洗2~3遍,加入胰蛋白酶/乙二胺四乙酸溶液于37 ℃消化约1 min。倒置显微镜下观察,若大部分细胞胞质回缩、胞体变圆、细胞间隙增大,则加入少量含10%FBS的DMEM培养液终止消化,吸管吹打使细胞悬液混匀后移至15 ml 离心管中,以离心半径为17 cm、1 000 r/min 离心5 min,弃上清,加入适量含10%FBS的DMEM培养液吹打均匀后,按1∶3传代,分别接种到培养瓶中,置于含5%CO2、37 ℃培养箱中培养。根据细胞的生长情况及培养液的变化,每1~3 天更换培养液1 次。细胞培养至3~4代后,加入CD55抗体,用流式细胞仪检测细胞表达CD55阳性率,检验细胞纯度。
2.2 台盼蓝法对体外FLS计数及活力检测
将第3~4 代细胞消化、离心、重悬后,取等体积细胞悬液与5 g/L的台盼蓝染液混匀,静置染色3~4 min后计数。死细胞被染成淡蓝色,活细胞拒染。根据以下公式进行细胞计数并计算活细胞百分率:细胞总数=(4大格细胞总数/4)×104×稀释倍数;活细胞百分率(%)=(4 大格活细胞总数/4 大格细胞总数)×100%。
2.3 MTT法检测细胞的增殖抑制率
取对数生长期细胞,用含10% FBS 的DMEM 制备成1×105ml-1的细胞悬液,接种于96 孔培养板中,孵育24 h 后加入TP溶液,制成TP终浓度为0 nmol/ml的空白对照组和50、100、200 nmol/ml 的低、中、高浓度组,每个浓度设6 个复孔。分别置于37 ℃、5%CO2的培养箱中继续培养24、48、72 h后,加入5 mg/ml MTT 20 μl,继续培养4 h,弃去上清,每孔加DMSO 200 μl,振荡至结晶完全溶解。用酶标仪于490 nm波长处测定吸光度A,细胞的增殖抑制率(SF,%)=(1-A试验组/A空白对照组)×100%。
2.4 流式细胞术检测细胞凋亡和周期
取对数生长期细胞制成5×105ml-1的细胞悬液,将试验分为4 组,TP 浓度分别为0(空白对照)、50、100、200 nmol/ml,每个浓度设6个复孔。各组细胞均于37 ℃、5%CO2培养箱中培养48 h 后,取适量细胞,PBS 洗涤2 次,加入70%乙醇固定30 min,离心后PBS洗2次,弃上清,加入10 mg/ml的核糖核酸酶A 100 μl 和10 mg/ml 的溴化丙啶(PI)2 ml,4 ℃避光孵育30 min,流式细胞仪检测细胞凋亡和细胞周期。
2.5 统计学方法
3 结果
3.1 细胞的形态及鉴定结果
对原代培养的FLS进行贴壁分离纯化,细胞传代培养,试验各间段均在倒置显微镜观察细胞形态。结果显示,活细胞百分率>98%,流式细胞仪鉴定细胞表面CD55阳性表达率大于95%,因此可用3~4代细胞进行试验。
3.2 各组细胞增殖抑制率检测结果
与空白对照组比较,各给药组作用24、48、72 h后SF值均升高,差异有统计学意义(P<0.05);作用时间相同时,随着药物浓度的增加,SF 值增加;当药物浓度相同时,适当延长作用时间,SF 值略有升高(除中浓度组72 h SF 值较48 h 略有下降),平均在24~48 h达抑制最大值。增殖抑制率测定结果见表1。
表1 增殖抑制率测定结果(,n=6)Tab 1 The results of proliferation inhibitory rates(,n=6)
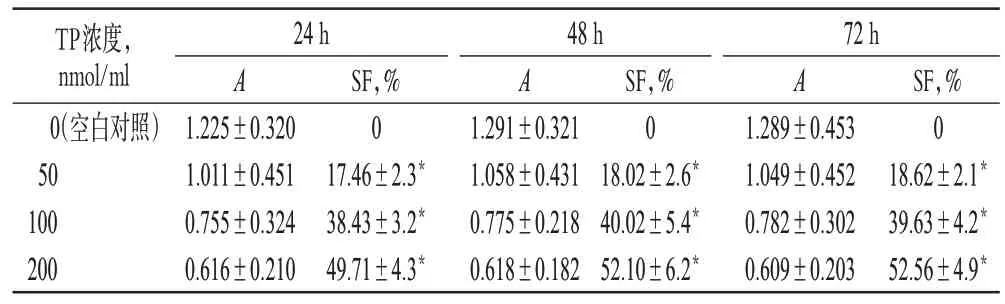
表1 增殖抑制率测定结果(,n=6)Tab 1 The results of proliferation inhibitory rates(,n=6)
注:与空白对照组比较,*P<0.05Note:vs.blank control group,*P<0.05
3.3 各组细胞凋亡和细胞周期检测结果
与空白对照组比较,中、高浓度TP 作用后G0/G1期细胞比例增加,S 期细胞比例减少,差异有统计学意义(P<0.05);且高浓度时可诱导细胞凋亡,作用48 h后出现显著凋亡峰(见图1)。各组细胞周期检测结果见表2。
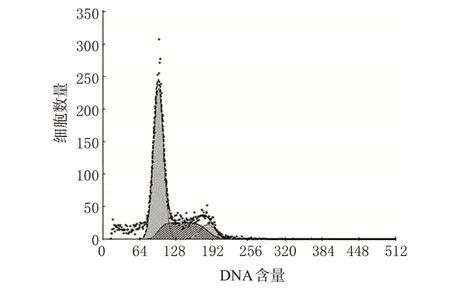
图1 高浓度TP对FLS的流式细胞凋亡图Fig 1 Flow cytometry apoptosis of FLS after treated with high concentration of TP
表2 细胞周期检测结果(,n=6,%)Tab 2 The results of cell cycle test(,n=6,%)
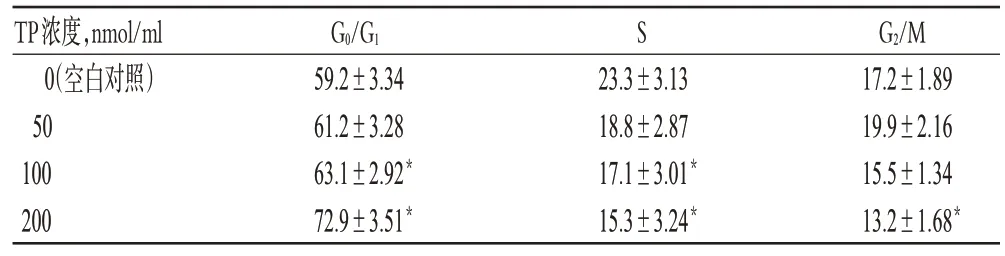
表2 细胞周期检测结果(,n=6,%)Tab 2 The results of cell cycle test(,n=6,%)
注:与空白对照组比较,*P<0.05Note:vs.blank control group,*P<0.05
4 讨论
正常情况下,FLS可分泌纤维蛋白、胶原蛋白、软骨素蛋白聚糖等多种结缔组织的组成成分,在保持关节内环境稳态中发挥重要作用[6]。大量的研究表明,RA 患者的FLS 在慢性炎症过程中被激活后出现细胞表型的显著改变,在连续培养中这些细胞表现出高增殖率、接触抑制缺失、组成性表达细胞因子mRNA 和锚定非依赖性细胞生长等特性[7]。FLS为RA患者炎症性滑膜炎中组织损伤和基质重塑的关键效应细胞,抑制FLS增殖可有效减轻关节炎和减少骨侵蚀,从而达到治疗RA的效果。
研究证明,TP可抑制炎症关节滑膜组织中多种趋化因子、细胞因子mRNA及其相应受体的表达[8-11],抑制血清中炎性细胞因子的表达,促进抗炎细胞因子的水平升高[11],抑制滑膜细胞分泌血管内皮生长因子(VEGF)、金属基质蛋白酶9(MMP-9)等从而抑制血管翳增殖[12]。
笔者从RA患者膝关节分离滑膜组织,采用组织块培养法得到的FLS,经原代培养后,取第3~4代FLS用于试验。加入TP 作用24 h 后FLS 即开始出现生长明显减慢,光镜下可见细胞突触回缩,细胞形态变不规则,细胞变圆甚至皱缩变小,核分裂相细胞较少,有的可见凋亡小体。这与周光伟等[5]研究结果相一致。不同浓度对FLS 的增殖均有抑制作用,并随浓度的加大抑制作用增强,呈浓度依赖性;而与作用时间并无明显的正相关关系,平均24~48 h均达作用最高峰。低剂量TP虽对FLS细胞增殖有抑制作用,但对其细胞周期无明显影响。加大药物浓度可诱导细胞凋亡,使S 期细胞比例降低,G0/G1期细胞比例增加,抑制细胞有丝分裂,促进细胞分化。
综上,TP 对RA 患者体外培养的FLS 具有良好的抑制作用,高浓度TP 可诱导FLS 凋亡,但其作用机制不明,有待进一步研究。
[1]Jackson JR,Minton JA,Ho ML,et al.Expression of vascular endothelial growth factor in synovial fibroblasts is induced by hypoxia and interleukin-1β[J].J Rheumatol,1997,24(7):1 253.
[2]Marinova-Mutafchieva L,Williams RO,Funa K,et al.Inflammation is preceded by tumor necrosis factor-dependent infiltration of mesenchymal cells in experimental arthritis[J].Arthritis Rheum,2002,46(2):507.
[3]Lories RJ,Derese I,Ceuppens JL,et al.Bone morphogenetic proteins 2 and 6,expressed in arthritic synovium,are regulated by proinflammatory cytokines and differentially modulate fibroblast-like synoviocyte apoptosis[J].Arthritis Rheum,2003,48(10):2 807.
[4]姚金成,刘颖,胡领,等.雷公藤甲素诱导肝细胞L-02 凋亡的作用机制研究[J].中国药房,2013,24(11):964.
[5]周光伟,沈权,金若珏,等.雷公藤多苷对类风湿关节炎患者滑膜细胞凋亡的影响[J].浙江临床医学,2007,9(8):1 034.
[6]Ospelt C,Neidhart M,Gay RE,et al.Synovial activation in rheumatoid arthritis[J].Front Biosci,2004,1(9):2 323.
[7]Bartok B,Firestein GS.Fibroblast-like synoviocytes:key effector cells in rheumatoid arthritis[J].Immunol Rev,2010,233(1):233.
[8]陈宗良.雷公藤多苷对滑膜细胞趋化因子RANTES、MCP-1影响的研究[J].中国医疗前沿,2009,13(4):125.
[9]Li H,Zhang YY,Tan HW,et al.Therapeutic effect of tripterine on adjuvant arthritis in rats[J].J Ethnopharmacol,2008,118(3):479.
[10]陈学晏,刘扬,李振英.雷公藤多苷治疗佐剂关节炎大鼠对TH1/TH2细胞平衡的影响[J].黑龙江医科大学,2009,32(2):95.
[11]毛晓丹,孙赛君,裴紫燕,等.雷公藤内酯醇对类风湿关节炎滑膜成纤细胞IL-18 及其受体表达的影响[J].细胞与分子免疫学杂志,2009,25(7):606.
[12]张前德,时彦标,谈文峰,等.雷公藤甲素对类风湿关节炎滑膜成纤维细胞系MH7A中VEGF、MMP-9水平变化的影响[J].南京医科大学学报:自然科学版,2008,28(7):902.

