三种方法提取血清miRNA效果的比较*
陈昌国,陈秋圆,2,郭建巍,马志家,刘 敏,赵强元,张雅芳
(1.中国人民解放军海军总医院检验科,北京 100048;2.北方医学院检验医学系,河北张家口 075000)
·论 著·
三种方法提取血清miRNA效果的比较*
陈昌国1,陈秋圆1,2,郭建巍1,马志家1,刘 敏1,赵强元1,张雅芳1
(1.中国人民解放军海军总医院检验科,北京 100048;2.北方医学院检验医学系,河北张家口 075000)
目的 比较Trizol法、蛋白酶K消化+Trizol法及沉淀裂解法提取血清miRNA的效果。方法 分别选取2例健康人、2例肺炎患者和2例肺癌患者血清,以Let-7a-5p作为目标mRNA,线虫Cel-miR-39-3p作为内参,分别采用Trizol法、蛋白酶K消化+Trizol法及沉淀裂解法提取血清miRNA,以Let-7a-5p及Cel-miR-39-3p特异性引物进行反转录PCR,以反转录PCR产物为模板运用SYBGreen Ⅰ法进行荧光定量PCR检测。结果 Trizol法与蛋白酶K消化+Trizol法均能有效提取到血清miRNA,而沉淀裂解法由于没有对血浆中的RNA进行富集故提取效果不佳。Trizol法提取较蛋白酶K消化+Trizol法相比,可以减少蛋白酶K的消化时间且提取效果更好,并且血清与Trizol试剂的体积比为200∶600时效果相对较好。三种方法检测Cel-miR-39-3p的Ct值基本一致。Trizol法和蛋白酶K消化+Trizol法在提取过程中加入的内参丢失较少。结论 Trizol法作为总RNA提取的手段适用于血清miRNA提取,通过调整血清与Trizol试剂的用量可使提取到的血清miRNA能够满足试验需要。
miRNA; Let-7a-5p; Cel-miR-39-3p; 提取
miRNA是近年来发现的一类18~24 nt的单链非编码RNA小分子,最早由Lee等[1]在秀丽新小杆线虫中首次发现,其主要通过与靶RNA分子以不完全互补和完全互补的方式影响基因的表达和稳定性,从而参与调控多种生物学行为,如:发育的进程、干细胞分化、细胞凋亡、疾病及肿瘤的发生[2-3]。miRNA是一类自然形成的小非编码RNA,50%以上的miRNA位于与癌症相关的染色体区域,多种miRNA与肿瘤的发生、发展、转移有重要的关系,因此有学者将miRNA命名为“oncomirs”[4]。血清miRNA因具有取材方便、对冷热稳定、保存时间长、表达与肿瘤的诊断、分期、进展及预后相关等特点被认为是一种潜在的肿瘤标志物[5-9]。本研究旨在通过比较三种不同的血清miRNA提取方法,为后续血清miRNA相关研究奠定基础,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取正常体检且各项指标正常的健康体检者2例,依据《肺炎诊断(WS 382-2012)指南》经呼吸科临床医生诊断为肺炎的患者2例,以及依据《013ACCP肺癌的诊断与治疗指南(第3版)》经病理诊断为肺癌的患者2例。采集各研究对象全血标本3 mL离心后收集血清。
1.2 仪器与试剂 普通PCR仪器为ABI公司GeneAmp®PCR System 9700 PCR仪,荧光定量PCR仪为ABI公司StepOne PCR仪。SYBR®Green QPCR Master Mix 购自安捷伦公司(批号0006148864);RevertAid Fist Strand cDNA Synthesis Kit(批号00127244)购自Thermo SCIENTIFIC公司;miRNA特异性反转录引物、PCR引物及线虫Cel-miR-39-3p内参(20 fmol/sample)miRNA购自广州瑞博生物科技有限公司。
1.3 方法
1.3.1 Trizol法提取血清miRNA 200 μL血清中加入500 μL Trizol,涡旋振荡30 s,室温静置5 min;加200 μL三氯甲烷,剧烈颠倒混匀45 s,室温静置5 min;4 ℃ 13 000 r/min离心30 min,小心将上清液移至新的1.5 mL离心管;加等体积的异丙醇至上清液中,颠倒混匀,置-20 ℃静置30 min;4 ℃ 13 000 r/min离心30 min,沉淀总RNA;吸弃上清液,沉淀用体积分数75% 乙醇洗1 次;4 ℃,以7 500 r/min离心5 min,沉淀RNA;吸净乙醇,50 μL DEPC水溶解RNA。
1.3.2 蛋白酶消化法提取血清miRNA 取200 μL 血浆样本于1.5 mL离心管中,加入10 μL蛋白酶K(20 mg/mL),56 ℃消化30 min后进行RNA提取,步骤同1.3.1。
1.3.3 沉淀裂解法提取血清miRNA 取200 μL血浆样本于1.5 mL离心管中,加入200 μL核酸提取液,涡旋振荡15 s,室温13 000 r/min离心10 min,弃上清液;在沉淀中加入50 μL核酸裂解液吹打混匀,涡旋振荡15 s,100 ℃金属浴加热10 min,室温13 000 r/min离心5 min,取上清液作为反转录PCR的模板。
1.3.4 反转录及荧光定量PCR反应体系及条件 采用Thermo SCIENTIFIC公司反转录试剂盒进行反转录,所有体系及步骤按照说明书进行操作,取2 μL反转录cDNA为模板以Let-7a-5p荧光定量PCR引物进行扩增。PCR反应条件为95 ℃ 5 min;95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,40个循环,收集荧光。
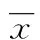
2 结 果
2.1 三种方法提取血清miRNA后Let-7a-5p及Cel-miR-39-3p检测情况 三种方法提取的血清miRNA经荧光定量PCR检测均使Let-7a-5p和Cel-miR-39-3p有效扩增,见图1。

注:A为Let-7a-5p的PCR扩增曲线;B为Cel-miR-39-3p的PCR扩增曲线。
图1 荧光定量PCR扩增曲线
2.2 三种方法提取血清miRNA后内参Ct值差异 三种方法提取血清miRNA过程中掺入25 fmol内参后,经过后续步骤操作,Trizol法、蛋白酶K消化+Trizol法、沉淀裂解法提取的miRNA中,Cel-miR-39-3p的扩增Ct值分别为26.3±1.5、27.4±1.3、28.2±1.8,差异无统计学意义(P=0.12)。
2.3 不同血清用量与Trizol试剂提取血清miRNA的效率 对分别设置3个不同的血清与Trizol 试剂体积比(100∶600、200∶600及300∶600),比较不同血清用量与Trizol试剂提取血清miRNA的效率,同时检测Let-7a-5p和Cel-miR-39-3p,发现血清与Trizol试剂体积比为200∶600时,提取效果较好(绿色曲线),荧光定量PCR扩增曲线见图2。

注:A为Let-7a-5p的PCR扩增曲线;B为Cel-miR-39-3p的PCR扩增曲线。
图2 不同血清用量与Trizol试剂提取血清miRNA的效率比较
3 讨 论
研究显示,miRNA表达与肿瘤的诊断、分期、进展及预后相关,其表达水平的检测有可能为观察临床疗效、判断肿瘤是否复发及预后提供帮助。此外,miRNA广泛存在于泪液、乳汁、唾液等多种体液中,在血浆、血清中具有良好的稳定性,在多次反复冻融、24 h室温放置、强酸、强碱、DNA酶、RNA酶等恶劣情况下仍不被降解且保持相对稳定的水平[10-11],在血清和血浆中的表达不存在差异,外周血miRNA的表达亦不存在明显的性别、个体差异[5,9,12],这些均提示miRNA有潜力作为肿瘤标志物应用于肿瘤的早期诊断、疗效判定及转移复发等病情的判断指标[7-8]。
目前,常用的血清miRNA 的提取方法有柱分离法和Trizol法,相对于柱分离技术而言,Trizol法能够较好地保留包括miRNA 在内的小片段成分,但该方法主要用于细胞总mRNA提取,并未考虑miRNA与mRNA在物理性质及存在方式上的差别。赵德尧等[13]曾尝试在Trizol法抽提miRNA前对标本进行加热、加入十二烷基磺酸钠(SDS)、超声裂解及蛋白酶K消化等处理,发现加热或加入SDS能够显著提高血清miRNA的提取效率[13]。为进一步开展血清miRNA的相关研究工作,本课题组分别采用Trizol法、蛋白酶K消化+Trizol法及沉淀裂解法抽提血清miRNA,发现经典的Trizol法能够有效提取到血清miRNA并且通过调整血清与Trizol试剂的比例可满足实验的要求;蛋白酶K消化+Trizol法并未提高提取效率并且操作时间稍长。miRNA主要以蛋白复合体的形式存在,提高miRNA 提取效率的关键是使miRNA从蛋白复合体上解离下来,依据该特点本研究尝试使用临床提取核酸用的核酸沉淀液及核酸提取液抽提血清miRNA,实验结果证实该方法不适用于血清miRNA的提取。经荧光定量PCR检测,三种方法提取物中,内参Cel-miR-39-3p的Ct值无明显差异,说明三种抽提方法均能有效保留加入的内参[14-15]。本研究成功地利用Trizol法、蛋白酶K消化+Trizol法提取到血清miRNA,并且Trizol法提取效果相对更好,利用荧光定量PCR进行检测的结果能满足实验要求。
[1]Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[2]Macfarlane LA,Murphy PR.MicroRNA:biogenesis,function and role in cancer[J].Curr Genomics,2010,11(7):537-561.
[3]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[4]Esquela-Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer[J].Nat Rev Cancer,2006,6(4):259-269.
[5]Cortez MA,Welsh JW,Calin GA.Circulating microRNAs as noninvasive biomarkers in breast cancer[J].Recent Results Cancer Res,2012,195:151-161.
[6]Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[7]Wang J,Zhang KY,Liu SM,et al.Tumor-associated circulating microRNAs as biomarkers of cancer[J].Molecules,2014,19(2):1912-1938.
[8]Shen J,Stass SA,Jiang F.MicroRNAs as potential biomarkers in human solid tumors[J].Cancer Lett,2013,329(2):125-136.
[9]Cortez MA,Bueso-Ramos C,Ferdin J,et al.MicroRNAs in body fluids--the mix of hormones and biomarkers[J].Nat Rev Clin Oncol,2011,8(8):467-477.
[10]Grasedieck S,Scholer N,Bommer M,et al.Impact of serum storage conditions on microRNA stability[J].Leukemia,2012,26(11):2414-2416.
[11]Mraz M,Malinova K,Mayer J,et al.MicroRNA isolation and stability in stored RNA samples[J].Biochem Biophys Res Commun,2009,390(1):1-4.
[12]Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci U S A,2008,105(30):10513-10518.
[13]赵德尧,杜权,郭江峰,等.血浆microRNA提取技术优化[J].浙江理工大学学报,2010,27(4):595-599.
[14]Kroh EM,Parkin RK,Mitchell PS,et al.Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR(qRT-PCR) [J].Methods,2010,50(4):298-301.
[15]Arroyo JD,Chevillet JR,Kroh EM,et al.Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma[J].Proc Natl Acad Sci U S A,2011,108(12):5003-5008.
Comparing the serum miRNA extraction effect of three methods*
CHENChang-guo1,CHENQiu-yuan1,2,GUOJian-wei1,MAZhi-jia1,LIUMin1,ZHAOQiang-yuan1,ZHANGYa-fang1
(1.DepartmentofClinicalLaboratory,NavyGeneralHospitalofPLA,Beijing100048,China;2.DepartmentofLaboratoryMedicine,theNorthMedicalCollege,Zhangjiakou,Hebei075000,China)
Objective To compare the serum miRNA extracting efficiency of Trizol method,protease K digestion combined with Trizol method and precipitation pyrolysis method.Methods 2 healthy persons,2 pneumonia patients and 2 lung cancer patients were enrolled in the study and their serum samples were collected.miRNA were extracted from serum samples respectively by using Trizol method,protease K digestion combined with Trizol method and precipitation pyrolysis method.Let-7a-5p was the objective miRNA of detection,with Cel-miR-39-3p as the incorporation of spike-in reference.The specific primers of Let-7a-5p (objective miRNA) and Cel-miR-39-3p (internal reference) were used in reverse transcription PCR.The products of reverse transcription PCR were used as templates for SYBGreen Ⅰ fluorescence quantitative PCR assay.Results The Trizol method and protease K digestion combined with Trizol method could effectively extract serum miRNA,but precipitation pyrolysis method was not so suitable for extraction of serum miRNA.Trizol method was better than protease K digestion combined with Trizol method,which could save the proteinase K digestion time and had better extracting effects.When the volume ratio of serum and Trizol reagent was 200∶600,the extracting effect of Trizol method was best.The Ct values of Cel-miR-39-3p extracted by three methods were basically the same.There was a little loss of internal reference in the extraction process of Trizol method and protease K digestion combined with Trizol method.Conclusion The Trizol method as the extracting method of total RNA is suitable for miRNA extraction from serum.The extracted serum miRNA can meet the detection needs by adjusting the dosage of serum and Trizol reagent.
miRNA; Let-7a-5p; Cel-miR-39-3p; extracting
国家自然基金青年项目(81401311);首都临床特色应用研究项目[吴阶平(Z141107006614009)]。
陈昌国, 男,博士,主管技师,主要从事分子免疫相关研究。
10.3969/j.issn.1672-9455.2015.20.003
A
1672-9455(2015)20-2976-03
2015-03-06
2015-06-12)

