重度子痫前期患者外周血Th17和Treg细胞及相关细胞因子的表达及意义*
汪 勤,赵春辉,夏良萍,朱华英
(1.江苏大学第四附属医院ICU,江苏镇江 212001;2.江苏省镇江市精神卫生中心检验科,江苏镇江 212001;3.江苏大学第四附属医院检验科,江苏镇江 212001;4.江苏大学第四附属医院产科,江苏镇江 212001)
·论 著·
重度子痫前期患者外周血Th17和Treg细胞及相关细胞因子的表达及意义*
汪 勤1,赵春辉2△,夏良萍3,朱华英4
(1.江苏大学第四附属医院ICU,江苏镇江 212001;2.江苏省镇江市精神卫生中心检验科,江苏镇江 212001;3.江苏大学第四附属医院检验科,江苏镇江 212001;4.江苏大学第四附属医院产科,江苏镇江 212001)
目的 探讨重度子痫前期(sPE)患者外周血Th17及CD4+CD25+Treg细胞及相关细胞因子白细胞介素(IL)-17、IL-21、IL-10和转化生长因子β(TGF-β)的水平变化及意义。方法 选取30例sPE患者(sPE组)及30例正常妊娠者(对照组)作为研究对象。采用流式细胞术检测外周血单个核细胞中Th17及CD4+CD25+Treg细胞水平。采用QRT-PCR检测维甲酸相关孤儿受体γt(RORγt)mRNA和Foxp3 mRNA的表达水平。采用ELISA法检测血浆IL-17、IL-21、IL-10和TGF-β水平。结果 sPE组外周血Th17细胞水平为(1.16±0.78)%,显著高于对照组的(0.68±0.35)%,差异有统计学意义(t=3.447,P=0.002)。sPE组外周血CD4+CD25+Treg细胞水平为(1.65±0.49)%,显著低于对照组的(2.42±0.91)%,差异有统计学意义(t=-4.25,P=0.000)。sPE组RORγt mRNA表达水平为0.190±0.063,高于对照组的0.136±0.037,差异有统计学意义(t=3.776,P=0.001)。而sPE组Foxp3 mRNA表达水平为0.069±0.025,低于对照组的0.127±0.027,差异有统计学意义(t=-8.218,P=0.000)。sPE组IL-17、IL-21、IL-10水平分别为(82.03±37.61)、(63.29±27.42)、(56.89±17.28)ng/L,高于对照组的(30.81±21.87)、(33.87±13.73)、(33.24±11.93)ng/L,差异有统计学意义(P<0.01),TGF-β水平为(24.34±6.51)ng/L,低于对照组的(46.97±15.81)ng/L,差异有统计学意义(t=-7.781,P=0.000)。sPE患者血浆IL-17、IL-21水平与Th17细胞水平呈正相关(r分别为0.695、0.586,P<0.01)。结论 sPE患者Th17细胞数量升高,CD4+CD25+Treg细胞数量减少,以及相关细胞因子的紊乱在sPE的发病机制中可能起到重要作用。
先兆子痫; T淋巴细胞; 细胞因子类
重度子痫前期(sPE)是危害严重的妊娠期特有疾病,常伴有严重的母婴并发症,导致不良的妊娠结局。随着对Th17和调节性T细胞(Treg)的深入研究,对sPE的病因及发病机制有了更深的认识。Th17和Treg细胞是近年新发现的2个不同于Th1和Th2的Th细胞亚群。Th17细胞可产生白细胞介素(IL)-17等细胞因子,与促炎反应、自身免疫性疾病和移植排斥等密切相关。因此Th17细胞可能会由于这种促炎作用而在胚胎免疫排斥的发生中起一定作用[1]。而Treg细胞是可诱导免疫耐受并且有独特免疫调节功能的T细胞亚群,有助于母体对胎儿耐受[2]。本研究通过测定sPE患者外周血中Th17、CD4+CD25+Treg细胞水平及相关细胞因子表达,探讨其在sPE发病机制中的作用。
1 资料与方法
1.1 一般资料 选择2012年10月至2013年12月在镇江市妇幼保健院行剖宫产分娩的30例sPE患者为研究对象(sPE组)。由于sPE的病因和临床表现有明显的异质性,为了减少这种异质性及孕周对检测结果的影响,本研究选择妊娠32~40周且符合sPE诊断标准的病例,未包括合并HELLP综合征、肾功能不良及胎儿生长受限的病例。另选择血压正常,无糖尿病、肾炎、肝炎、系统性红斑狼疮、孕周匹配的30例剖宫产产妇作为对照组。两组行均衡性检验,差异无统计学意义(P>0.05)。两组产妇的临床一般资料见表1。sPE诊断标准参照《妇产科学》第8版。

表1 受试者的临床资料

组别丙氨酸氨基转移酶(U/L)尿素氮(mmol/L)血小板计数(×109/L)新生儿体质量(g)胎盘质量(g)sPE组23.4±8.53.7±1.3150.4±43.82951.8±235.2487.3±58.4对照组24.2±7.83.5±0.8161.8±35.23368.2±232.5542.5±65.9
注:与对照组比较,*P<0.05。
1.2 仪器与试剂 Biolegend公司人Th17流式检测试剂盒:包括FITC标记的抗人CD3,PE标记的抗人CD4,AlexaFluor647标记的抗人IL-17及相匹配的鼠IgG1同型对照,固定液和破膜洗液。Biolegend公司CD4+CD25+Foxp3+Treg一步法流式检测试剂盒:包括PerCP标记的抗人CD4,PE标记的抗人CD25,AlexaFluor488标记的FOXP3及相匹配的鼠IgG1同型对照,FOXP3固定/破膜液和破膜缓冲液;佛波酯、离子霉素均购自Sigma公司;莫能霉素购自Biolegend公司;流式细胞仪(FACSCalibur型号及FACSDiva软件,美国BD公司)。mRNA检测:Trizol试剂为美国Invitrogen公司产品,qRT-PCR试剂盒为日本Takara公司产品;日立U00800型紫外分光光度仪(日立,日本);Bio-RadMyIQ PCR仪(Bio-Rad,美国);凝胶成像系统(Alpha,美国);电泳仪(Bio-Rad,美国)。细胞因子检测:ELISA试剂盒为美国R&D公司产品;Bio-Rad imark酶标仪(Bio-Rad,美国)。
1.3 方法
1.3.1 标本采集 采集两组产妇外周血6 mL,肝素抗凝。其中2 mL用于流式细胞术检测分析,2 mL用于检测维甲酸相关孤儿受体γt(RORγt)和Foxp3的mRNA表达水平,2 mL用于细胞因子检测。
1.3.2 Th17细胞的检测 用Ficoll密度梯度法分离出外周血单个核细胞(PBMC),用含10%胎牛血清的RPMI 1640重悬提取的PBMC;取20 μL细胞悬液加20 μL锥虫蓝,调节细胞浓度为2×106/mL;加入丙二醇甲醚醋酸酯(PMA,终浓度为100 ng/mL)和离子霉素(终浓度为1 μg/mL)并充分混匀,于37 ℃、5% CO2细胞培养箱中培养1 h后加入莫能霉素(终浓度1 μL/mL)混匀后继续培养5 h。取刺激培养后细胞悬液100 μL于流式管中,每管加0.5 mL固定液,振荡摇匀后室温孵育20 min;加2 mL破膜洗液,振荡摇匀后室温孵育20 min,离心后弃上清液;破膜洗液洗涤和重悬细胞,加入10 μL抗人IL-17Alexa Fluor647/CD3 FITC/CD4 PE抗体混匀后室温暗处孵育30 min;阴性对照管则加入抗人IL-7同型对照鼠IgG1/CD3 F1TC/CD4 PE;0.5 h内上流式细胞仪检测。
1.3.3 CD4+CD25+Treg细胞的检测 用PBS重悬提取的PBMC;取20 μL细胞悬液加20 μL锥虫蓝,调节细胞浓度为1×107/mL;加入1 mL FOXP3固定/透膜液,充分混匀后室温孵育20 min;洗涤液及1 mL FOXP3透膜缓冲液重悬细胞,暗处孵育15 min;加入10 μL抗人FOXP3 Alexa Fluor488/CD25PE/CD4 PerCP抗体混匀后暗处孵育30 min;0.5 h内上流式细胞仪检测。
1.3.4 RORγt和Foxp3 mRNA的检测 用Trizol试剂一步法提取总RNA,紫外分光光度计检测RNA浓度。按逆转录试剂盒说明书合成cDNA,于-20 ℃保存。引物序列设计参考文献[3]。引物由上海英骏生物技术有限公司合成(表2)。反应体系(总体积25 μL):SYBRGreen MIX 0.5 μL、ddH2O 9.5 μL,dNTP 1.6 μL;分别加入上、下游引物各0.5 μL,cDNA模板2 μL,Taq DNA聚合酶(5 U/μL)0.5 μL;MgCl2(25 mmol/L)0.8 μL。RORγt PCR条件:95 ℃预变性15 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环。Foxp3 PCR条件:95 ℃预变性15 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35个循环。用β-actin作为内参照,采用2-ΔΔCt法计算RORγt和Foxp3 mRNA的相对表达量。

表2 引物序列及目的基因扩增范围
注:F为上游引物,R为下游引物。
1.3.5 血浆IL-17、IL-21、IL-10、转化生长因子β(TGF-β)检测 采用ELISA法检测血浆IL-17、IL-21、IL-10、TGF-β水平,严格按照试剂盒说明操作。
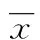
2 结 果
2.1 Th17细胞和CD4+CD25+Treg细胞水平 sPE患者外周血Th17细胞水平为(1.16±0.78)%,高于健康对照组的(0.68±0.53)%,差异有统计学意义(t=3.45,P=0.002);sPE患者外周血CD4+CD25+Treg细胞水平为(1.65±0.49)%,低于健康对照组的(2.42±0.91)%,差异有统计学意义(t=-4.25,P=0.000)。
2.2 RORγt和Foxp3 mRNA的表达水平 sPE患者外周血RORγt mRNA表达水平为0.19±0.06,高于健康对照组的0.14±0.04,差异有统计学意义(t=3.78,P=0.001);sPE患者外周血Foxp3 mRNA表达水平为0.07±0.03,低于健康对照组的0.13±0.03,差异有统计学意义(t=-8.22,P=0.000)。
2.3 细胞因子检测结果 sPE患者外周血IL-17、IL-21、IL-10明显高于健康对照组,TGF-β水平明显低于健康对照组,差异均有统计学意义(P<0.05),见表3。

表3 重度子痫患者血浆中相关细胞因子的表达水平
2.4 相关性分析 sPE患者血浆IL-17、IL-21水平与Th17细胞水平呈正相关(r分别为0.695、0.586,P<0.01);RORγt mRNA表达水平与Th17细胞水平呈正相关(r=0.739,P<0.01);Foxp3 mRNA的表达水平与CD4+CD25+Treg细胞水平呈正相关(r=0.689,P<0.01);IL-10、TGF-β与Th17和CD4+CD25+Treg细胞无相关性。
3 讨 论
3.1 sPE患者外周血Th17细胞及其相关细胞因子变化及意义 Th17细胞分泌高水平的IL-17、IL-21、IL-23,并高表达转录因子RORγt[4]。Th17细胞在自身免疫性疾病中的研究证实其参与人体内免疫及炎性反应的生物学过程,但其在妊娠及其并发症中的研究较少。有学者发现,IL-17等Th17细胞系列细胞因子与造成胎膜早破、宫内感染有密切关系[5]。Bewster等[6]研究表明,sPE患者血浆中IL-17水平与对照组相比显著增高。本研究发现,sPE患者外周血Th17细胞高于对照组,同时发现sPE患者外周血Th17细胞产生炎性因子IL-17、IL-21及Th17细胞表达的转录因子RORγt也显著增高。进一步证明Th17细胞在sPE发病机制中发挥一定的作用。在胎盘形成的过程中,滋养层细胞侵蚀子宫内膜蜕膜和浅肌层,螺旋动脉发生重铸,从而维持胎盘有足够的血流量。正常妊娠时,母体免疫系统低水平激活,类似于轻度的炎性反应。高水平IL-17可与多种因子协同发挥作用以放大胎盘小血管炎性反应,同时IL-17有强大的募集中性粒细胞的能力,通过释放活性物质后损害内皮细胞,产生氧自由基是构成了sPE血管痉挛、血压升高、水肿、蛋白尿等临床表现的病理基础[7]。从而发生胎盘组织凋亡、着床变浅、螺旋小动脉管腔狭窄等形态学改变,导致子痫前期的发生。
3.2 sPE患者外周血Treg细胞及其相关细胞因子变化及意义 Treg细胞以表达转录抑制基因Foxp3为特征并分泌IL-10、TGF-β,是一个可诱导免疫耐受并具有独特免疫调节功能的T细胞亚群[8]。近年来有研究证实,sPE患者外周血中Treg细胞数量与对照组相比明显减少[9]。本研究将CD4+CD25+Treg细胞和Foxp3 mRNA结合起来研究其在sPE中的作用机制,发现sPE患者外周血CD4+CD25+Treg细胞和Foxp3 mRNA的表达量显著低于对照组。提示sPE发生与Treg细胞的免疫抑制功能减弱有关。Treg细胞是维持肌体自身免疫耐受的重要组成部分,Treg细胞活化后能抑制自身反应性活化、增殖、分化,参与正常妊娠的免疫平衡。Treg细胞在胚胎着床及妊娠维持过程中起着至关重要的作用[10]。Treg细胞数量的减少伴随母体对胎儿排斥反应的发生。而Foxp3是Treg细胞生长发育和发挥功能的主要调节基因[11],Foxp3表达下降可能是影响Treg细胞增殖分化、细胞减少的因素之一,直接导致Treg细胞和效应性T、B淋巴细胞之间的不平衡,引发病理妊娠。本研究结果表明,PE组外周血中Foxp3的表达明显减低,提示子痫前期的发生与Treg细胞的免疫抑制功能减弱有关。Th17细胞和CD4+CD25+Treg细胞的分化是密切相关的,细胞因子TGF-β在T淋巴细胞中起双向调节作用,低浓度的TGF-β在促炎细胞因子的环境中诱导Foxp3表达水平下降,而RORγt表达水平升高,从而促进Th17细胞分化;而高浓度TGF-β能抑制IL-17的表达,增加Foxp3表达[12]。本研究发现sPE患者TGF-β水平明显降低,推测TGF-β的降低导致Treg细胞减少,Th17细胞增加,使sPE患者免疫抑制作用减弱,导致疾病的发生。虽然CD4+CD25+Treg能分泌IL-10,但是本研究中,sPE患者IL-10水平明显高于对照组,这与Treg细胞减少不相符,提示IL-10可能源于其他T细胞。
综上所述,CD4+T细胞及其相关细胞因子在母胎免疫识别和耐受过程中发挥重要的作用。随着新的CD4+T细胞的发现,现将传统的妊娠免疫理论Th1/Th2模式发展为Th1/Th2/Treg/Th17模式[13]。妊娠可看做是一种成功的同种半异体移植过程,妊娠是否成功有赖于胎儿与母体间的免疫平衡。Th17、Treg细胞通过与其分泌的细胞因子间复杂的网络系统,精细调节母胎的免疫平衡。这种平衡一旦失调,即可引发排斥反应,导致妊娠失败或病理妊娠。研究Th17、Treg细胞在sPE发病机制中的作用为临床预测和治疗该疾病提供了一个新的思路,可能通过阻断或增强其关键调节因子来调节Th17、Treg细胞的表达,寻找到治疗sPE等妊娠合并症的新靶点。
[1]Darmochwal-Kolarz D,Kludka-Sternik M,Tabarkiewicz J,et al.The predominance of Th17 lymphocytes and decreased number and function of Treg cells in preeclampsia[J].J Reprod Immunol,2012,93(2):75-81.
[2]Martínez FF,Knubel CP,Sánchez MC,et al.Pregnancy-specific glycoprotein 1a activates dendritic cells to provide signals for Th17-,Th2-,and Treg-cellpolarization[J].Eur J Immunol,2012,42(6):1573-1584.
[3]陈凤英,刘晓丽,蔡军.系统性红斑狼疮患者外周血Th17和CD4+CDhigh25 Treg细胞及相关细胞因子的检测及意义[J].中华检验医学杂志,2011,34(10):910-914.
[4]Galand C,Donnou S,Crozet L,et al.Th17 cells are involved in the local control of tumor progression in primary intraocular lymphoma[J].PLoS One,2011,6(9):e24622.
[5]Gargano JW,Holzman C,Senagore P,et al.Mid-pregnancy circulating cytokine levels,histologic chorio amnionitis and spontaneous preterm birth[J].Rcprod Immunol,2008,79(1):100-110.
[6]Bewster JA,Orsi NM,Gopichandran N,et al.Host inflammatory response profiling in preeclampsia using all in vitro whole blood stimulation model[J].Hypertens Pregnancy,2008,27(1):l-16.
[7]赵春辉,夏良萍,张晓凤,等.重度子痫前期患者外周血及胎盘组织Th17和Treg细胞的表达[J].中国妇幼保健杂志,2013,28(31):5189-5192.
[8]Lan Q,Zhou X,Fan H,et al.Polyclonal CD4+Foxp3+Treg cells induce TGFβ-dependent tolerogenic dendritic cells that suppress the murine lupus-like syndrome[J].J Mol Cell Biol,2012,4(6):409-419.
[9]Toldi G,Saito S,Shima T,et al.The frequency of peripheral blood CD4+CD25high FoxP3+and CD4+CD25-FoxP3+regulatory T cells in normal pregnancy and pre-eclampsia[J].Am J Reprod Immunol,2012,68(2):175-180.
[10]Schumacher A,Wafula PO,Teles A,et al.Blockage of heme oxygenase-1 abrogates the protective effect of regulatory T cells on murine pregnancy and promotes the maturation of dendritic cells[J].PLoS One,2012,7(8):e42301.
[11]Saito S,Shima T,Inada K,et al.Which types of regulatory T cells play important roles in implantation and pregnancy maintenance[J].Am J Reprod Immunol,2013,69(4):340-345.
[12]Regateiro FS,Howie D,Cobbold SP,et al.TGF-β in transplantation tolerance[J].Curr Opin Immunol,2011,23(5):660-669.
[13]Peck A,Mellins ED.Plasticity of T-cell phenotype and function:the T helper type17 example[J].Immunology,2009,129(2):147-153.
Expression and significance of peripheral blood Th17,Treg cells and related cytokines in patients with severe preeclampsia*
WANGQin1,ZHAOChun-hui2△,XIALiang-ping3,ZHUHua-ying4
(1.ICU,FourthAffiliatedHospitalofJiangsuUniversity,Zhenjiang,Jiangsu212001,China;2.DepartmentofClinicalLaboratory,ZhenjiangMunicipalMentalHealthCenter,Zhenjiang,Jiangsu212001,China;3.DepartmentofClinicalLaboratory,FourthAffiliatedHospitalofJiangsuUniversity,Zhenjiang,Jiangsu212001,China;4.DepartmentofObstetrics,FourthAffiliatedHospitalofJiangsuUniversity,Zhenjiang,Jiangsu212001,China)
Objective To investigate the changes and signifcance of peripheral blood Th17,CD4+CD25+iTreg cells and the related cytokines (IL-17,IL-21,IL-10 ) and TGF-βin the patients with severe preeclampsia(sPE).Methods 30 sPE patients(sPE group) and 30 cases of normal pregnancy(control group) were selected as the research subjects.The levels of Th17 and CD4+CD25+Treg cells in peripheral blood were detected by flow cytometry.QRT-PCR was used to detect the mRNA expression level of RORγt and Foxp3.Plasma cytokines levels of IL-17,IL-21,IL-10 and TGF-β were measured by ELISA.Results The peripheral blood Th17 cells level in the sPE group was signifcantly higher than that in the control group,the difference was statistically significant[(1.16±0.78)%vs. (0.68±0.35)%,t=3.447,P=0.002].The level of peripheral blood CD4+CD25+Treg cells in the sPE group was lower than that in the control group,the difference was statistically significant[(1.65±0.49)%vs. (2.42±0.91)%,t=-4.25,P=0.000].The expressions level of RORγt mRNA in the sPE group was higher than that in the control group,the difference was statistically significant[(0.190±0.063)vs. (0.136±0.037),t=3.776,P=0.001],but the expression level of Foxp3 mRNA was decreased compared with the control group,the difference was statistically significant[(0.069±0.025)vs. (0.127±0.027),t=-8.218,P=0.000].Plasma levels of IL-17,IL-21 and IL-10 in the sPE group were (82.03±37.61),(63.29±27.42),(56.89±17.28)ng/L respectively,which were higher than(30.81±21.87),(33.87±13.73),(33.24±11.93) ng/L in the control group respectively,the differences were statistically significant(P<0.01).However,the TGF-β level in the sPE group was markedly decreased compared with the control group,the difference was statistically significant[(24.34±6.51)ng/Lvs. (46.97±15.81)ng/L,t=-7.781,P=0.000].Plasma IL-17 and IL-21 levels in the sPE patients were positively correlated with the Th17 cells level(r=0.695,0.586,P<0.01).Conclusion Th17 cells increase,CD4+CD25+Treg cells decrease and related cytokines disorder in the sPE patients could play an important role in the pathogenesis of sPE.
preeclampsia; T-lymphocytes; cytokines
江苏省镇江市科技计划项目(SH2013061、SH2014063)。
汪勤,女,本科,副主任医师,主要从事危重病急救工作。△
,E-mail:jyk252@sina.com。
10.3969/j.issn.1672-9455.2015.20.027
A
1672-9455(2015)20-3040-04
2015-03-20
2015-07-10)

