幽门螺杆菌经ROS 通路激活NLRP3 炎症复合体诱导THP-1 细胞分泌IL-1β 和IL-18①
李 翔 何跃平 刘 胜 罗晶晶 刘 硕 张紫柔 姚 雯 张 艳
(南华大学病原生物学研究所,衡阳 421001)
幽门螺杆菌(Helicobacter pylori,H.pylori)致癌作用与胃黏膜炎症反应密切相关[1]。多种细胞因子介导H.pylori 感染相关的炎症反应,其中Interleukin-1beta (IL-1β) 和 Interleukin-18 (IL-18)在H.pylori 感染胃黏膜标本中的过度分泌已有报道[2-5]。体外细胞共培养试验亦表明,H.pylori 能刺激树突状细胞(Dendritic cell,DC)、巨噬细胞和单核细胞 分 泌IL-1β 和IL-18[4,6,7]。然 而,目 前 关 于H.pylori 感染导致这两种细胞因子产生的机制尚不明确。新近研究发现,一种胞浆NOD 样受体(NODlike receptor,NLR)——NLRP3 炎症复合体(Inflammasome)能够识别多种病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)及内源性危险信号,通过活化胱天蛋白酶(caspase)-1,调控IL-1β、IL-18 和IL-33 等促炎细胞因子的加工及活化,参与天然免疫系统的激活[8,9]。活性氧(Reactive oxygen species,ROS)是目前公认的激活NLRP3 炎症复合体的关键分子之一[10]。本研究以人单核细胞THP-1 来源的巨噬细胞与H.pylori 为共培养模型,采用RNA 干扰等方法,探讨H.pylori 是否通过激活NLRP3 炎症复合体诱导IL-1β 和IL-18的产生及ROS 在其中的作用。
1 材料与方法
1.1 材料 H.pylori SS1 菌株为本实验室保存;人单核细胞THP-1 细胞购于上海中科院细胞库;哥伦比亚琼脂培养基购自青岛海博生物技术有限公司;羊血购自贝瑞特生物公司;RPMI1640 培养基购自Hyclone 公司;胎牛血清购自四季青生物工程材料公司;Real-time PCR 所 用 引 物、TRIZOL 试 剂、UltraSYBR Mixture 购于北京康为世纪公司;LPS(E-.coli O55:B5)、乙酰半胱氨酸(NAC)、二氯荧光素二乙酸酯(DCFH-DA)购于Sigma 公司;人IL-1β ELISA 试剂盒购于武汉博士德生物公司;人IL-18 ELISA 试剂盒购于北京欣博盛生物公司;一抗(兔抗-caspase-1)购于CST 公司;二抗(羊抗兔IgG)购于Invitrogen 公司。
1.2 方法
1.2.1 细菌-细胞共培养模型的建立及分组 收集对数生长期THP-1 细胞,按1×106个细胞/孔将细胞接种于6 孔培养板中,每孔加入1 ml 培养液,加入终浓度为100 nmol/L 的佛波酯(PMA)在恒温箱(37℃、5% CO2)中孵育48 h,诱导分化为巨噬细胞。用无菌PBS(pH7.2)收集哥伦比亚血琼脂平板上的H.pylori 菌体,调整菌液浓度至1×109CFU/ml。按照不同感染复数(MOI,细菌数:细胞数)200 ∶1、100 ∶1、50 ∶1、25 ∶1加入H.pylori 菌液刺激,共培养0、3、6、12、24 h 后用庆大霉素杀死胞外的细菌,收集培养上清及细胞用于后续实验。同时设立阴性对照(仅用培养基培养)及阳性对照(100 ng/ml LPS 处理)。
1.2.2 ELISA 检测共培养细胞上清中IL-1β、IL-18含量[11]采用双抗体夹心法,按照ELISA 试剂盒说明书进行操作。
1.2.3 FCM 检测胞内ROS 水平 THP-1 细胞分组同前,设立对照组,每孔设3 个平行孔,用H.pylori刺激THP-1 细胞3、6、12、24 h。去除培养基,加入1 ml 浓度为10 μmol/L 的DCFH-DA,37℃细胞培养箱内孵育30 min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。收集各时间点细胞,上流式细胞仪(FCM)检测荧光的强弱(激发光488 nm,发射光525 nm)。
1.2.4 实时荧光定量PCR(Real-time PCR)检测细胞中NLRP3、caspase-1 mRNA 的表达 于不同时间点收集共培养细胞,TRIZOL 法提取细胞总RNA,逆转录后采用SYBR Green Ⅰ染料法进行Real-time PCR。反应条件:95℃10 min,95℃15 s,60℃ 1 min,共40 个循环。分析基因扩增的平均Ct 值,以GAPDH 为内参(174 bp),按照公式2-ΔΔct进行相对定量计算。各种基因引物序列及扩增产物大小见表1。
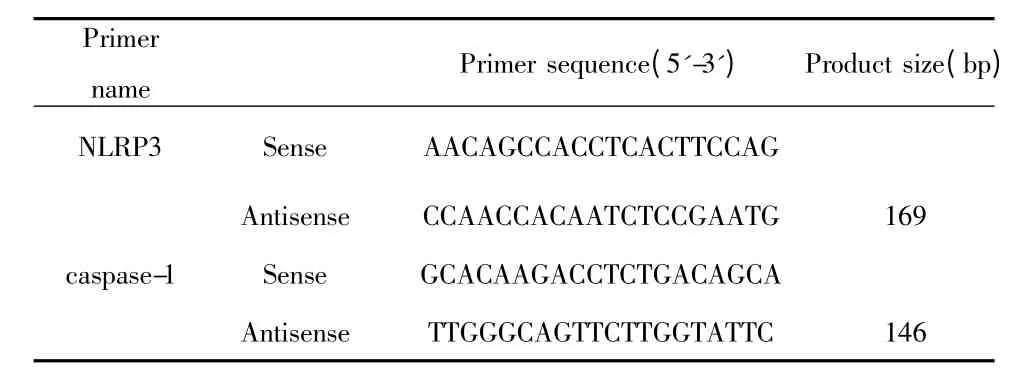
表1 各基因引物序列及扩增产物大小Tab.1 Primers sequences and size of amiplification products
1.2.5 Western blot 检测细胞中活性caspase-1 的表达 细胞分组及处理同前,提取细胞总蛋白并定量后按常规操作步骤进行[11]。caspase-1 和β-actin 一抗终浓度均为1 ∶1 000。实验重复3 次。
1.2.6 NAC 预处理对NLRP3、caspase-1 mRNA 表达及细胞因子分泌的影响 设未清除组和清除组,每组设3 个平行孔。清除组将25 mmol/L ROS 清除剂NAC 加至细胞培养板中孵育30 min,之后两组细胞用H.pylori 刺激3、6、12、24 h,收集培养上清及细胞,进行Real-time PCR、ELISA 检测。
1.2.7 NLRP3-siRNA 对H.pylori 诱导的IL-1β 和IL-18 分泌的影响 查找人NLRP3 mRNA 基因序列,根据siRNA 的设计原则设计引物(Sense:5'-GGUGUUGGAAUUAGACAAC-3';Antisense:5'-GUUGUCUAAUUCCAACACC-3')并交由广州锐博生物科技有限公司合成。实验分为3 组:①野生组(WT组,未干扰组);②control-siRNA 组(阴性干扰序列对照组:Sense:UUCUCCGAACGUGUCACGUTT,Antisense:ACGUGACACGUUCGGAGGAGAATT);③NLRP3-siRNA 组。6 孔板中PMA 诱导THP-1 细胞分化为巨噬细胞;用Opti-MEM 培养基按1 ∶50(v/v)分别稀释Lipofectamine 2000 和siRNA(储存液浓度:20 μmol/L),再将二者稀释液按照1 ∶1(v/v)轻轻混匀,室温静置20 min 以形成siRNA-Lipofectamine 2000 混合液;将500 μl 混合液加入各孔并将培养基补足到2 ml,细胞置培养箱培养4 h 后更换新鲜培养基继续培养24 h,Real-time PCR 确认干扰效果。siRNA 转染后24 h 用H.pylori 刺激,于12 h 收集细胞培养上清,ELISA 检测细胞因子含量。
1.3 统计学处理 SPSS18.0 软件分析。实验数据以±s 表示,组内采用独立样本t 检验,组间均数比较采用重复测量数据的方差分析。
2 结果
2.1 H.pylori 诱导THP-1 细胞分泌IL-1β 和IL-18 不同MOI 的H.pylori 刺激THP-1 细胞12 h,能以剂量依赖性方式诱导细胞产生IL-1β 和IL-18。当MOI 为100 ∶1 时细胞因子的产生达最大值,但当MOI 为200 ∶1 时,细胞因子产生减少(结果未显示),故选用MOI 为100 ∶1进行后续试验。与阴性对照(正常THP-1 细胞)相比,H.pylori 刺激能显著增加IL-1β 和IL-18 的含量,二者分别在6、12 h 达到最高(图1A、B)。
2.2 H.pylori 诱导THP-1 细胞产生胞内ROS 与阴性对照相比,H.pylori 刺激导致DCF 荧光值增加,于刺激后6 h 达到高峰(图2),提示H.pylori 能诱导胞内ROS 的产生。
2.3 H.pylori 增加THP-1 细胞NLRP3、caspase-1 mRNA 的表达 Real-time PCR 结果(图3)表明,H.pylori 刺激能增加THP-1 细胞NLRP3、caspase-1 mRNA 的表达,NLRP3 和caspase-1 mRNA 均于3 h开始升高,6 h 达到高峰。
2.4 H.pylori 诱导THP-1 细胞caspase-1 活化 Western blot 结果显示(图4),H.pylori 刺激组可检测到caspase-1 p10 (10 kD)亚单位的产生,其表达在3 h 开始升高,6 h 达到最高,NAC 作用后各组含量都下降。
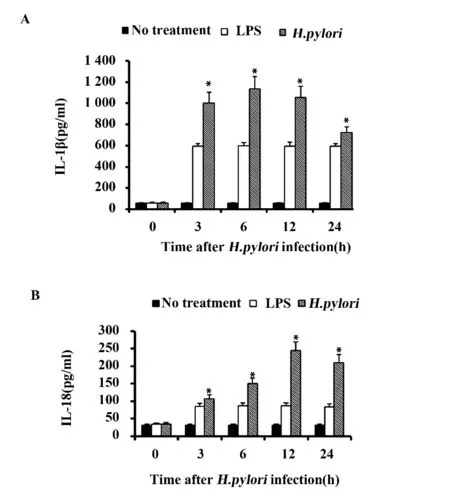
图1 H.pylori 诱导THP-1 细胞产生IL-1β 和IL-18Fig.1 H.pylori induced production of IL-1β and IL-18 in THP-1 cells

图2 H.pylori 诱导THP-1 细胞后ROS 的荧光强度值Fig.2 Mean fluorescence intensity values of ROS in THP-1 cells induced by H.pylori
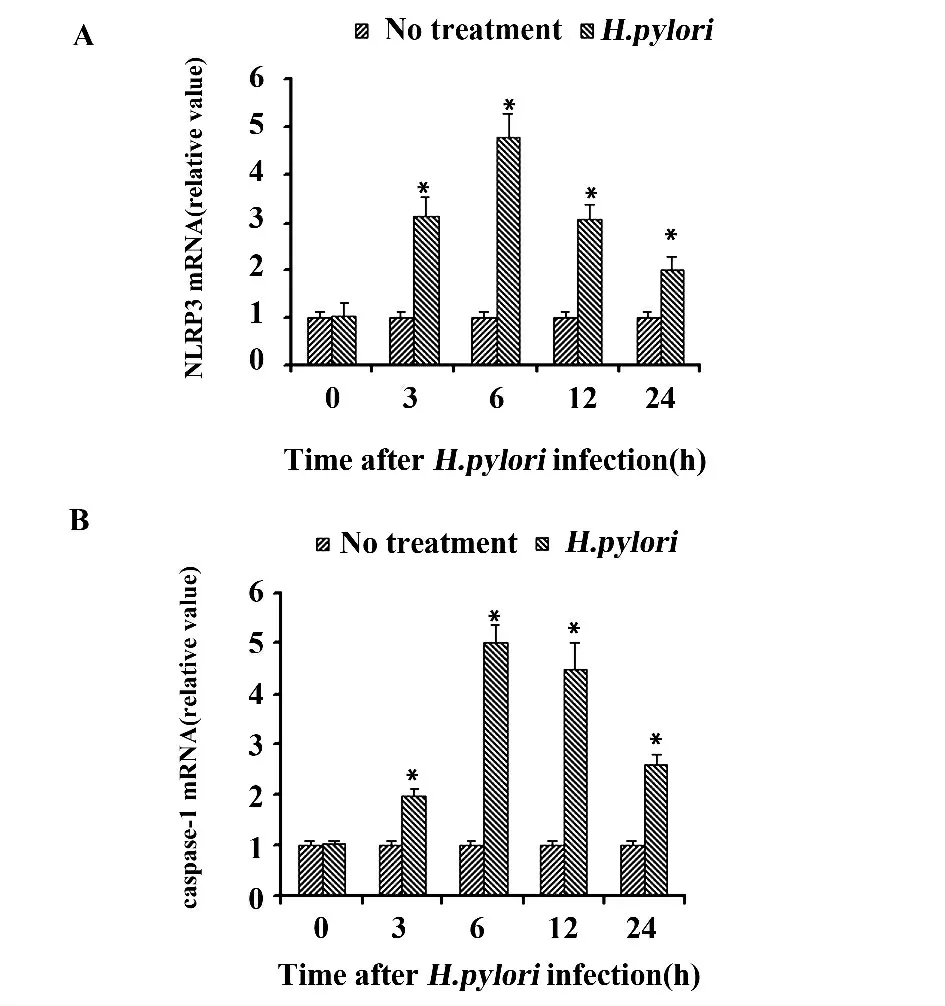
图3 Real-time PCR 检测细胞中NLRP3 和caspase-1 mRNA 的表达Fig.3 Expression of NLRP3 and caspase-1 mRNA detected by Real-time PCR

图4 Western blot 检测各组THP-1 细胞中caspase-1 蛋白的表达Fig.4 Expression of caspase-1 protein in THP-1 cells detected by Western blot
2.5 NAC 预处理对NLRP3、caspase-1 mRNA 表达及细胞因子分泌的影响 如图5 所示,NAC 预处理THP-1 细 胞30 min 明 显 降 低H.pylori 诱 导 的NLRP3 和caspase-1 mRNA 的表达;NAC 预处理同样抑制了H.pylori 诱导的IL-1β、IL-18 的产生(图6),提示ROS 在H.pylori 诱导的NLRP3 炎症复合体激活中发挥着重要作用。
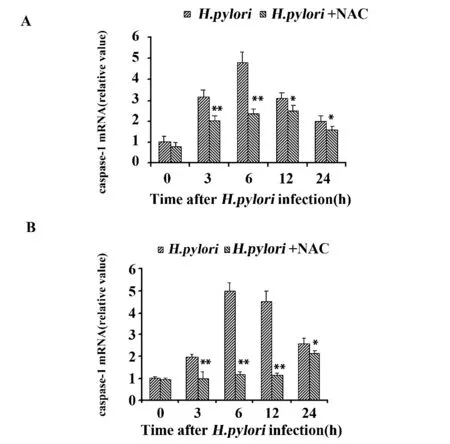
图5 NAC 对H.pylori 诱 导 的THP-1 细 胞NLRP3、caspase-1 mRNA 表达的影响Fig.5 Effects of NAC on NLRP3 and caspase-1 mRNA expression in THP-1 cells induced by H.pylori
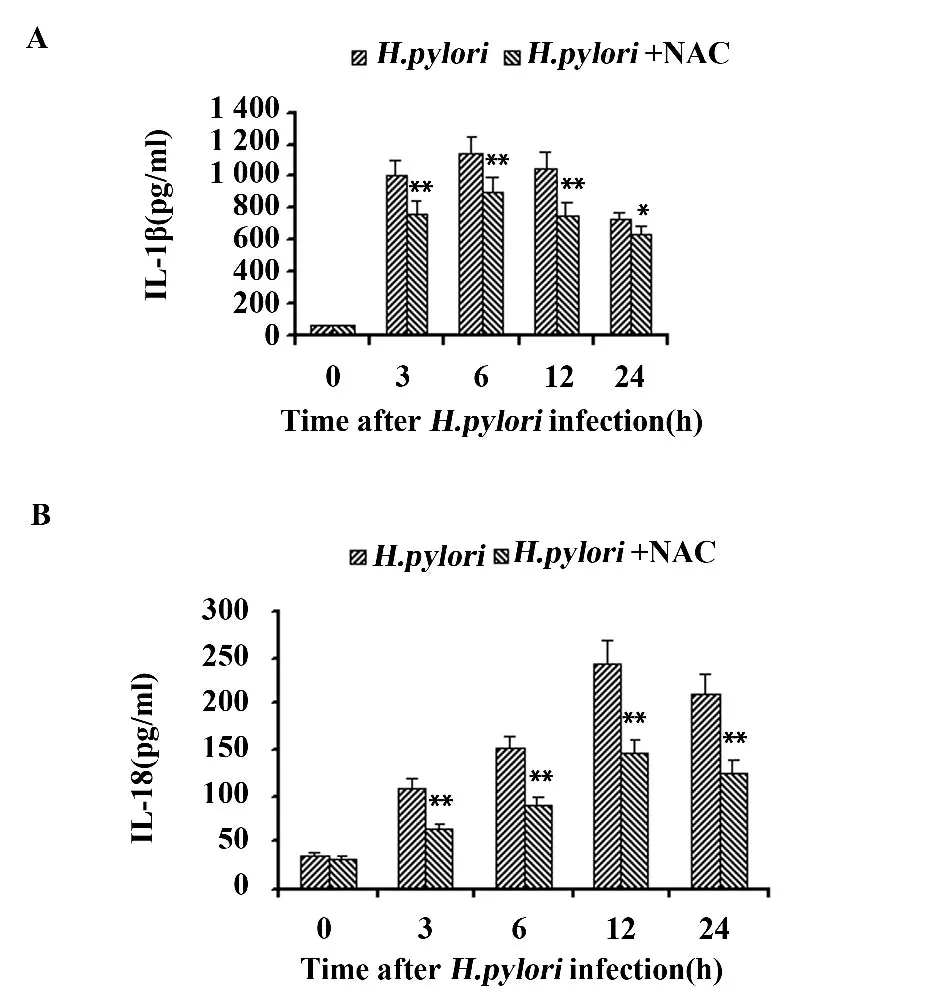
图6 NAC 对H.pylori 诱导的THP-1 细胞分泌细胞因子的影响Fig.6 Effects of NAC on cytokines secretion from THP-1 cells induced by H.pylori
2.6 NLRP3-siRNA 对H.pylori 诱导的IL-1β 和IL-18 分泌的影响 与WT 组及control-siRNA(ctrlsiRNA)组相比,NLRP3-siRNA 明显抑制了NLRP3 mRNA 表达(图7)。在用H.pylori 刺激的情况下,NLRP3-siRNA 组IL-1β 和IL-18 的含量与对照组相比都有所降低,分别减少30.08%、58.94%(图8A、B)。

图7 NLRP3-siRNA 对THP-1 细胞NLRP3 mRNA 表达水平的影响Fig.7 Effects of NLRP3-siRNA on NLRP3 mRNA expression in THP-1 cells

图8 NLRP3-siRNA 对H.pylori 诱导THP-1 细胞产生IL-1β 和IL-18 的影响Fig.8 Effects of NLRP3-siRNA on IL-1β and IL-18 production in H.pylori-infected THP-1 cells
3 讨论
促炎细胞因子在H.pylori 致病和疾病进展(如胃癌)中发挥着重要作用[1]。已有研究报道,H.pylori 感染阳性胃黏膜标本中促炎细胞因子,如IL-1β、IL-6 和TNF-α 等的表达高于H.pylori 阴性者[2-5,12]。IL-1β 具有广泛的生物学效应,可在局部或全身发挥作用,如发热、参与炎症反应等。IL-1β与IL-1RⅠ结合,通过一系列激酶磷酸化步骤激活NF-κB、MAPK 途径,从而促进炎症相关基因表达[2,3]。IL-1β 和IL-18 能够增加其他细胞因子如IL-6 和TNF-α 的表达,上调黏附分子的表达并促进炎性细胞的渗出[2-5]。已有研究表明,H.pylori 能诱导DC、巨噬细胞和单核细胞分泌IL-1β 和IL-18[4,6,7],但其机制尚不明确。IL-1β 和IL-18 的加工和分泌需要caspase-1 的活化,而caspase-1 活化受到胞内多蛋白复合物——NLRP3 等炎症复合体的调控[9]。不少研究证实,NLRP3 炎症小体是引发各种炎症反应的新机制,在多种病毒、细菌、真菌感染性炎症以及痛风、关节炎、动脉粥样病变等非感染性炎症的发生和发展中均发挥了重要作用[8-10]。
关于NLRP3 炎症复合体在抗H.pylori 感染中的作用目前已有少量报道。Benoit 等[13]的研究表明,ASC 基因缺失小鼠宿主免疫反应降低、H.pylori定植增多,提示ASC 参与H.pylori 感染的免疫应答,但H.pylori 是否以NLRP3 和ASC 协同依赖性的方式诱导caspase-1 的活化和IL-1β 分泌及其活化机制尚不清楚。H.pylori 能够在体内及体外培养的DC 中活化caspase-1,诱导IL-1β 和IL-18 的成熟和分泌[14]。最近的一项研究显示,H.pylori 感染小鼠DC 经NLRP3 炎症复合体激活caspase-1 而诱导成熟IL-1β 的分泌[15]。我们的前期研究亦发现,H.pylori 感染C57BL/6 小鼠胃黏膜组织中NLRP3信号通路相关分子表达增高,提示NLRP3 炎症复合体可能参与H.pylori 的防御与清除[11]。
巨噬细胞在H.pylori 感染引起的炎症反应中发挥着重要的作用[16]。例如,来自于H.pylori 感染儿童胃黏膜活检标本中存在大量巨噬细胞的浸润,巨噬细胞数量与IL-1β、IL-18 等细胞因子转录水平及胃炎严重性密切相关[17]。本研究结果显示:H.pylori 能够激活THP-1 源性巨噬细胞NLRP3 炎症复合体,并以时间和剂量依赖性方式诱导THP-1细胞产生IL-1β 和IL-18,这两种细胞因子的分泌增多可能与NLRP3 炎症复合体活化有关。
NLRP3 炎症小体的激活需要两个信号[18]。首先需要由信号1 促进NLRP3 的转录,使其表达量增加到足以激活炎症小体,这个信号可以由一些先天性免疫受体、细胞因子受体等提供,通过NF-κB 途径促进NLRP3 以及IL-1β 前体(pro-IL-1β)的转录;接着在信号2(如:ROS 产生、钾离子外流及组织蛋白酶B 释放等)的刺激下,NLRP3 与ASC 以及caspase-1 组装成炎症小体,并导致成熟IL-1β 的切割和释放。
H.pylori 能够诱导胞内ROS 的产生,这可能是H.pylori 感染导致宿主损伤的重要机制之一[19,20]。本研究结果表明:H.pylori 能够诱导THP-1 细胞产生胞内ROS,NAC 预处理显著抑制H.pylori 诱导的NLRP3 炎症复合体成份的表达以及这两种细胞因子的产生,提示ROS 在H.pylori/NLRP3 活化/细胞因子分泌轴中发挥着重要的作用。进一步的研究结果表明:NLRP3 基因沉默明显抑制了H.pylori 诱导的IL-1β 和IL-18 分泌,表明NLRP3 是H.pylori 诱导细胞因子产生所必需。
综上所述,本研究显示H.pylori 通过激活NLRP3 炎症复合体诱导THP-1 细胞分泌IL-1β 和IL-18;ROS 是H.pylori 诱导NLRP3 炎症复合体活化的关键上游信号。NLRP3 炎症小体在H.pylori 感染炎症反应中的具体作用机制仍不清楚,NLRP3 如何识别H.pylori、如何触发炎症反应以及该过程是否涉及两种或多种激活途径的协同作用尚待深入研究。
[1]Lamb A,Chen LF.Role of the Helicobacter pylori-induced inflammatory response in the development of gastric cancer[J].J Cell Biochem,2013,114(3):491-497.
[2]Shigematsu Y,Niwa T,Rehnberg E,et al.Interleukin-1β induced by Helicobacter pylori infection enhances mouse gastric carcinogenesis[J].Cancer Lett,2013,340(1):141-147.
[3]Mitchell PJ,Afzali B,Fazekasova H,et al.Helicobacter pylori induces in-vivo expansion of human regulatory T cells through stimulating interleukin-1β production by dendritic cells[J].Clin Exp Immunol,2012,170(3):300-309.
[4]Yamauchi K,Choi IJ,Lu H,et al.Regulation of IL-18 in Helicobacter pylori infection[J].J Immunol,2008,180(2):1207-1216.
[5]Shimada M,Ando T,Peek RM,et al.Helicobacter pylori infection upregulates interleukin-18 production from gastric epithelial cells[J].Eur J Gastroenterol Hepatol,2008,20(12):1144-1150.
[6]Fehlings M,Drobbe L,Moos V,et al.Comparative analysis of the interaction of Helicobacter pylori with human dendritic cells,macrophages,and monocytes[J].Infect Immun,2012,80 (8):2724-2734.
[7]Basak C,Pathak SK,Bhattacharyya A,et al.NF-kappaB-and C/EBPbeta-driven interleukin-1beta gene expression and PAK1-mediated caspase-1 activation play essential roles in interleukin-1beta release from Helicobacter pylori lipopolysaccharide-stimulated macrophages[J].J Biol Chem,2005,280(6):4279-4288.
[8]Bauernfeind F,Hornung V.Of inflammasomes and pathogens--sensing of microbes by the inflammasome[J].EMBO Mol Med,2013,5(6):814-826.
[9]Schroder K,Tschopp J.The inflammasomes[J].Cell,2010,140(6):821-832.
[10]Latz E,Xiao TS,Stutz A.Activation and regulation of the inflammasomes[J].Nat Rev Immunol,2013,13(6):397-411.
[11]蒋建烨,刘 胜,罗晶晶,等.NLRP3 炎症小体信号通路分子在幽门螺杆菌感染小鼠模型中的表达研究[J].细胞与分子免疫学杂志,2013,29(8):785-788.
[12]Figueiredo CA,Marques CR,Costa Rdos S,et al.Cytokines,cytokine gene polymorphisms and Helicobacter pylori infection:friend or foe?[J].World J Gastroenterol,2014,20(18):5235-5243.
[13]Benoit BN,Kobayashi M,Kawakubo M,et al.Role of ASC in the mouse model of Helicobacter pylori infection[J].J Histochem Cytochem,2009,57(4):327-338.
[14]Hitzler I,Sayi A,Kohler E,et al.Caspase-1 has both proinflammatory and regulatory properties in Helicobacter infections,which are differentially mediated by its substrates IL-1beta and IL-18[J].J Immunol,2012,188(8):3594-3602.
[15]Kim DJ,Park JH,Franchi L,et al.The Cag pathogenicity island and interaction between TLR2/NOD2 and NLRP3 regulate IL-1β production in Helicobacter pylori infected dendritic cells[J].Eur J Immunol,2013,43(10):2650-2658.
[16]Gobert AP,Cheng Y,Wang JY,et al.Helicobacter pylori induces macrophage apoptosis by activation of arginase II[J].J Immunol,2002,168(9):4692-4700.
[17]Dzierzanowska-Fangrat K,Michalkiewicz J,Cielecka-Kuszyk J,et al.Enhanced gastric IL-18 mRNA expression in Helicobacter pylori-infected children is associated with macrophage infiltration,IL-8,and IL-1 beta mRNA expression[J].Eur J Gastroenterol Hepatol,2008,20(4):314-319.
[18]Bauernfeind FG,Horvath G,Stutz A,et al.Cutting edge:NF-kappaB activating pattern recognition and cytokine receptors license NLRP3 inflammasome activation by regulating NLRP3 expression[J].J Immunol,2009,183(2):787-791.
[19]Ding SZ,Minohara Y,Fan XJ,et al.Helicobacter pylori infection induces oxidative stress and programmed cell death in human gastric epithelial cells[J].Infect Immun,2007,75(8):4030-4039.
[20]Luo JJ,Li CY,Liu S,et al.Overexpression of Helicobacter pylori VacA N-terminal fragment induces proinflammatory cytokine expression and apoptosis in human monocytic cell line through activation of NF-κB[J].Can J Microbiol,2013,59(8):523-533.