高脂饮食对小鼠内脏脂肪组织T 细胞亚群的影响①
邹倩蕾 张国俊 郑雅静 张会杰 王瑞芳 王 侠 宋向凤 王 辉
(新乡医学院,新乡 453003)
随着人们生活方式和生活习惯的改变,全世界范围内肥胖相关疾病的发病率逐年增高[1]。WHO已将肥胖定位为一种重要的疾病,它已经成为世界范围内重要的公共卫生问题。肥胖伴随的局部及全身慢性低度炎症状态已经得到研究者的广泛认可[2,3]。但目前关于炎症的发生机制还未完全阐明。研究显示,肥胖的脂肪组织内有多种免疫细胞的聚集[4]。T 淋巴细胞是适应性免疫的主要细胞,根据功能和产生的细胞因子的不同,T 细胞可分为CD4+T 细胞和CD8+T 细胞,而CD4+T 细胞又分为Th1、Th2 和Th17 细胞[5,6]。本研究通过高脂饮食诱导C57BL/6 小鼠建立肥胖模型,探讨脂肪组织内Th1、Th2 和Th17 细胞的变化规律,为肥胖症及其相关疾病的机制研究奠定基础。
1 材料与方法
1.1 材料 C57BL/6 雄性小鼠购于北京维通利华公司;动物高脂饲料购于美国Research Diets Inc,含60%脂肪热能;小鼠TNF-α ELISA 试剂盒、Th1、Th2和Th17 细胞流式检测试剂盒购于美国BD 公司;胶原酶Ⅱ购于Sigma 公司。
1.2 高脂饮食诱导小鼠肥胖模型的建立 5 周龄的雄性C57BL/6 小鼠常规饲养在清洁级动物房,保持温度在22℃~26℃,湿度40%~60%,随意自由饮水和进食。适应性喂养1 周后将小鼠随机分为2组,高脂组(HFD,给予高脂饲料)和对照组(NFD,给予标准饲料),喂养16 周,每天观察,每周称重。
1.3 血脂及葡萄糖的测定 高脂饮食16 周后眼球采血分离血浆,用全自动生化分析仪检测总胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和血糖(GLU)的含量。
1.4 内脏脂肪含量和免疫器官指数的测定 高脂饮食16 周后,颈椎脱臼法处死小鼠,打开腹腔,游离附睾垫脂肪组织和肾周脂肪组织,称取重量,计算内脏脂肪系数:附睾垫脂肪湿重/体重,肾周脂肪湿量/体重;同时剪取脾脏和胸腺,称重并计算指数:脾脏重量/体重,胸腺重量/体重。
1.5 脂肪组织内细胞的分离及流式测定 取小鼠附睾垫脂肪组织,剪碎后加入1 mg/ml 的Ⅱ型胶原酶,37℃消化2 h,1 000 r/min 离心10 min 后取沉淀中的细胞,用PBS 洗涤2 次后加入RPMI1640 完全培养液(10% 胎牛血清),同时加入PMA(终浓度100 ng/ml)、Ionomycin(终浓度1 μg/ml)和TPI,37℃培养5 h,分别用CD4、CD8、CD3、Th1、Th2、Th17 抗体孵育后进行流式检测。
1.6 血清TNF-α 的测定 采用ELISA 试剂盒测定血清中TNF-α 的含量,操作按说明书进行。
2 结果
2.1 高脂饮食对小鼠体重及体重增加的影响 高脂饮食16 周后小鼠的体重从(19.9±0.20)g 增加到(48.4±3.28)g,而对照组小鼠体重从(19.8±0.62)g增加到(32.0±1.42)g,高脂组小鼠体重平均增加了(28.2±2.50)g,对照组小鼠平均增加了(12.2±1.46)g,两组之间对比有显著的统计学意义(P <0.01)。
2.2 高脂饮食对小鼠体内脂肪含量的影响 与正常对照组相比,高脂饮食16 周的小鼠附睾脂肪重量是对照组的4.8 倍左右,肾周脂肪重量是对照组的6.7 倍左右,脂肪指数也显著不同,脾脏指数有增大的趋势,胸腺指数有缩小的趋势,但两组间未见显著差别(图1)。
2.3 高脂饮食对小鼠脂代谢的影响 由图2 可知,高脂饮食16 周后小鼠血清中CHOL、TG、HDL 和LDL 含量较对照组均明显增高,但TG 增加相对较少,HDL/LDL 比值无明显变化。
2.4 高脂饮食对小鼠附睾垫脂肪组织内T 淋巴细胞的影响 高脂饮食16 周后小鼠脂肪组织内CD3+、CD4+和CD8+T 淋巴细胞数均较对照组有所增高,其中CD8+T 淋巴细胞增多最显著,进一步分析CD4+T 淋巴细胞的亚群组成比例发现,高脂饮食组小鼠脂肪组织内Th1 和Th17 T 淋巴细胞与对照组相比显著增多,而Th2 细胞未见显著差别(图3)。
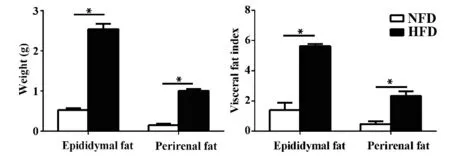
图1 高脂饮食对小鼠内脏脂肪含量的影响Fig.1 Effect of high fat diet on mice visceral fat
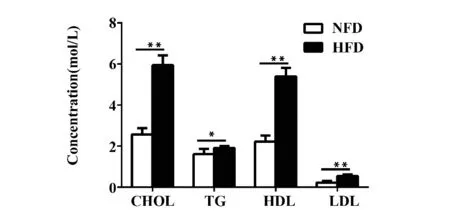
图2 高脂饮食对小鼠血脂水平的影响Fig.2 Effect of high fat diet on mice blood lipids
2.5 高脂饮食对小鼠血清中血糖和TNF-α 产生的影响 高脂饮食16周后小鼠外周血血糖水平达到(10.10± 0.58)mmol/L,显著高于对照组的(6.4±0.44)mmol/L,同样TNF-α 的水平也比对照组明显增高,是对照组的4.7 倍[(23.24±7.38)pg/ml vs(109.36±16.41)pg/ml],差异具有统计学意义。
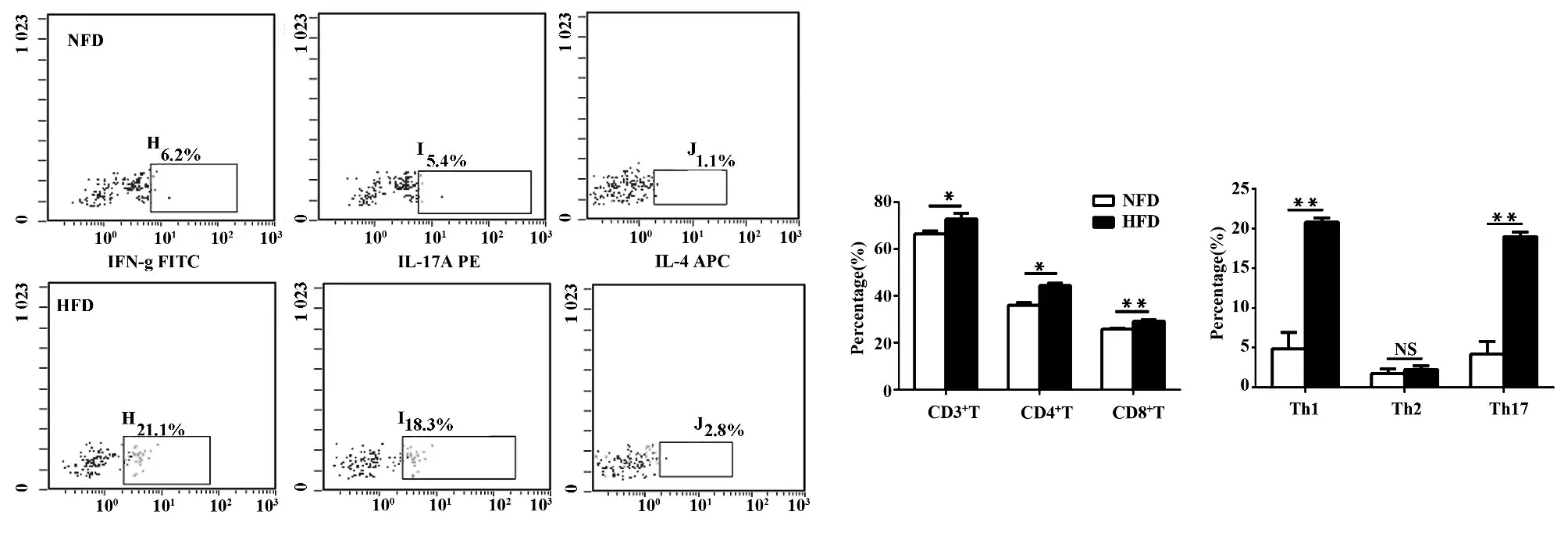
图3 高脂饮食对小鼠附睾脂肪组织内T 淋巴细胞的影响Fig.3 Effect of high fat diet on T lymphocyte in mice epididymal fat tissue
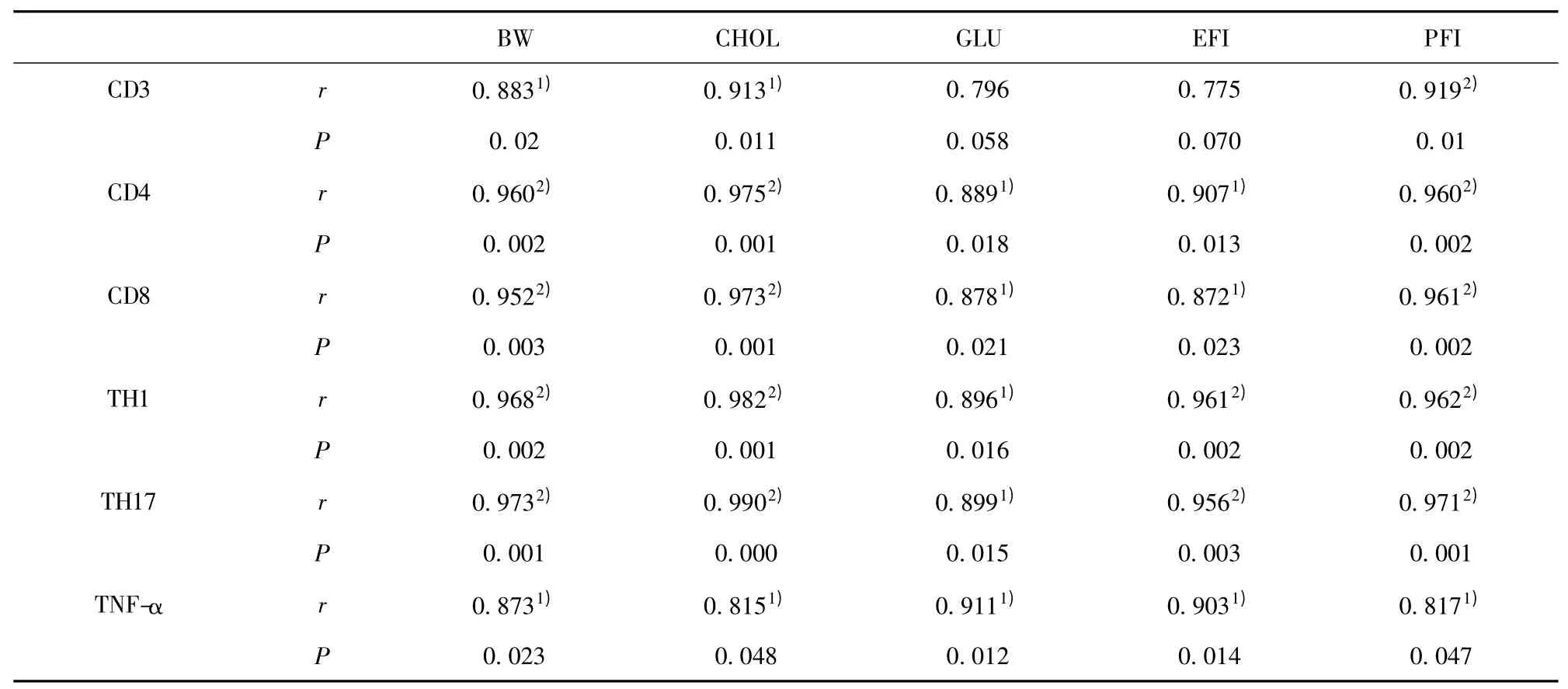
表1 T 细胞亚群及TNF-α 与体重、内脏脂肪指数、葡萄糖和胆固醇的相关性分析Tab.1 Analysis on correlation between T cell subsets,TNF-α and body weight (BW),cholesterol (GHOL),Glucose(GLU),epididymis fat index (EFI)and perirenal fat index (PFI)
2.6 各指标间的相关性分析 综合以上结果,我们对肥胖的指标、血脂和T 细胞亚群变化做了相关性分析。结果发现小鼠脂肪中CD4+T 细胞、CD8+T 细胞、Th1、Th17、TNF-α 与体重、附睾脂肪指数、肾周脂肪指数、血中总胆固醇、葡萄糖均呈极显著的正相关(表1)。
3 讨论
目前肥胖已经成为现代社会影响人类健康的重要因素之一,越来越多的研究证明许多疾病与肥胖密切相关,如Ⅱ型糖尿病、心脏病、脂肪肝、动脉粥样硬化、癌症等,因此对肥胖的研究已经成为研究热点[7,8]。高脂饮食诱导肥胖是常用的肥胖动物模型,本研究中,我们首先用高脂饮食诱导C57BL/6雄性小鼠建立肥胖动物模型,结果显示高脂饮食16周后,小鼠的体重和血脂与对照组相比显著升高,平均体重是对照组的1.5 倍,增加的体重是普通饮食组的2.3 倍。体重的增加主要出现在内脏脂肪和皮下脂肪的增多,一般认为,内脏脂肪在疾病的发生中扮演了重要角色[9]。我们的结果显示了高脂组的附睾脂肪垫重量、肾周脂肪重量以及与体重之比明显高于正常对照组,说明高脂饮食可诱导小鼠内脏脂肪的增加,引起腹型肥胖的发生。
肥胖伴随的局部及全身慢性低度炎症状态是多种疾病发生的重要原因[10]。脂肪组织内有多种免疫细胞的聚集,如巨噬细胞、中性粒细胞、T 细胞、B细胞、NKT 细胞、嗜酸性粒细胞、肥大细胞等等[11,12]。随着肥胖的发生,这些免疫细胞的种类和数量均发生了变化,如巨噬细胞由M2 型转变成M1型[13]。T 淋巴细胞是适应性免疫应答的主要细胞,具有很大的异质性。在2009 年有三个小组分别在遗传性肥胖小鼠模型和高脂饮食诱导的肥胖小鼠中证明了脂肪组织中浸润的T 细胞对胰岛素抵抗起着关键的作用[14-16]。我们在高脂饮食诱导的小鼠肥胖模型中没有检测到免疫器官胸腺和脾脏指数的改变,同时外周血中的T 淋巴细胞也未发生显著的改变,但用流式检测到了附睾垫脂肪组织内T 淋巴细胞的异常情况,CD3+、CD4+和CD8+T 淋巴细胞数均较普通饮食组有所增高,其中CD8+T 淋巴细胞增多最显著,这和之前的研究一致[17,18]。CD4+T 细胞根据功能和产生的细胞因子的不同又分为Th 细胞和Treg 细胞,Th 细胞又分为Th1 细胞、Th2 细胞和Th17 细胞,我们进一步分析CD4+T 淋巴细胞的亚群组成比例变化,发现高脂饮食组脂肪组织内出现Th1 和Th17 T 淋巴细胞极化现象。有研究提示,Th1 和Th17 细胞通过产生IL-1、IL-6 和TNFα 和RANTES 增强巨噬细胞的前炎症功能,促进脂肪组织炎症,而Th2 通过调节巨噬细胞使其分化为抗炎的M2 细胞而抑制炎症的发生[19]。随着肥胖的进展,脂肪组织内T 淋巴细胞的增多早于巨噬细胞[15],这提示T 细胞亚群的改变或再分布可能影响巨噬细胞的功能,从而诱导炎症的发生。
总之,我们的研究证明了高脂饮食可以诱导小鼠腹型肥胖的发生,增加脂肪组织内CD3+、CD4+和CD8+T 淋巴细胞数量,使CD4+T 细胞朝向Th1 和Th17 方向极化,这为肥胖诱导局部炎症的发生提供了理论基础。
[1]Frederick CB,Snellman K,Putnam RD.Increasing socioeconomic disparities in adolescent obesity[J].Proc Natl Acad Sci USA,2014,111(4):1338-1342.
[2]Fuentes EFF,Vilahur G,Badimon L,et al.Mechanisms of chronic state of inflammation as mediators that link obese adipose tissue and metabolic syndrome [J].Mediat Inflamm,2013,2013:136584.
[3]Ye J,Gao Z,Yin J,et al.Hypoxia is a potential risk factor for chronic inflammation and adiponectin reduction in adipose tissue of ob/ob and dietary obese mice[J].Am J Physiol Endocrinol Metab,2007,293(4):E1118-E1128.
[4]Schipper HS,Prakken B,Kalkhoven E,et al.Adipose tissueresident immune cells:key players in immunometabolism[J].Trends Endocrinol Metab,2012,23(8):407-415.
[5]Harrington LE,Mangan PR,Weaver CT.Expanding the effector CD4 T-cell repertoire:the Th17 lineage[J].Curr Opin Immunol,2006,18(3):349-356.
[6]Tong ZH,Shi HZ.Subpopulations of helper T lymphocytes in tuberculous pleurisy[J].Tuberculosis (Edinb),2013,93(3):279-284.
[7]Hursting SD.Minireview:the year in obesity and cancer[J].Mol Endocrinol,2012,26(12):1961-1966.
[8]Wang ZNT.Inflammation,a link between obesity and cardiovascular disease[J].Mediat Inflamm,2010,2010:535918.
[9]Giralt M,Villarroya F.White,brown,beige/brite:different adipose cells for different functions?[J].Endocrinology,2013,154(9):2992-3000.
[10]Emanuela FGM,Marco de R,Maria Paola L,et al.Inflammation as a link between obesity and metabolic syndrome[J].J Nutr Metab,2012,2012:476380.
[11]Patel PS,Buras ED,Balasubramanyam A.The role of the immune system in obesity and insulin resistance[J].J Obes,2013,2013:616193.
[12]Mathis D.Immunological goings-on in visceral adipose tissue[J].Cell Metab,2013,17(6):851-859.
[13]Kaminski DA,Randall TD.Adaptive immunity and adipose tissue biology[J].Trends Immunol,2010,31(10):384-390.
[14]Feuerer M,Herrero L,Cipolletta D,et al.Lean,but not obese,fat is enriched for a unique population of regulatory T cells that affect metabolic parameters[J].Nat Med,2009,15(8):930-939.
[15]Nishimura S,Manabe I,Nagasaki M,et al.CD8+effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity[J].Nat Med,2009,15(8):914-920.
[16]Winer S,Chan Y,Paltser G,et al.Normalization of obesity-associated insulin resistance through immunotherapy[J].Nat Med,2009,15(8):921-929.
[17]Jiang E,Perrard XD,Yang D,et al.Essential role of CD11a in CD8+T-cell accumulation and activation in adipose tissue[J].Arterioscler Thromb Vasc Biol,2014,34(1):34-43.
[18]Yang H,Youm YH,Vandanmagsar B,et al.Obesity increases the production of proinflammatory mediators from adipose tissue T cells and compromises TCR repertoire diversity:implications for systemic inflammation and insulin resistance[J].J Immunol,2010,185(3):1836-1845.
[19]Rocha VZ,Folco EJ,Sukhova G,et al.Interferon-gamma,a Th1 cytokine,regulates fat inflammation:a role for adaptive immunity in obesity[J].Circ Res,2008,103(5):467-476.