胚胎干细胞源性树突状细胞对同源性神经前体细胞脑内移植耐受诱导
梅爱农 张苏明 (福建医科大学省立临床医学院干部特诊一科,福建省临床老年病研究所,福建省立医院老年医学研究室,福州350001)
据研究,不成熟树突状细胞(immature dendritic cell,imDC)和免疫抑制因子作用下的耐受性树突状细胞(Tolerogenic DC,TDC)能诱导抗原特异性耐受[1],另外研究表明干细胞或其衍生细胞如神经前体细胞(Neural progenitor cell,NPC),在特定的移植背景下会诱发机体的免疫反应,提示这类细胞移植仍然需要考虑移植排斥反应[2]。为此,本研究试图利用胚胎干细胞源性树突状细胞(esDCs)来诱导针对同源性干细胞来源物比如NPCs 的免疫耐受,因为研究表明esDCs 可能与传统骨髓源性imDC 一样具有致耐受性[3,4]。研究中将利用胚胎干细胞来源的两种细胞NPCs 和esDCs 的联合移植,来观察esDCs 对局部免疫细胞浸润、细胞因子的偏移、外周淋巴系统的增殖性以及对NPC 细胞脑内存活的影响。
1 材料与方法
1.1 动物及材料 实验动物:6~8 周龄健康Sprague-Dawley 大鼠,体重180~220 g,随机分成2组,每组18 只,购自华中科技大学同济医学院动物试验中心。主要仪器:倒置相差荧光显微镜(Olympus CK40)、CO2培养箱(Heraeus)、流式细胞计数仪(BD Pharmingen)、酶标测定仪、凝胶成像分析系统(BioRad)、PCR 仪(Biometra)、SW-CJ 标准型超净工作台(苏州安泰空气技术有限公司)、江湾Ⅰ型C 鼠脑立体定位仪等。主要材料及试剂:pCXhrGFP ES-D3 ESCs、ES-D3 ESCs、SNL 细胞系来自同济医院神经内科试验室;DMEM、DMEM/F12 培养基、胎牛血清、100×N2-supplement、50×B27 supplement、rm-bFGF(Gibco、Bibco BRL);纤维连接蛋白(Fn)、烟酰胺、β-巯基乙醇(Sigma);100×ITS 培养液(Hyclone);人白血病抑制因子(LIF)、兔抗Cy3-Nestin (Chemicon);rmIL-2、rmIFN-γ、rmGM-CSF、rmIL-3(Peprotech);四甲基偶氮唑蓝(MTT)(Amresco);丝裂霉素C(Kyowa Hakka Kogyo Co.Lid);鼠抗FITC-MHC-Ⅰ、FITC-MHC-Ⅱ、CD4、CD8;兔FITCCD11c、PE-CD80、PE-CD83、PE-CD86(BD Pharmingen);鼠抗ED1(CD68)(Serotec);羊抗小鼠IgM 二抗、DAB 染色试剂盒(北京中杉金桥有限公司);Trizol 试剂盒(Omega Bio-tek,Inc);cDNA 逆转录试剂盒、PCR 扩增试剂盒(Fermentas,USA)。
1.2 试验方法
1.2.1 pCX-hrGFP ES-D3 向NPCs 诱导分化 pCX-hrGFP ES-D3 用LIF 条件培养基(1%L-谷氨酰胺,1%β-巯基乙醇,1%青-链霉素溶液,1%非必需氨基酸,DMEM 培养液,20 ng/ml LIF)悬浮,于0.1%明胶包被的无滋养层的塑料培养瓶中,置37℃、5%CO2饱和湿度温箱中培养。待细胞团长满瓶底的80%后,倒掉培养基,Trypsin/EDTA 消化、离心细胞后将单细胞悬液加入ES 完全培养基(LIF 条件培养基去除LIF)重新悬浮,调整细胞密度至1×105ml-1,按照(2~2.5)×104/cm2接种到低黏性细菌培养皿,加入ES 完全培养基,置37℃、5%CO2饱和湿度温箱中连续培养4 d,细胞由接种时的单细胞长成悬浮的圆形细胞团,即拟胚体(EBs)。收集第4天的EBs 转移到新的25 cm 普通培养瓶,添加ES 完全培养基,置37℃、5%CO2饱和湿度温箱中培养24 h,待EBs 完全贴壁后轻轻倒掉培养基。加入无血清ITSF 培养基(5 mg/L insulin,50 μg/L 转铁蛋白,30 mmol/L 硒酸钠,5 mg/L 纤维连接蛋白),连续培养6 d。Trypsin/EDTA 消化,离心后加入诱导培养基(1% N2-supplement,1% B27-supplement,TrisbFGF 50 μl/50 ml DMEM/F12 培养基)将细胞重新悬浮,按照(1.5~2)×104/cm2接种到新的培养瓶。添加诱导培养基连续培养6 d,隔天换液一次。Nestin 荧光染色免疫细胞化学鉴定。
1.2.2 esDCs 的体外诱导培养及基本生物学特征检测 将在无滋养层培养瓶中培养的ESCs 消化成单细胞悬液,按照(2~2.5)×104/cm2接种到低黏性细菌培养皿,加入EB 全培养基(20%FBS DMEM+1%L-谷氨酰胺、β-巯基乙醇、非必需氨基酸、丙酮酸钠、青-链霉素溶液),置37℃,5%CO2饱和湿度温箱中连续培养4 d,细胞由接种时的单细胞长成悬浮的圆形细胞团,即EBs。EBs 培养第14 天后转入组织培养瓶,加入EB 全培养液置37℃、5%CO2饱和湿度温箱中培养过夜。待EBs 完全黏附后,换入esDC诱导培养基(终浓度为25 ng/ml rmGM-CSF 与10 ng/ml rmIL-3 的EB 全培养基)置37℃、5%CO2饱和湿度温箱中培养,隔日换液,连续培养10 d。加入0.05%胰蛋白酶-EDTA 消化细胞3~5 min,加入等量培养液中止消化,并用吸管反复吹打成单细胞悬液。离心后弃上清,加入esDC 诱导培养基重悬细胞密度至1×106ml-1,按照(3~5)×105cell 接种到新的培养瓶置37℃、5%CO2饱和湿度温箱中培养。隔日换液,细胞长满80%瓶底后传代。流失细胞术检测初始型细胞及脂多糖诱导下MHCⅠ、MHCⅡ、CD11c、CD80、CD86 表达。
1.2.3 NPCs 体内移植实验 健康Sprague-Dawley大鼠,体重180~220 g,随机分成esDCs 预处理组及对照组2 组,每组18 只。采用改良的线拴法制作MCAo 模型:用6%水合氯醛麻醉大鼠,颈部正中切口结扎颈外动脉,再在颈总动脉下方穿过2 条结扎线,将近心的线扎紧后,在两线之间的血管壁上剪一个小口,插入0.2 mm 钝头钓鱼线缓慢推进,感轻微阻力时停止,即为缺血开始,扎紧结扎线并固定插线,缺血1 h 后再将插线拔除,让缺血区得到再灌注,为再灌注开始。NPC 脑内移植:MCAo 术后1周,esDCs 预处理组动物尾静脉输注5×105esDCs,对照组注射PBS。术后2 周,两组大鼠用6%水合氯醛麻醉,按Pellegrino 鼠脑定向图谱行侧脑室注射定位(以前囟为零点,前囟前0.7 mm,旁开2.0 mm,深3.5 mm)5×104pCX-hrGFP NPCs。
1.2.4 ED1、CD4、CD8 免疫组织化学检测(n=6)移植2 周后(缺血后4 周)动物6%的水合氯醛(5 ml/kg)腹腔注射麻醉,4%的多聚甲醛灌注。取脑后于4%的多聚甲醛后固定6 h。于移植针孔后1 mm 连续冰冻切片,厚度20 μm,隔3 取1,分别对应行鼠抗ED1、CD4、CD8 免疫组化检测。切片于3%过氧化氢孵育5 min,正常羊血清室温下孵育20 min,吸干,加一抗抗体(1 ∶200)4℃过夜,按试剂盒说明书加入二抗,DAB 染色后常规脱水、透明、封片、镜检并照相。对应每个分子检测,每只大鼠取3张切片,40×物镜下在纹状区随机选取4 个视野进行计数,统计3 张切片共12 个视野细胞总数(面积0.72 mm2)。
1.2.5 淋巴细胞再刺激(n=6) 移植2 周后(缺血后4 周)分离培养颈部淋巴细胞,调整密度5×105ml-1。NPCs 细胞计数按5×104NPCs(200 μl)/孔接种96 孔板,用含FGF 的诱导培养基在37℃、5%CO2培养5 d,在淋巴细胞加入之前2 h 加入丝裂霉素C(20 μg/ml)灭活。每只动物取4 份5×104(100 μl)淋巴细胞分别加入3 个灭活的NPC 孔样和一个空白孔样,同时加入重组rIL-2 刺激淋巴细胞增殖,另外预留一个灭活NPC 的孔样,加入100 μl 含FGF的诱导培养基。每只动物都对应3 个“淋巴细胞+NPC”孔样,计为“LN”;1 个“淋巴细胞”孔样,记为“L”;1 个“NPC”孔样,记为“N”。在37℃、5%CO2饱和湿度温箱中孵育68 h。在培养结束前4~6 h培养板各孔加入1 mg/ml MTT 液在37℃、5%CO2饱和湿度温箱中培养6 h 后,每孔加入2%SDS 过夜培养。用酶标测定仪测570 nm 下的吸光度(A570),淋巴细胞增殖指数(PI)用以下公式进行校正:PI=(LNA570nm-NA570 nm)/LA570 nm。
1.2.6 NPC 存活率的测定(n=6,来源同淋巴细胞再刺激亚组) 移植2 周后(缺血后4 周),每组取6 只断头取脑,Oct 包埋,放入-70℃冰箱保存。连续冠状面冰冻切片,厚度20 μm,隔10 取1。收集穿刺点前后约±0.5 mm 的脑片,观察区(Regions of interest,ROI)为同侧的纹状体,在荧光显微镜×40 物镜下取10 个对等的视野进行GFP 阳性细胞计数。
1.2.7 IFN-γ、IL-10 mRNA的逆转录PCR(RTPCR)(n=6) ①引物设计与合成:(北京三博远志生物技术公司合成),内参β-actin (GenBank NM-031144):正义:5'-CATCCAGGCTGTGTTGTCCC-3',反义:5'-TTCTCTTTAATGTCACGCACG-3'(240 bp);IFN-γ:正 义5'-GCTGGTGAATCACTCTGATG-3',反义5'-GCCAAGGCACACTGATTGAA-3' (360 bp);IL-10:正义5'-AAACTCATTCATGGCCTTGTA-3',反义5'-TGCCTTCAGTCAAGTGAAGACT-3' (346 bp)。②总RNA 的提取:移植2 周后(缺血后4 周),每组各取6 只大鼠快速断头处死,取缺血侧皮层和纹状体50~100 mg 样本,加入1 ml RNA 裂解液之后按每1 ml RNA 匀浆加265 μl 氯仿的比例,向Ep 管里加入适量氯仿,离心后按每1 ml RNAsolv 加入670 μl 异丙醇的比例向转移的水相中加入异丙醇以沉淀RNA。离心后用75% 乙醇沉淀RNA 沉淀之后将RNA 重新溶解于Rnase-free 水中(50 μl)测定RNA浓度和纯度,选取纯度达标的样本放入-70℃保存。③逆转录反应:逆转录反应体系总体积为20 μl。将总RNA 反应混合物(总RNA 10 μl,0.5 μg/ml OdT 1 μl,去离子水1 μl)加入200 μl Ep 管内,置于70℃5 min,立刻冰水浴2 min 然后短暂离心。按照下列顺序将各试剂加入上述管中:5×反转录buffer 4 μl;RNA 酶抑制剂1 μl;10 mmol/L dNTP Mix 2 μl;MMLV 逆转录酶(200 U/μl)1 μl,将反应混合物置于42℃60 min,在70℃加热10 min 终止上述反应,然后置于冰上。以上合成的第一链cDNA 可以直接地用于PCR 扩增。④PCR 扩增:将下列反应物[10×PCR 缓冲液2 μl;2 mmol/L dNTP mix 2 μl;引物Ⅰ(10 μm)2 μl;引物Ⅱ(10 μm)2 μl;Taq DNA 聚合酶0.1 μl;25 mmol/L MgCl21.2 μl;DNA 模板5 μl;消毒双蒸水5.7 μl]加入一个PCR 管中,置于冰上,混匀,短暂离心。将样本加入热循环仪进行PCR 扩增:初始变性过程-95℃3 min;变性、退火、延伸30个循环,变性为94℃1 min,退火为55℃40 s,延伸为70℃1 min;终末延伸过程:70℃ 10 min。⑤PCR产物的检测:PCR 产物行1.5%琼脂糖凝胶电泳,观察照相,采用凝胶成像分析系统对条带进行半定量分析,根据样品条带光密度值与β-actin 光密度值之比确定样品mRNA 含量。
2 结果
2.1 细胞准备和鉴定 自pCX-hrGFP ES-D3 mESCs 诱导分化的NPCs 常规消化后在bFGF 条件下保持扩增能力,并倾向于集落生长。Nestin 荧光染色显示双标阳性率为94% 以上,表明经pCXhrGFP 转染的ES-D3 mESCs 能稳定表达GFP 绿色荧光并在传代和诱导分化中保持荧光的稳定性。是可靠的细胞分子标记物,可用于移植中的细胞计数标记(图1A~C)。

图1 细胞准备和鉴定:分别自pCX-hrGFP ES-D3 诱导NPCs 和ES-D3 诱导esDCsFig.1 Cell preparation and identification:differentiation of NPCs from pCX-hrGFP ES-D3 and esDCs from ES-D3 respectively
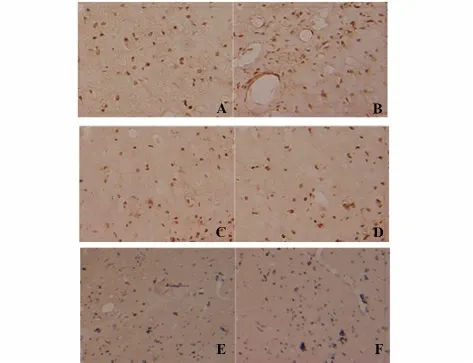
图2 两组大鼠纹状体CD4,CD8,ED1 阳性细胞浸润Fig.2 Infiltration of CD4,CD8,ED1 positive cells in striatum in two groups

图3 两组大鼠缺血脑组织炎症因子表达Fig.3 Expression of inflammatory cytokine in ischemia lesions in two groups
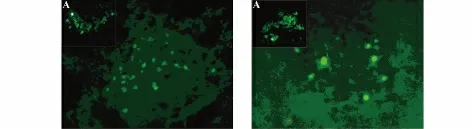
图4 两组大鼠缺血纹状体移植细胞存活比较Fig.4 Survivals of grafted cells in ischemic striatum in two groups

图5 两组大鼠颈部淋巴细胞增殖指数比较Fig.5 Proliferation indexes (PI) of cervical T lymphocytes in two groups
ES-D3 mESCs 经“拟胚体”在细胞因子GM-CSF及IL-3 的作用下诱生的esDCs 呈集落性生长,运用传统的消化方法将这些细胞继代培养,在GM-CSF及IL-3 存在的情况下能继续扩增,而保持一致的细胞形态。流式细胞术显示这些细胞CD11chiMHCⅠmoMHCⅡloCD80loCD83loCD86lo。在连续培养超过4 周的时间后,细胞表面的MHCⅡ分子及共刺激分子CD80 等的表达未见上调。但esDCs 细胞在脂多糖的作用下,逐渐向成熟DC 形态发展,在培养的第4 天,大量的钉状突起从周围生长出,呈现出老化成熟表型(CD11chiMHCⅠhiMHCⅡhiCD80mo),表现出强烈的诱导淋巴细胞增殖能力(图1D~F)。如上说明本法获得的细胞为与mDC 类似的树突状细胞,但通常状态下呈不成熟表型。
2.2 ED1、CD4、CD8 免疫组织化学检测 在预处理组纹状体,CD4+细胞浸润显著低于对照组(134.7±36.2 vs 198.8±59.6,P<0.01),但CD8+细胞(145.8±45.4 vs 134.3±39.0,P>0.05)及ED1+细胞(298.8±75.9 vs 302.2±88.5,P>0.05),二组间没有明显差别,提示esDCs 预处理主要对CD4+细胞浸润产生影响(图2)。
2.3 IL-10 与IFN-γ mRNA RT-PCR 半定量RTPCR 检测缺血脑组织IL-10 与IFN-γ mRNA,预处理组与对照组缺血皮质IL-10(1.147±0.260 vs 1.264±0.119,P >0.05)、IFN-γ(1.697±0.273 vs 1.829±0.250,P>0.05)表达无显著差异(图3);提示esDCs预处理不改变缺血脑组织局部炎性细胞因子水平。
2.4 NPC 存活率测定 NPC 移植之后2 周,进行存活GFP 阳性细胞计数。参与计数的脑片在注射点前后约±0.5 mm 之内。两组共收集符合要求的脑片52 张,计数每张脑片中10 个40×视野中GFP阳性细胞,成团细胞以单个细胞表示。统计结果示预处理组M=58.0(Qd=36.5,0~121),对照组M=35(Qd=36.5,0~124),U=209.5,Z=-2.353,P=0.019,两组之间有统计学差异(图4)。
2.5 颈淋巴细胞增殖实验 移植两周后取颈淋巴细胞与NPC 共培养,预处理组与对照组PI 值无显著差别(1.245±0.211 vs 1.331±0.235,P >0.05)(图5)。提示esDCs 预处理对NPCs 再刺激下颈淋巴细胞反应无影响。
3 讨论
目前认为,干细胞及其衍生物比如NPCs 脑内移植会引起局部免疫反应,因此干细胞的移植有必要考虑克服移植排斥反应[2,5]。在临床移植中,通常运用免疫抑制剂如环孢素A 来削弱免疫排斥反应,这种方法的主要缺点是药物的毒副作用大,因此移植免疫耐受策略一直颇受研究者重视,其中,以树突状细胞(DC)为平台的免疫耐受策略是研究的焦点。研究证实,经典树突状细胞如骨髓DC 及类浆细胞DC,具有捕获和交叉递呈外源抗原的能力,能用于诱导抗原特异性耐受[1]。在这种基本范例下,不成熟DC(imDC)表面MHC 分子及共刺激分子的低表达能诱导T 细胞耐受,相反成熟DC(mDC)高表达这些免疫分子从而激发效应T 细胞。imDC 不管是供体的还是受者的,都可以增加致耐受性[6]。
esDC 是一种直接从胚胎干细胞诱导分化的树突状细胞,这种细胞在形态、表型、功能方面均与传统髓源性imDC 相似,具备强大的抗原摄取提呈能力,但在缺乏足够刺激因子的作用下总是处于稳定的不成熟状态(Immature status),因而是很有前途的耐受性DC[3,4]。因此,本研究试图建立一种全新的干细胞移植耐受诱导模式,即从同一ESCs 中分别诱导出治疗性细胞如NPCs 和耐受性DC 如esDCs,然后将二者同时或先后注入受者体内诱导完全意义上的耐受。这种模式的基本原理是利用imDC 的“致耐受性”以及与同源治疗细胞的“表型同一性”,巧妙地将以前耐受诱导途径中的“抗原同递过程”消除。
本研究发现,esDC 预处理的大鼠,不能减少局部CD8+细胞和ED1+细胞的浸润,但能减少局部CD4+细胞的浸润,同时增加移植细胞的存活率,提示esDC 可能通过减少局部CD4+T 细胞反应诱导免疫耐受。据研究,NPCs 引起的脑内免疫反应模式主要为CD4+T细胞反应,可能与其表面MHCⅡ类分子在局部炎症环境下表达上调有关[5,7,8],因此,esDC 对CD4+T 细胞的抑制作用有助于移植物存活。据研究调节性T 细胞(Treg)在髓源性imDC 耐受诱导中起主要作用[1]。imDC 可以通过细胞-细胞途径启动先天性CD4+CD25+Tregs,后者可以对活化的反应性T 细胞“再教育”,通过“连锁抑制”和“感染性耐受”等机制诱导T 细胞耐受[9,10]。imDC也可作用于诱导型CD4+CD25-Tregs(Tr1),通过释放“耐受性”细胞因子如IL-10、TGF-β 等起免疫抑制作用[11,12]。据研究这两种调节性T 细胞归巢部位不太一致,细胞因子依赖性CD4+CD25-Tr1 细胞倾向迁徙入炎症地点如梗塞或移植部位,而自然发生CD4+CD25+Tregs 主要在淋巴器官中发现[9],在本研究中,移植局部脑组织IL-10 抑制性细胞因子或刺激性细胞因子IFN-γ 等较对照组没有明显改变,提示Tr1 在esDCs 耐受诱导中可能不起主导作用,esDCs 诱导耐受作用是否与CD4+CD25+Tregs 有关,甚至是否主要通过“中枢”机制,即在受者胸腺模拟自身APCs 的阴性选择机制克隆性删除抗原特异性的T 细胞而起作用,有待进一步研究。另外,本研究发现esDCs 预处理的大鼠局部淋巴细胞对NPCs 再刺激反应与对照组无差别,可能主要与NPCs 体外环境下MHCⅡ类分子表达微弱有关[7,8];也可能与耐受性DCs 来源有关,比如研究表明供者来源的DC 需通过受者DC 的间接提呈才能发挥耐受诱导作用[13]。
因此,本研究初步探讨了esDCs 对同源性移植物的耐受诱导机制,发现esDCs 可能通过减少局部CD4+T 细胞反应提高移植物的存活率,但具体机制需要进一步研究,比如需要相应的细胞跟踪实验明确esDC 在体内的迁徙及存活状态,同时需要对移植局部及引流淋巴结T 细胞进行更细致的表型分型及与esDCs 的相互作用做深入探讨。
[1]Manicassamy S and Pulendran B.Dendritic cell control of tolerogenic responses[J].Immunol Rev,2011,241(1):206-227.
[2]Johansson S,Price J and Modo M.Effect of inflammatory cytokines on major histocompatibility complex expression and differentiation of human neural stem/progenitor cells[J].Stem Cells,2008,26:2444-2454.
[3]梅爱农,王 珏,杨 津,等.拟胚体直接诱导胚胎干细胞向树突状细胞的分化[J].现代免疫学,2010,30(2):105-109.
[4]Fairchild PJ,Nolan KF,Cartland S.Embryonic stem cells:a novel source of dendritic cells for clinical applications[J].Int Immunopharmacol,2005,5:13-21.
[5]梅爱农,张苏明.胚胎干细胞源性神经前体细胞移植脑缺血大鼠局部细胞的免疫反应[J].中国组织工程研究,2014,18(14):2191-2199.
[6]Moreau A,Varey E,Bériou G,et al.Tolerogenic dendritic cells and negative vaccination in transplantation:from rodents to clinical trials[J].Front Immunol,2012,3:218.
[7]梅爱农,张苏明,常丽英,等.鼠胚胎干细胞及其衍生神经前体细胞的免疫原性检测[J].神经损伤与功能重建,2008,3(5):307-309.
[8]梅爱农,张苏明,常丽英,等.脑缺血大鼠神经前体细胞侧脑室移植后颈淋巴细胞的增殖性[J].神经损伤与功能重建,2008,3(6):428.
[9]Walsh PT,Taylor DK,Turka LA.Tregs and transplantation tolerance[J].J Clin Invest,2004,114:1398-1403.
[10]Waldmann H,Cobbold S.Regulating the immune response to transplants:a role for CD4+regulatory cells?[J].Immunity,2001,14:399-406.
[11]Jonuleit H,Schmitt E,Schuler G,et al.Induction of interleukin 10-producing,nonproliferating CD4+T cells with regulatory properties by repetitive stimulation with allogeneic immature human dendritic cells[J].J Exp Med,2000,192:1213-1222.
[12]Levings MK,Gregori S,Tresoldi E,et al.Differentiation of Tr1 cells by immature dendritic cells requires IL-10 but not CD25+CD4+Tr cells[J].Blood,2005,105:1162-1169.
[13]Wang Z,Divito SJ,Shufesky WJ,et al.Dendritic cell therapies in transplantation revisited:deletion of recipient DCs deters the effect of therapeutic DCs[J].Am J Transplant,2012,12(6):1398-1408.