钠氢交换蛋白1抑制剂对脓毒症大鼠心脏损伤保护作用的实验研究*
第四军医大学学员旅(西安710032) 白 威 杨薛康 杨国栋
·论著·基础研究·
钠氢交换蛋白1抑制剂对脓毒症大鼠心脏损伤保护作用的实验研究*
第四军医大学学员旅(西安710032) 白 威 杨薛康△杨国栋▲
目的:观察钠氢交换蛋白1(NHE1)抑制剂对脓毒症大鼠心脏损伤的保护作用,并探讨其可能的机制。方法:常规方法建立大鼠脓毒症模型诱导心脏损伤。将SD大鼠随机分为对照组、脓毒症组和脓毒症治疗组,脓毒症治疗组大鼠注射钠氢交换蛋白1抑制剂卡立泊来德,于伤后12h检测左心室射血分数(LVEF)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、肿瘤坏死因子α(TNF-α)、白细胞介素6 (IL-6)、髓过氧化物酶(MPO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和丙二醛(MDA)水平。结果:脓毒症组大鼠心脏损伤高于对照组,表现为LVEF值的降低和LDH、CK、CK-MB值的升高;脓毒症治疗组大鼠较脓毒症组大鼠心脏损伤显著减轻,表现为LVEF值的升高、LDH、CK和CK-MB值的降低。脓毒症组大鼠TNF-α、IL-6、MPO、MDA水平高于对照组,差异有统计学意义;SOD、CAT和GPx水平低于对照组,差异有统计学意义;治疗组大鼠上述指标显著改善。结论:NHE1抑制显著减轻脓毒症诱导的心脏损伤,其部分机制可能是抑制了炎症反应和氧化应激。
钠氢交换蛋白(NHE)是一种跨膜蛋白,广泛存在于所有真核细胞表面,其主要功能是将一个氢离子泵出细胞外,并获得一个钠离子,进而调节细胞内外的pH值[1-3]。NHE1是NHE家族中表达最为广泛的亚型,在组织的缺血再灌注损伤过程中发挥着关键作用[2-4]。我们前期的研究发现,NHE1在烧伤后显著活化,NHE1的抑制剂卡立泊来德可以减轻烧伤后的心脏损伤[5]。脓毒症是烧伤后常见的严重并发症,在本实验中,我们建立大鼠脓毒症模型,观察NHE1在脓毒症心脏损伤中的作用,并初步探讨其可能的机制。
材料和方法
1 实验材料 健康无特殊病原体级雄性SD大鼠70只,体质量200±25g,由第四军医大学实验动物中心提供,所有实验操作经第四军医大学实验动物伦理委员会批准。试剂:卡立泊来德(cariporide)为德国Hoechst公司产品,牛血清白蛋白、三羟甲基氨基甲烷、氯仿、甲醇、蔗糖、抗坏血酸、硫酸亚铁和四氯化碳等实验室常规试剂均为国产AR试剂。
2 方 法 ①动物分组及模型建立:大鼠适应性喂养1周后,并根据随机分组表法随机分为对照组(10只)、脓毒症组(30只)和脓毒症治疗组(30只)。以戊巴比妥钠(30mg/kg)腹腔注射麻醉,行腹正中切口,采用盲肠结扎穿孔术(CLP)复制脓毒症大鼠模型。对照组除不作环形结扎和针刺穿孔外,其余操作均与脓毒症组相同。脓毒症治疗组大鼠腹腔注射卡立泊来德(0.4mg/kg)1 ml;本实验中动物处置方法符合动物伦理学标准。②检测指标与方法:大鼠于伤后12h断头处死,另处死对照组大鼠。大鼠断头后立即取血,1000 r/min离心5min,分离血浆,-80℃保存备用。取大鼠心肌组织,加入9倍体积的等渗盐水制成匀浆,离心后取上清,-80℃保存检测以下指标。心脏功能指标:左心室射血分数(LVEF)使用超声心动图检测。心肌损伤指标:包括血清乳酸脱氢酶(LDH)、肌酸激酶(CK)和肌酸激酶同工酶(CK-MB),应用全自动生化分析仪(日本Olympus公司产品)检测。炎性指标:包括肿瘤坏死因子α(TNF-α)、白细胞介素6 (IL-6)和髓过氧化物酶(MPO),肿瘤坏死因子α(TNF-α)采用ELISA法检测,按上海森雄科技公司ELASA试剂盒说明书进行。氧化应激指标:包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)活性和丙二醛(MDA)含量,使用南京建成科技公司试剂盒检测。

结 果
1 NHE1抑制对脓毒症心脏损伤的影响 与对照组相比,脓毒症组大鼠LVEF值显著降低,差异有统计学意义(P<0.01);治疗组大鼠LVEF值显著高于脓毒症组,差异有统计学意义(P<0.01);另外,与对照组相比,脓毒症组大鼠血清LDH、CK及CK-MB值显著升高,差异有统计学意义(P<0.01),治疗组大鼠上述指标较脓毒症组显著降低,差异有统计学意义(P<0.01),见表1。
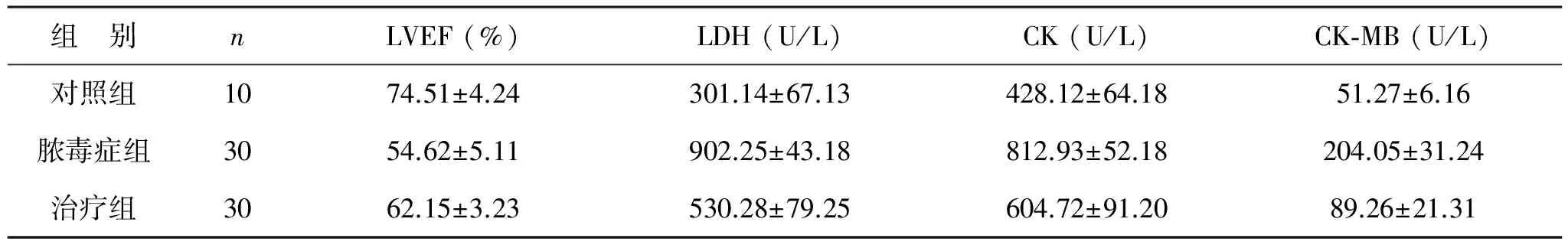
表1 3组大鼠LVEF、LDH、CK及CK-MB值变化
2 NHE1抑制对脓毒症后炎性因子表达的影响 与对照组相比,脓毒症组大鼠血清TNF-α、IL-6及MPO水平明显升高,差异有统计学意义(P<0.01);治疗组大鼠上述指标较脓毒症组显著降低,差异有统计学意义(P<0.01),见表2。脓毒症组大鼠心肌组织TNF-α、IL-6及MPO水平较对照组显著升高,差异有统计学意义(P<0.01);治疗组大鼠上述指标均低于脓毒症组,差异有统计学意义(P<0.01),见表3。
3 NHE1抑制对脓毒症后氧化损伤指标的影响 与对照组相比,脓毒症组大鼠血清SOD、CAT、GPx活性显著降低,MDA含量显著升高,差异有统计学意义(P<0.01);治疗组大鼠血清SOD、CAT、GPx活性较脓毒症组明显升高,MDA含量明显降低,差异有统计学意义(P<0.01)。脓毒症组大鼠心肌组织SOD、CAT、GPx活性低于对照组,MDA含量高于对照组,差异有统计学意义(P<0.01);而治疗组大鼠心肌组织SOD、CAT、GPx活性显著高于脓毒症组,MDA含量低于脓毒症组,差异有统计学意义(P<0.01),见表4、5。
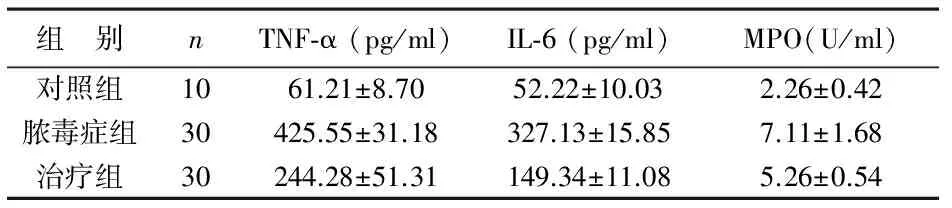
表2 3组大鼠血清TNF-α、IL-6及MPO水平变化
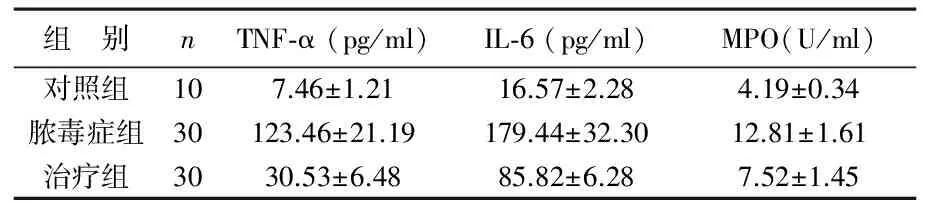
表3 3组大鼠心肌组织TNF-α、IL-6及MPO水平变化
讨 论
本实验发现NHE1抑制剂卡立泊来德显著减轻了脓毒症后的心脏损伤,表现为心功能的改善和心肌酶的降低,进一步证实了NHE1抑制对脓毒症后心脏损伤的保护作用,并对其机制进行了初步探讨。
虽然脓毒症后心脏损伤的机制尚不完全清楚,但越来越多的证据表明炎症反应和氧化应激均发挥着关键的作用[5-9]。近年的研究显示,NHE1可以调节炎症进程,NHE1活化可以促进中性粒细胞募集,并且诱导巨噬细胞活化。体内外实验均发现,NHE1的抑制剂可以显著抑制炎性因子的产生[10-11]。在本实验中,NHE1抑制显著减轻了心肌组织炎症反应和全身炎症反应。这说明NHE1抑制对脓毒症后心脏损伤的保护作用可能与其抗炎机制有关。

表4 3组大鼠血清SOD、CAT、GPx及MDA含量变化
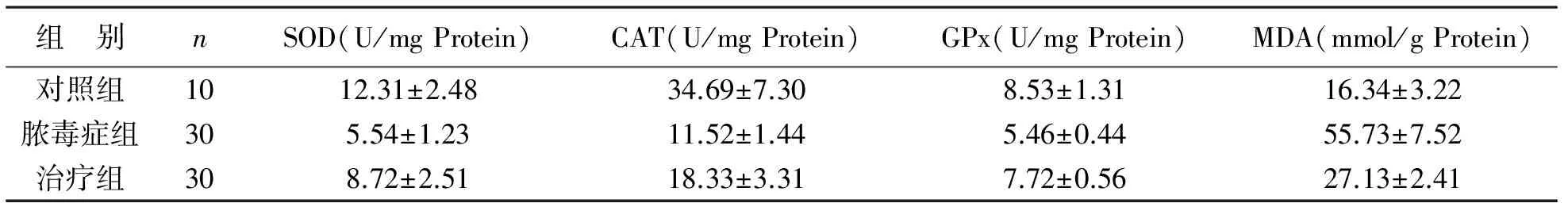
表5 3组大鼠心肌组织SOD、CAT、GPx及MDA含量变化
最新的研究还发现,NHE1在线粒体氧化应激过程中发挥着关键的作用,NHE1的抑制可以显著减轻活性氧的生成[12-14]。在本实验中,我们发现卡立泊来德减轻了脓毒症导致的氧化损伤,提高了抗氧化酶的含量,说明NHE1抑制显著减轻了脓毒症后的氧化应激,提示NHE1抑制对脓毒症后心脏损伤的保护作用也可能是对氧化应激的抑制所致。
NHE1参与脏器损伤的机制是复杂的。在缺血再灌注损伤过程中,NHE1的活化导致细胞内钠离子升高,进而活化钠钙泵,导致细胞内钙离子增加,进而引起钙离子介导的细胞凋亡和组织损伤[3-4]。而钙离子介导的细胞凋亡和组织损伤在脓毒症后的心肌损伤中同样发挥着重要作用[15]。本实验仅明确了NHE1在脓毒症后心脏损伤中的作用,探讨了其部分机制,进一步的研究还在继续。
综上,我们的研究发现NHE1的抑制显著减轻了脓毒症诱导的心脏损伤,其部分机制可能是通过抑制了炎症反应和氧化应激。
[1] Yang X, Wang D, Dong W,etal. Inhibition of Na+/H+exchanger 1 by 5-(N-ethyl-N-isopropyl) amiloride reduces hypoxia-induced hepatocellular carcinoma invasion and motility[J].Cancer Lett,2010,295(2):198-204.
[2] Wu D,Qi J,Dai H,etal. Resuscitation with Na+/H+exchanger inhibitor in traumatic haemorrhagic shock: cardiopulmonary performance, oxygen transport and tissue inflammation[J]. Clin Exp Pharmacol Physiol,2010,37:337-342.
[3] Fliegel L.The Na+/H+exchanger isoform 1[J].Int J Biochem Cell Biol,2005,37(1):33-37.
[4] Liu H,CalaPM,Anderson SE. Na+/H+exchange inhibition protects newborn heart from ischemia/reperfusion injury by limiting Na+dependent Ca2+overload[J].J Cardiovasc Pharmacol,2010,55(3):227-233.
[5] Yang X, Bai H, Cai W,etal.Inhibition of Na+/H+exchanger 1 by cariporide alleviates burn-induced multiple organ injury[J].J Surg Res,2013,185:797-804.
[6] Y-Hassan S, Settergren M, Henareh L. Sepsis-induced myocardial depression and takotsubo syndrome[J]. Acute Card Care,2014,16(3):102-109.
[7] Marchant DJ, Boyd JH, Lin DC,etal. Inflammation in myocardial diseases[J]. Circ Res,2012,110(1):126-144.
[8] Antonucci E,Fiaccadori E,Donadello K,etal. Myocardial depression in sepsis: from pathogenesis to clinical manifestations and treatment[J].J Crit Care,2014,29(4):500-511.
[9] Huet O.Dupic L,Harrois A,etal. Oxidative stress and endothelial dysfunction during sepsis[J]. Front Biosci (Landmark Ed),2011,16:1986-1995.
[10] De Vito P.The sodium/hydrogen exchanger:A possible mediator of immunity[J].Cell Immunol,2006,240(2):69-85.
[11] Shi Y, Kim D, Caldwell M,etal. The role of Na+/H+exchanger isoform 1 in inflammatory responses: maintaining H(t) homeostasis of immune cells[J].Adv Exp Med Biol,2013,961:411-418.
[12] Fantinelli JC,Cingolani HE,Mosca SM.Na+/H+exchanger inhibition at the onset of reperfusion decreases myocardial infarct size:Role of reactive oxygen species[J]. Cardiovasc Pathol,2006,15:179-184.
[13] Garciarena CD,Caldiz CI,Correa MV,etal.Na+/H+exchanger-1 inhibitors decrease myocardial superoxide production via direct mitochondrial action[J].J Appl Physiol,2008,105:1706-1713.
[14] Garciarena CD,Fantinelli JC,Caldiz CI,etal.Myocardial reperfusion injury:reactive oxygen species vs. NHE-1 reactivation[J].Cell Physiol Biochem,2011,27:13-22.
[15] Song HP,Zhang L,Dang YM,etal.The phosphatidylinositol 3-kinase-Akt pathway protects cardiomyocytes from ischaemic and hypoxic apoptosis via mitochondrial function[J].Clin Exp Pharmacol Physiol,2010,37(5-6):598-604.
(收稿:2015-04-20)
Study was designed to investigate the cardioprotective role of Na+/H+exchanger 1 (NHE1) inhibition after sepsis of rats
Fourth Military Medical University(Xi’an 710032)
Bai Wei Yang Xuekang Yang Guodong
Objective: This study was designed to investigate the cardioprotective role of Na+/H+exchanger 1 (NHE1) inhibition after sepsis, and explore the potential mechanisms.Methods: A common sepsis model was used to induce cardiac injury in rats. All rats were randomly divided into 3 groups:the control group, the sepsis group and the treatment group. Changes in left ventricular ejection fraction (LVEF), the lactate dehydrogenase (LDH), creatine kinase (CK), MB isoenzyme of creatine kinase (CK-MB), tumor necrosis factor (TNF-α),interleukin (IL-6),myeloperoxidase (MPO) activity, superoxidase dismutase (SOD), catalase (CAT),glutathione peroxidase (GPx) and malondialdehyde (MDA) were examined.Results: Sepsis resulted in significant cardiac injury, as manifested by lowered LVEF, increased serum LDH, CK and CK-MB, compared with the control group. NHE1 inhibition markedly alleviated cardiac injury. In addition, sepsis caused increased level of TNF-α、IL-6、MPO and MDA, and decreased of SOD、CAT and GPx, which were improved by NHE1 inhibition in treatment group.Conclusion: NHE1 inhibition alleviates sepsis-induced cardiac injury, possibly by inhibiting sepsis-induced oxidative stress and inflammation response.
Sepsis Heart injuries @Na+/H+exchanger 1
*国家自然科学基金资助项目(81201463)
脓毒症 心脏损伤 @钠氢交换蛋白1
R542.2
A
10.3969/j.issn.1000-7377.2015.06.001
△第四军医大学西京医院烧伤与皮肤外科
▲通讯作者:第四军医大学基础部生物化学与分子生物学教研室

