补肾化痰法影响骨髓间充质干细胞成骨分化的实验研究*
周亚娜,向 楠,陈 辉
(1.湖北省中医院,武汉 430061;2.湖北中医药大学,武汉 430065)
补肾化痰法影响骨髓间充质干细胞成骨分化的实验研究*
周亚娜1,向 楠2△,陈 辉2
(1.湖北省中医院,武汉 430061;2.湖北中医药大学,武汉 430065)
目的:研究补肾化痰法对BMSCs成骨分化的影响,探讨补肾化痰法治疗骨质疏松症的可能作用机制。方法:运用全骨髓贴壁法分离培养纯化Wsitar大鼠BMSCs,诱导BMSCs成骨分化,观察补肾中药、化痰中药和补肾化痰中药分别对BMSCs成骨分化后茜素红染色及定量、碱性磷酸酶(ALP)活性和骨钙素(OCN)mRNA表达影响。结果:补肾化痰中药能促进BMSCs成骨诱导后细胞体外钙化,提高细胞内ALP活性,上调OCN-mRNA表达。结论:补肾化痰法可以促进BMSCs向成骨细胞分化。
补肾化痰法;骨质疏松症;骨髓间充质干细胞;成骨分化
1 材料与方法
1.1 主要试剂与仪器
L-DMEM,美国Hyclone公司;胎牛血清(FBS),澳大利亚 Maverick公司;CD29-FITC、CD45-PE、CD44-FITC,美国 BioLegend公司;二甲基亚枫(DMSO)、地塞米松(DEX)、维生素C、β-甘油磷酸钠(β-GP),Invitrogen公司;RT-PCR 试剂盒,Fermentas公司;碱性磷酸酶染色液(BCIP/NBT),美国Maxim Biotech公司;蛋白定量的试剂盒(lowry 法),Bio Rad公司;FACSCalibur型流式细胞仪(美国Becton Dickinson公司)、PCR扩增仪(Biometra公司)、紫外分光光度计(上海精密科学仪器有限公司)。
1.2 中药干预液的配制
补肾化痰中药组:淫羊藿、补骨脂、全栝楼、红曲、山楂;补肾中药组:淫羊藿、补骨脂;化痰中药组:全栝楼、红曲、山楂。将上述各组中药复方经水煮、醇沉,浓缩成每毫升相当于原中药材1 g的药液,4℃冰箱保存备用。用前先用滤纸初滤,再用0.22 μm过滤除菌、分装,-20℃保存。
1.3 BMSCs分离、培养与传代
全骨髓贴壁法:6~8周龄雄性Wistar大鼠,分离大鼠两侧股骨和胫骨,用含10%FBS的L-DMEM完全培养基反复冲洗骨髓腔,将细胞悬液移至离心管,200 g离心5 min弃上清。用2~3 ml的 LDMEM完全培养基(含L-DMEM培养基,10%FBS,青霉素、链霉素各100 U/ml)重悬细胞,接种到T25塑料培养瓶中,置于37℃、5%CO2饱和湿度培养箱中培养。72 h后首次全量换液,弃去未贴壁细胞。此后每3 d更换培养基,待细胞80%~90%融合后,用0.25%胰蛋白酶消化传代。
1.4 BMSCs鉴定
形态学观察,即逐日用倒置相差显微镜观察细胞生长情况。BMSCs表面标志物的测定,即用流式细胞仪检测P4代BMSCs表面CD29、CD44和CD45单克隆抗体表达。
打开国家工商行政管理总局商标局的中国商标网,在相似商标国际分类第一类中,随意输入国内一线的化肥商标,就可以查询出诸多相似商标,多数仅一字之差。记者以“红四方”商标为例,查询时发现,与之一字之差的商标还有“四方”“四红方”“红方”“红遍四方”等多个与之类似的商标,这些商标多数用于化肥行业。除了“四红方”与“红四方”的申请人均为中盐安徽红四方股份有限公司外,其他相似商标的申请人则是不同的公司和个人。再以“史丹利”进行搜索,则发现一字之差的商标依旧很多,如“史丹臣”“史沛利”“绿丹利”等,这些商标均属于不同公司。
1.5 补肾化痰中药对BMSCs诱导成骨分化的影响
将P4代BMSCs按4×103/cm2密度接种于6孔板,细胞融合达60%~70%后加入成骨分化培养基(含10-7mol/L地塞米松,10 mmol/L β-甘油磷酸钠,50 μg/ml Vitamin C),置培养箱中隔天换液1次。根据预实验结果,在成骨分化诱导培养基中分别加入0.01%补肾化痰中药干预液、补肾中药干预液、化痰中药干预液,分为补肾化痰中药组、补肾中药组、化痰中药组。BMSCs成骨诱导18 d后终止诱导,并进行下列各项指标检测。
1.5.1 茜素红染色及定量 用10%中性甲醛固定15min,加入0.5%的茜素红染色液染色20 min,蒸馏水洗涤4次,分光光度法测定吸光度(OD 值),茜素红定量以umol/mg表示。
1.5.2 碱性磷酸酶(ALP)活性检测 用常规生化分析仪测定ALP活性。
1.5.3 骨钙素(OCN)mRNA表达 用0.25%胰蛋白酶(含1mmol/L EDTA)消化收集细胞,按照Trizol试剂盒说明进行总RNA的抽提。引物设计: β-actin,上游引物:5’-GTG GGG CGC CCC AGG CAC CA-3’;下游引物:5’-CTC CTT AAT GTC ACG CAC GAT TTC-3’。OCN:上游引物:5’-ATG AGA GCC CTC ACA CTC-CTC-3’,下游引物:5’-GCC GTA GAA GCG CCG ATA GGC-3’。经逆转录反应制备cDNA后贮于-20℃备用。PCR体积30 μL,包括cDNA模板1.2 μL,10×Buffer 3 μL,dNTP (0.2 mM)3 μL,MgCl2(25 mM)2 μL,上游引物:(10 μM)1 μL,下游引物:(10 μM)1 μl,Taq酶(1 U/ μL)2 μL,ddH2O补足体积至30 μL。混匀后离心数秒,置PCR仪上,热循环程序为:预变性94℃3 min,变性94℃30 s,退火60℃1 min,延伸72℃1 min,30个循环后72℃再延伸10 min。取10 μL产物进行1.0%琼脂糖凝胶电泳,用凝胶成像系统检测溴化乙锭染色的凝胶,紫外灯下观察,凝胶成像系统扫描存盘。记录各条带积分光密度(IOD),将检测基因与GAPDH条带IOD相比较得到其相对IOD。
1.6 统计学方法
采用SPSS 12.0统计软件对实验数据进行分析,所有数据以均数±标准差(±s)表示。
2 结果
2.1 大鼠BMSCs及成骨诱导分化后形态学特征
接种后,BMSCs呈圆形,胞体透亮,折光性强,大小不一。72 h首次换液后即可见大量贴壁细胞,细胞完全舒展并呈现长梭形、三角形、多边形等多种形态,带2~3个突起。4~7 d呈放射状生长的贴壁细胞形成数个不同大小、分散的细胞集落。9~10 d细胞逐渐融合成片,沿胞体长轴有序排列,呈旋涡状(图1)。传代后的细胞形态单一均匀,融合后呈典型的极性,漩涡状生长。成骨诱导第2天开始,即可见部分细胞由长梭形逐渐变为立方形,进而转变为多角形且体积增大。培养8 d后,细胞持续增殖,呈多层重叠生长,逐渐聚集形成多个散在致密的岛状细胞结构,并逐渐被细胞分泌的基质所包埋,13 d左右出现钙化结节,其后还可见到明显的钙沉积(图2)。

图1 BMSCs原代培养结果(×40)

图2 BMSCs传代培养(×200)
2.2 大鼠BMSCs表面标志物检测
细胞表面抗原CD29、CD44的阳性率分别为99.64%和98.52%,CD45的阳性率为1.54%。
2.3 补肾化痰方对BMSCs成骨诱导后茜素红S染色与定量、ALP活性、OCN-mRNA表达的影响
表1图3显示,用茜素红S染色后矿化结节呈橘红色。各组OCN-mRNA表达的电泳图,见图4。补肾化痰中药组BMSCs成骨诱导后茜素红S定量值、ALP活性、OCN-mRNA表达均高于经典诱导组(P<0.05,P<0.001)。补肾中药组和化痰中药组与经典诱导组比较,差异均无统计学意义。
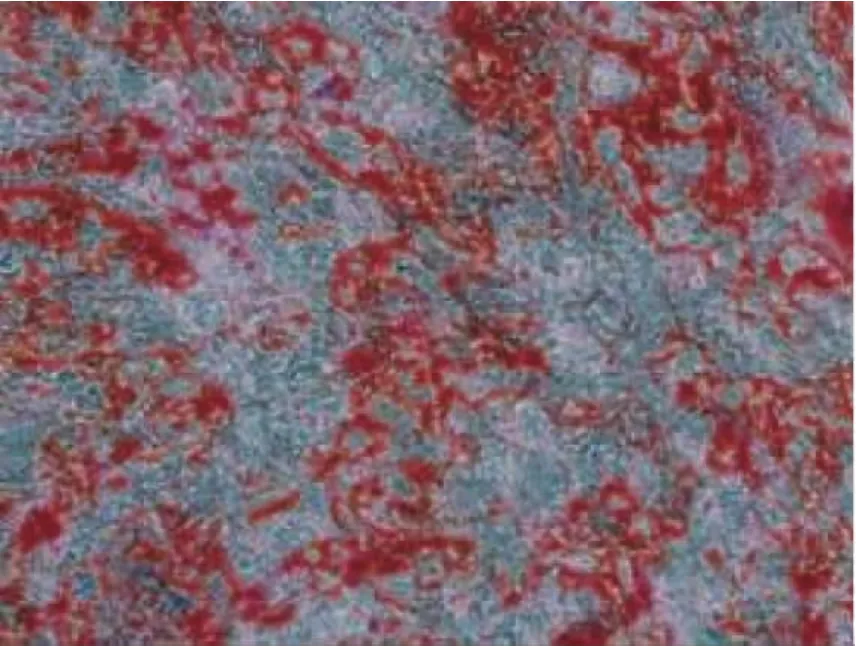
图3 细胞矿化作用检测结果(×200)

图4OCN-mRNA琼脂糖电泳结果
表1 各组BMSCs成骨诱导后茜素红定量、ALP活性及OCN-mRNA表达的检测结果(n=3±s)

表1 各组BMSCs成骨诱导后茜素红定量、ALP活性及OCN-mRNA表达的检测结果(n=3±s)
注:与经典诱导组比较:*P<0.05,***P<0.001
组别 茜素红定量(μmol/mg)-actin经典诱导组ALP活性(nmol/mg) OCN/β 12.605±0.847 3406.650±5.734 0.384±0.131补肾化痰中药组 15.568±2.310*4265.287±41.735***1.080±0.356***补 肾 中 药 组 11.277±0.489 3580.569±8.797 0.588±0.327化 痰 中 药 组12.626±1.221 3044.010±5.581 0.549±0.079
3 讨论
BMSCs是在骨髓中发现的一种起源于中胚层、具有自我复制和多向分化潜能的非造血干细胞,能在不同的诱导条件下分化为软骨细胞、成骨细胞、脂肪细胞、神经细胞、肌肉细胞、心肌细胞、血管内皮细胞等成熟的间质细胞[2]。BMSCs向成骨细胞和脂肪细胞分化保持正常的比例关系,对维持骨组织重建与代谢发挥着重要的调控作用。一旦BMSCs过多地向成脂细胞方向分化,则向成骨细胞分化的细胞数就相应减少,进而引起成骨缺陷。研究表明,各种原因导致的骨质疏松和骨量减少,如卵巢切除、长期制动、酒精、糖皮质激素应用等,多伴有骨髓脂肪细胞的增多[3]。随着年龄的增长,骨量不断丢失的同时,骨髓腔内脂肪细胞的体积、数目均呈直线性增加[4],尤其是四周骨髓的骨髓腔约90%被脂肪细胞占据。绝经后骨质疏松妇女的BMSCs成骨分化能力减弱,更易于向脂肪细胞分化[5]。因此,研究调控BMSCs向成骨细胞方向分化、抑制向脂肪细胞分化的基因及药物是骨质疏松症防治的重要方向。
我们从脂代谢紊乱与骨质疏松症存在密切联系出发,认为肾虚是骨质疏松症的病理基础,痰浊是骨质疏松症的致病因素之一,提出脂代谢异常可能与骨质疏松症痰浊有关的假说,并制定了补肾化痰的新治则[6]。补肾化痰方由淫羊藿、补骨脂、全栝楼、山楂、红曲5味药组成。方中淫羊藿,《本草纲目》称其有“益精气,强筋骨,补腰膝”作用,为温肾壮阳之要药;补骨脂具有补肾壮阳、固精缩尿、温脾止泻的功效,两药相合补肾壮骨,是为君药。方中全栝楼功可清热化痰为臣药;山楂善于消食化积、行气散瘀;红曲健脾消食、活血化瘀,二药协同为佐药,全方共奏补肾化痰之功。
成骨细胞在钙化条件培养下,具有体外矿化特点,用茜素红S染色可见橘红色钙结节,可作为成骨细胞的一种标志。ALP是一种较为肯定的参与促进钙化活动的酶类,它是一种细胞内酶,其活性作为早期成骨性分化指标在骨代谢研究中被广泛应用。OCN是晚期成骨性诱导的关键性标志,对骨骼的改建过程有重要的调节功能。本实验结果表明,补肾化痰中药组BMSCs成骨诱导后茜素红S定量值、ALP活性、OCN-mRNA表达均高于经典诱导组,而补肾中药组和化痰中药组与经典诱导组比较差异均无统计学意义,提示补肾化痰中药在促进BMSCs早期和晚期成骨性分化方面均具有作用。
[1] Kha HT,Basseri B,Shouhed D,et al.Oxysterols regulate differentiation of mesenchymal stem cells:probone and antifat [J].J Bone Miner Res,2004,19(5):830.
[2] MingueU JJ,Erices A,Conget P.Mesenchymal stem cells[J].Exp Biol Med,2001,226(6):507-520.
[3] 郭坤亮,安洪,蒋电明,等.早期酒精性股骨头缺血坏死骨细胞凋亡的实验研究[J].重庆医科大学学报,2003,28(3): 313-315.
[4] 李湘辉,陆志坚,张金超,等.阿伦磷酸钠对小鼠骨髓基质细胞成骨和成脂分化的影响[J].中国药理学报,2006,22(6): 671-674.
[5] Rodriguez JP,Garat S,Gajardo H,et al.Abnormal osteogenesis in osteoporotic patients is reflected by altered mesenchymal stem cells dynamic[J].J Cell Biochem,1999,75(3)414-423.
[6] 周亚娜,向楠.从“痰”论治骨质疏松症[J].湖北中医杂志,2013,35(12):36-38.
Experimental study of tonifying kidney and resolving phlegm methods on influencing the bone marrow mesenchymal stem cells osteogenic differentiation
ZHOU Ya-na1,XIANG Nan2△,CHEN Hui2
(1.Hubei provincial hospital of TCM,Wuhan 430061,China;2.Hubei University of Chinese Medicine,Wuhan 430065,China)
Objective:It observed the osteoblastic differentiation of BMSCs on Bushen Therapy,Huatan Therapy,Bushen Huatan Therapy,and explore the mechanism of Bushen Huatan Therapy of treating osteoporosis.Method:BMSCs of wistar rats were isolated,purified by using whole bone marrow adherent method and identified by cytomorphology and morphologic characteristics,surface antigensdetected by flow cytometer.BMSCswasinduced by osteoblastic differentiation.Through the detection of alizarin red staining and quantitative,the ALP activity and the expression of OCN-mRNA,it explored the effect of osteoblastic differenttiation of BMSCs on Bushen Therapy,Huatan Therapy,Bushen Huatan Therapy.Results:Using the whole bone marrow adherent method can get good,stable and heterogeneity of BMSCs.Bushen Huatan Herb can promote BMSCs to generate into osteoblast in vitro calcification,increase the activity of ALP,down-regulate theexpression ofOCN-mRNA.Conclusion: Bushen Huatan Treatmentcan promote osteoblastic differentiation of BMSCs.
Bushen Huatan Treatment;Osteoporosis;Bone mesenchymal stem cells;Osteogenic differentiation
R274.9
B
1006-3250(2015)03-0275-03
2014-11-16
国家自然科学基金资助项目(30672591);湖北省自然科学基金资助项目(2007ABA237)。
周亚娜(1980-),女,湖北襄阳人,主治医师,医学博士,从事中西医结合内分泌代谢疾病和内分泌肿瘤的临床与研究。
△通讯作者:向 楠,教授,博士研究生导师,第一批全国中医药优秀临床人才,全国老中医经验继承人,Tel: 13007162959,E-mail:xiangnan61@sina.com。

