宫颈鳞癌预后影响因素的临床研究
辛华栋
全世界每年有50 万新增宫颈癌病例,死亡病例约27.5 万,近年来我国每年新增病例约13.5 万,占全球发病数量的1/3,有增长趋势,发病趋于年轻化[1]。在众多的流行病学、临床病理特征及不同治疗方式等因素中以复杂的相互机制发挥作用影响宫颈癌的预后,但分子生物学指标很少被引入研究。COX-2 在多种恶性肿瘤组织中表达异常增高,并被认为与不良预后有关。宫颈癌以鳞状细胞癌为主,预后程度直接与患者的生活质量及生存期密切相关。本研究通过回顾性分析常见临床病理特征及COX-2 与宫颈鳞状细胞癌患者预后的关系,为更好的指导治疗及监测病情变化提供理论依据及积累临床资料。
1 资料与方法
1.1 一般资料 选择2008 年6 月至2009 年10 月在我院住院治疗的原发宫颈鳞癌患者77 例,临床病理资料完整,排除合并其他恶性肿瘤及心脑血管疾病的患者,年龄27 ~80 岁,中位年龄42 岁。所有病理切片请两位资深病理科医师复核,按照国际妇产科联盟(FIGO 2009)宫颈癌临床分期标准[2]:Ⅰ期16 例,Ⅱ期35例,Ⅲ期18 例,Ⅳ期8 例。高、中、低分化分别为15例、40 例及22 例。
1.2 免疫组化结果判断 采用免疫组化SP 法进行实验检测。羊抗人COX-2 多克隆抗体、即用型羊SP kate检测试剂、DAB 显色试剂盒、SP 试剂盒均为北京中山生物技术有限公司产品。根据文献,按阳性细胞百分比及阳性细胞染色强弱评分(immunohistochemical scores,IHS)[3]:IHS=a×b。a 代表阳性细胞百分比:a=0,无阳性细胞;a =1,阳性细胞为1% ~10%;a =2,阳性细胞为11% ~50%;a =3,阳性细胞为51% ~80%;a=4,阳性细胞为81%以上。b 代表阳性细胞染色强弱:b =0,阴性;b =1,弱阳性;b =2,中度阳性;b=3,强阳性。IHS 0 分为阴性;IHS ≥1 分为阳性。以已知COX-2 阳性的肺癌切片为阳性对照。
1.3 随访 通过电话、门诊复查、书信等方式对患者进行随访,从确诊之日起开始,至2014 年10 月随访结束。生存期以月为计算单位,随访时间为8.6 ~76 个月。随访期内,77 例宫颈鳞癌患者中死亡20 例,失访2 例,其中8 例死于局部复发,5 例死于远处转移,6 例死于局部复发合并远处转移,1 例死于脑血管意外。失访者自失访之日按截尾数据处理。
1.4 统计学分析 应用SPSS 21.0 统计软件,相关分析采用Spearman 等级相关检验,计数资料采用χ2检验、χ2分割法,Kaplan-Meier 法计算生存率并绘制生存曲线,组间生存率的比较采用Log-rank 检验,Cox 比例风险模型进行宫颈鳞癌预后的多因素分析,P <0.05为差异有统计学意义。
2 结果
2.1 5年生存率 患者的5 年生存率为74.03%,生存时间8.6 ~62 个月,平均生存时间44.78 个月,中位生存时间53 个月。
2.2 COX-2 在宫颈鳞癌中的表达情况 COX-2 阳性细胞为细胞浆内出现棕黄色及棕褐色颗粒。COX-2 在77 例宫颈鳞癌中的阳性表达率为68.83%(53/77),COX-2 阳性组的5 年生存率为68%,明显低于阴性组的87%,但差异无统计学意义(χ2= 3.321,P =0.068)。COX-2 阳性的平均生存时间为43.07 个月,明显低于COX-2 阴性的平均时间57.24 个月。见图1 ~3。
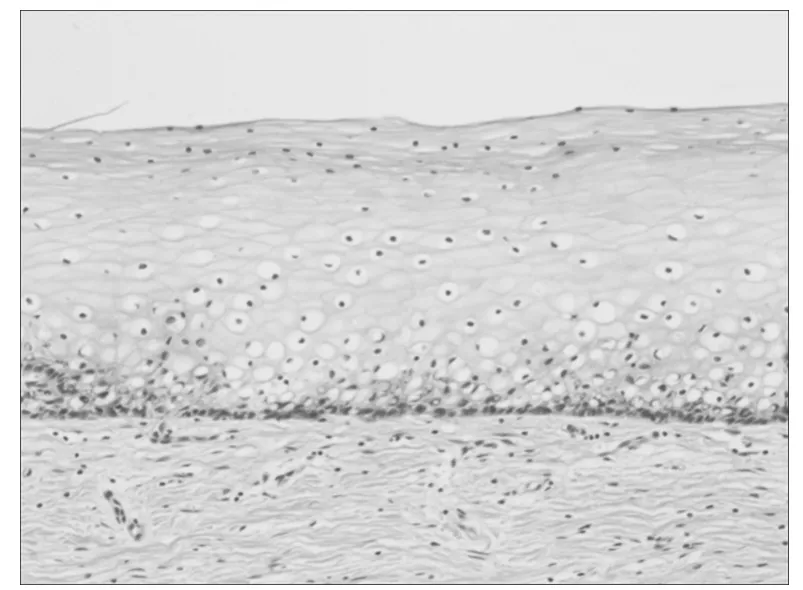
图1 COX-2 阴性(免疫组化×100)
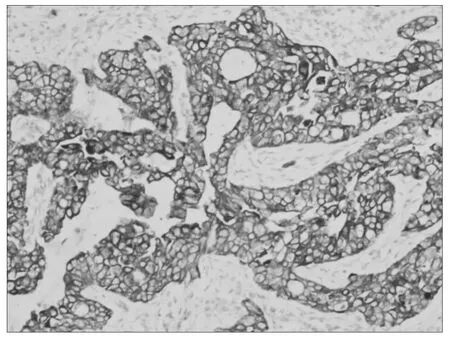
图2 COX-2 阳性(免疫组化×200)
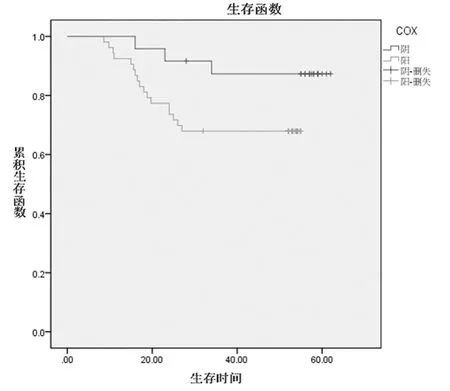
图3 COX-2 表达情况的生存曲线
2.3 Log-rank 检验分析显示 组织学分级、临床分期、淋巴结转移、肿瘤直径、宫旁或脉管浸润及肌层浸润深度与宫颈鳞癌预后相关(P <0.05)。经χ2分割后(α,=0.0125,k=3)显示:高分化组与低分化组的5 年生存率比较差异有统计学意义(χ2=8.767,P =0.003)。χ2分割后(α,=0.007143,k =4)Ⅰ期与Ⅲ、Ⅳ期的5 年生存率比较差异有统计学意义(χ2=8.992,P =0.003;χ2=13.694,P =0.000);Ⅱ期与Ⅳ期的5 年生存率比较有统计学意义(χ2=11.627,P =0.001)。见表1 ~3,图4 ~5。
2.4 可能因素进行多因素分析结果(只显示有意义的因素) COX-2、组织学分级、临床分期、淋巴结转移、宫旁或脉管浸润及肌层浸润深度对宫颈癌预后的影响差异有统计学意义(P≤0.05 为进入水准,P >0.10为剔除水准)。而年龄、肿瘤直径对宫颈癌预后的影响差异无统计学意义(P >0.10)。见表4。
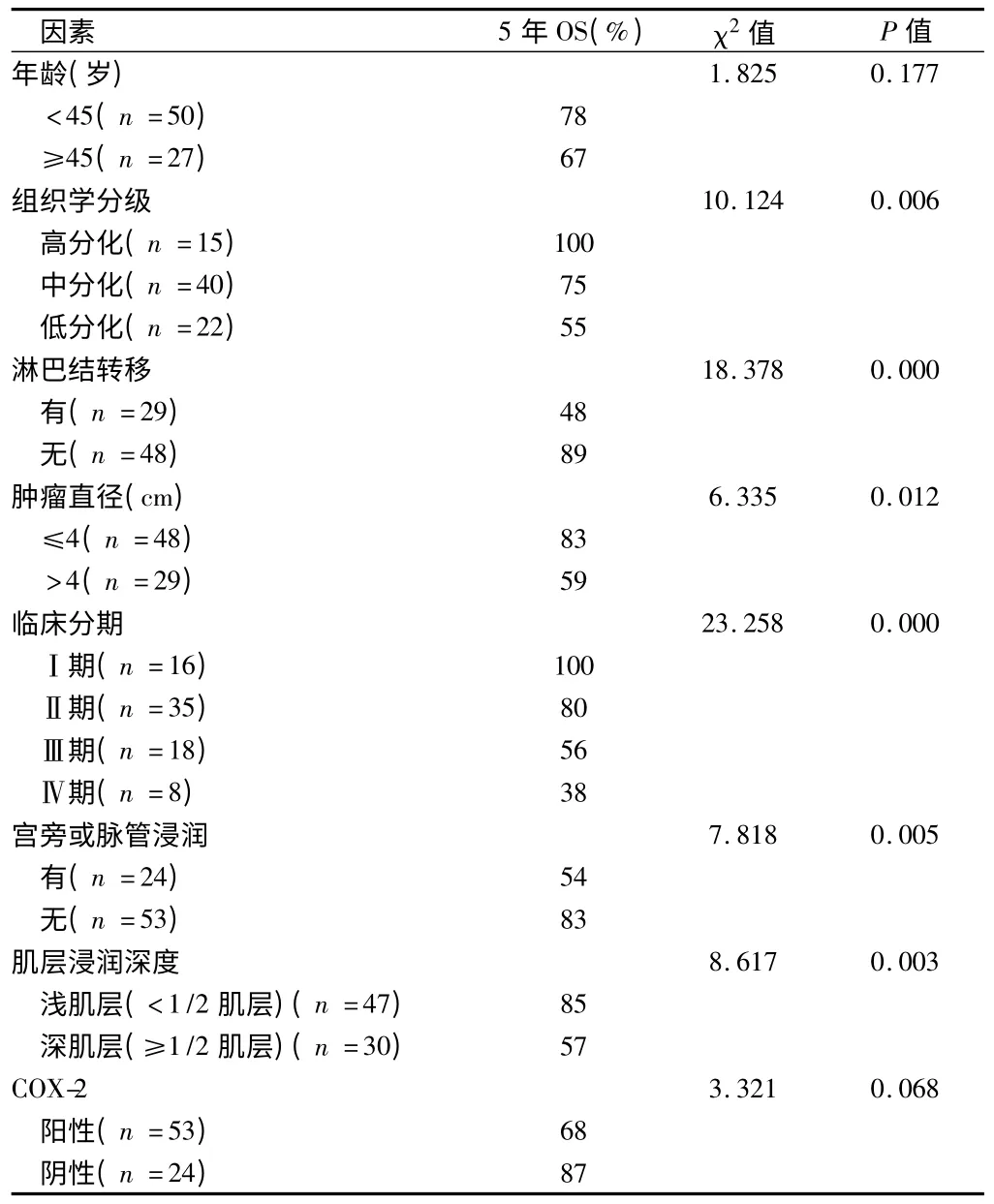
表1 影响77 例宫颈鳞癌预后的单因素分析 例
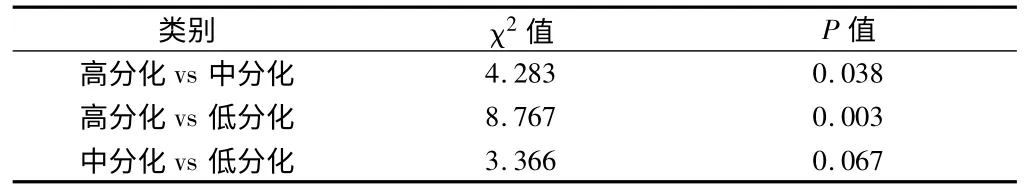
表2 组织学分级3 组5 年生存率两两比较的单因素分析

表3 临床分期4 组5 年生存率两两比较的单因素分析
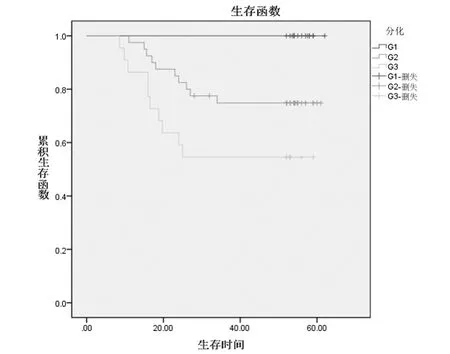
图4 组织学分级各组的生存曲线
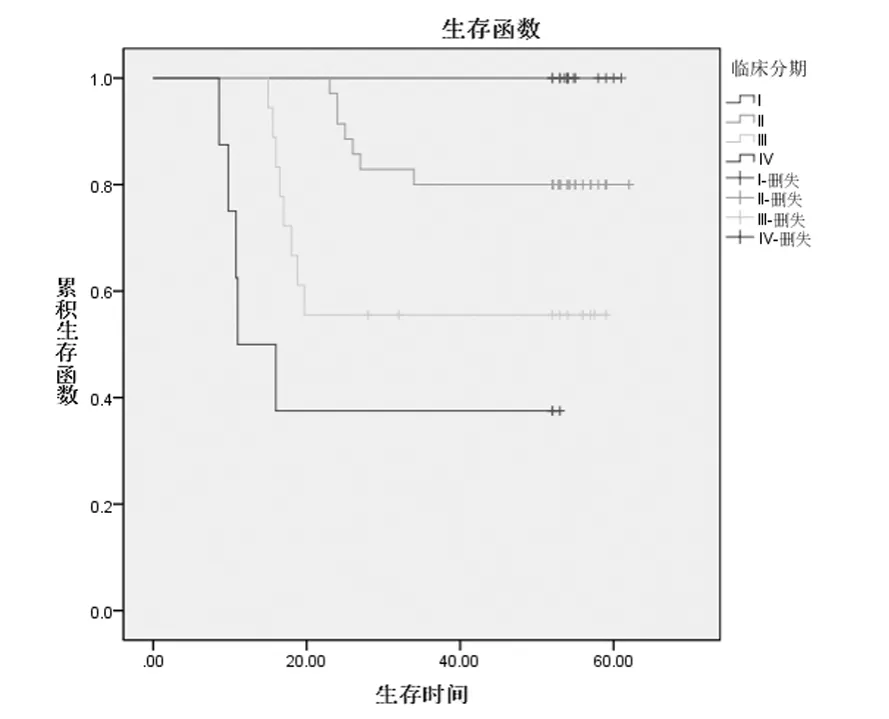
图5 临床分期的生存曲线
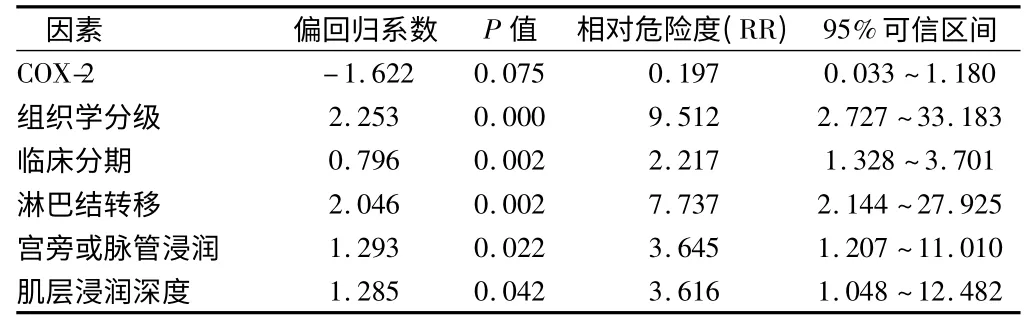
表4 77 例宫颈鳞癌预后的多因素分析结果
2.5 相关性分析 临床分期与组织学分级、肿瘤直径、淋巴结转移及宫旁或脉管浸润呈正相关关系(P <0.05),而与肌层浸润深度及COX-2 进行相关检验而无统计学意义(P >0.05)。组织学分级与COX-2 呈正相关关系(P <0.05)。淋巴结转移与肿瘤直径、深肌层浸润及COX-2 呈正相关关系(P <0.05)。见表5 ~6。
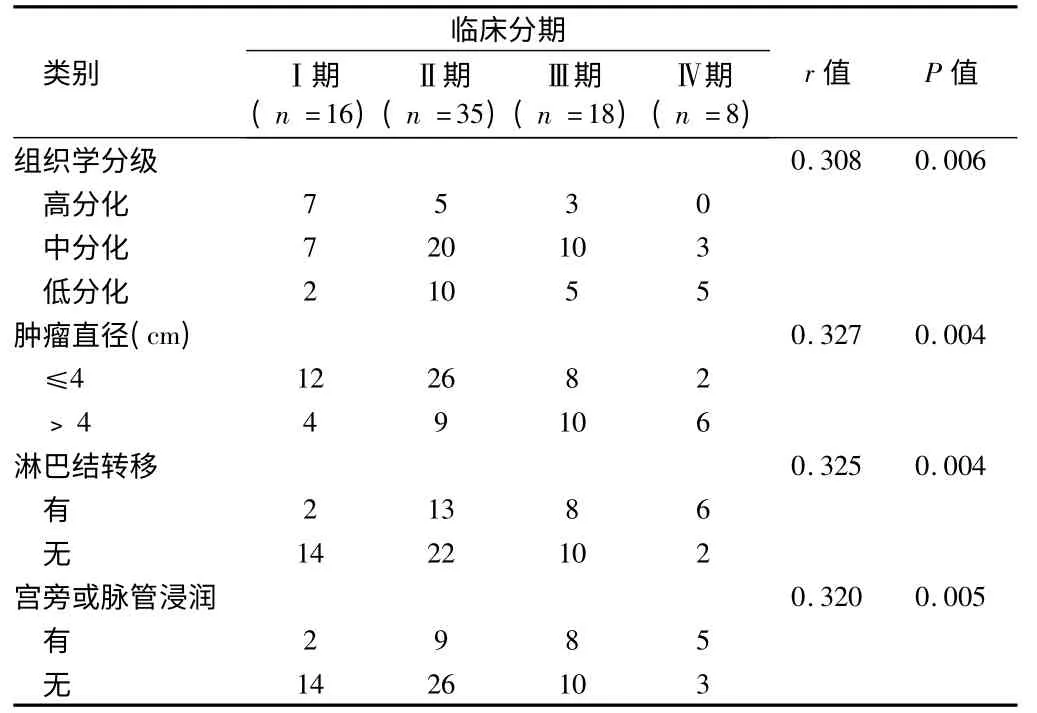
表5 临床分期与其他临床病理特征之间的相关性 例

表6 组织学分级与COX-2 的相关性 例
3 讨论
研究报道,COX-2 过表达可用于检测包括宫颈癌在内的多种肿瘤细胞的侵袭力和转移潜能[4],从而影响患者的预后。本研究中经Cox 比例风险模型分析:组织学分级、临床分期、淋巴结转移、宫旁或脉管浸润、肌层浸润深度及COX-2 与宫颈鳞癌的预后密切相关,在恶性肿瘤中,COX-2 通过促进细胞无限增殖、抑制细胞凋亡、促进肿瘤新生血管及淋巴管形成、参与癌基因活化或抑癌基因失活、介导细胞间粘附及细胞外基质降解等多种复杂机制促进肿瘤局部浸润及远处转移。在对食管癌的研究中发现:COX-2 高表达的患者生存率下降,新辅助放化疗后COX-2 的表达水平与患者复发率显著相关,可作为食管癌的独立预后指标[5,6]。头颈部鳞癌的研究显示:COX-2 高表达的患者5 年生存率显著低于低表达者,与预后密切相关[7]。一项关于结直肠癌预后的Meta 分析显示:截止2013 年8 月,入选18 篇文献中样本量共2 713 例,COX-2 表达可降低结直肠癌总生存率及无瘤生存率,是结直肠癌的不良独立预后因素[8]。本研究中COX-2 阳性患者的5年生存率为68%,明显低于COX-2 阴性的87%,但2组相比差异无统计学意义(P >0.05)。多元逐步Cox比例风险模型分析显示:COX-2 与宫颈鳞癌预后密切相关,有统计学意义。提示在宫颈鳞癌中COX-2 对预后评估及指导治疗具有重要的临床价值,本实验为COX-2 抑制剂应用于宫颈鳞癌提供了靶向治疗的方向。
张莉华等[9]研究显示:COX-2 在有淋巴结转移、有宫旁或脉管浸润、深肌层浸润的宫颈癌病例中阳性表达率显著升高,与宫颈癌的浸润转移密切相关。后续生存分析显示:上述三因素与HPV16-E6 蛋白影响患者的3 年生存率,与宫颈癌的独立预后因素[10]。文献报道:淋巴结转移是宫颈癌预后较差的一个指标[11,12]。早在1996 年,即有学者发现淋巴脉管浸润阳性是早期宫颈癌的独立预后因素[13]。国内研究发现淋巴脉管浸润影响总生存时间及无进展生存时间[14]。本研究显示:在宫颈鳞癌中有淋巴结转移的5年生存率为48%,显著低于无淋巴结转移者(89%)。有宫旁或脉管浸润及深肌层浸润的5 年生存率均显著低于相应阴性组,多因素分析亦有统计学意义,是宫颈鳞癌的独立预后因素。新生血管是肿瘤转移的必须条件,研究表明,VEGF 家族与肿瘤新生血管及淋巴管的形成均密切相关。袁冬兰等[15,16]的研究显示:COX-2及VEGF 表达阳性者较阴性者生存期缩短。一项直肠癌的研究显示:COX-2 过表达可上调VEGF-C 水平,促进直肠癌组织中微血管及微淋巴管的生成,利于肿瘤细胞的浸润转移,与直肠癌的预后密切相关[17]。宫旁组织疏松而淋巴管、静脉丛丰富,肿瘤细胞常沿宫颈两侧宫旁组织和主、骶韧带蔓延及淋巴结转移,而淋巴结内的淋巴管-静脉吻合支,促进癌细胞血行转移。这与宫颈癌的直接蔓延及淋巴转移的主要转移途径相符。有报道宫旁浸润、微血管瘤栓与淋巴结受累密切相关。本研究显示:在宫颈鳞癌组织中淋巴结转移与肿瘤直径、深肌层浸润及COX-2 呈正相关关系。肿瘤直径≤4 cm 与>4 cm 组经Log-rank 检验显示有显著性差异,影响宫颈鳞癌的预后。推测:COX-2 通过多种细胞通路促进新生血管及淋巴管生成,新生脉管密集而紊乱,肿瘤越大者,COX-2 通过与E-钙黏蛋白、CD44v6 及基质金属蛋白酶的相互作用,介导细胞间、细胞与细胞外基质粘附异常及降解细胞外基质的作用越强,肿瘤细胞越易出现深部浸润及远处转移,从而影响宫颈鳞癌患者的预后。与文献报道[18]一致。
淋巴结转移、临床分期及分化程度被大多数学者认为是最重要的预后因素。有文献报道:分化程度是影响宫颈癌手术预后的第一位独立因素[19]。本研究可见:有淋巴结转移及组织学分级差的患者发生复发转移等影响预后的恶性生物事件的风险分别为7.737倍及9.512 倍。高、中、低分化的5 年生存率分别为100%、75%及55%,单因素及多因素分析均有统计学意义,是宫颈鳞癌重要的不良预后因素(P <0.01)。经χ2分割后两两比较低分化组的5 年生存率显著低于低分化组,有统计学意义,见表2(α,=0.0125,χ2=8.767,P =0.003)。等级相关检验显示:组织学分级与临床分期及COX-2 呈正相关关系(P <0.05),见表5、6。这与非小细胞肺癌、乳腺癌、下咽鳞癌[20-22]的研究结果相似。刘晓丽等[23]对卵巢癌经Spearman 等级相关分析表明COX-2 的阳性表达与淋巴结转移、肿瘤分化程度及临床分期密切相关,与本研究结论一致,且随肿瘤分化程度的降低、COX-2 的表达升高及淋巴结转移,宫颈鳞癌的5 年生存率降低,为不良预后因素。但少数学者认为:组织学分级并非肿瘤的预后的独立因素[24]。
研究显示:临床分期越晚的宫颈癌患者,淋巴结转移率越高,5 年生存率越低,预后越差,是预后危险因素[25]。本研究显示:不同分期的宫颈鳞癌患者的5 年生存率有显著性差异。经χ2分割后两两比较Ⅰ期与Ⅲ、Ⅳ期,Ⅱ期与Ⅳ期的5 年生存率有统计学差异(α,=0.007143,P <0.007143)。提示随临床期别的提高,宫颈鳞癌患者的预后渐差。但Spearman 等级相关检验显示:临床分期与组织学分级、肿瘤直径、淋巴结转移、宫旁或脉管浸润密切相关(P <0.05),而与肌层浸润深度及COX-2 无关。肿瘤直径>4 cm 的患者较≤4 cm 的5 年生存率显著下降,Log-rank 检验有统计学意义,影响患者的预后,但多因素分析非宫颈鳞癌的独立预后因素。笔者推测:宫旁疏松组织内的淋巴管及血管丰富,与肿瘤新生脉管形成大量的吻合支,而新生脉管系统管壁薄弱、基底膜不完整、内皮细胞多为单层且间隙较大,既有助于向肿瘤输送营养,又有助于肿瘤细胞的扩散。肿瘤体积越大,细胞分化越差,越易通过细胞异质性粘附、细胞外基质降解、纤维蛋白溶解等复杂机制出现盆腔淋巴结转移及宫旁或脉管浸润,并进一步远处转移。郭梅梅等[26]对胰腺癌预后的研究结论与本研究相似。
综上所述,对于宫颈鳞癌,在临床病理特征中,临床分期、组织学分级、淋巴结转移、宫旁或脉管浸润及肌层浸润深度为独立预后因素,肿瘤直径影响宫颈鳞癌的预后,但非独立预后指标。COX-2 在宫颈鳞癌中表达增高,且是不良预后因素。对临床晚期、组织分化差、有淋巴结转移、宫旁或脉管浸润等患者高要度重视,应采取更为积极的治疗方案改善预后。COX-2 作为宫颈鳞癌预后相关因素,其抑制剂应用于抗肿瘤治疗或作为化疗增敏剂,已有学者进行了初步探索,期待有更深入严谨的大样本临床试验出现。
1 董小艳.50 例年轻宫颈癌患者的临床及病理特点.中国医学创新,2011,8:142-143.
2 丰有吉,沈铿主编.妇产科学.第2 版.北京:人民卫生出版社,2012.327-328.
3 欧阳艳琼,吴绪峰,陈惠祯,等.宫颈癌组织中环氧合酶-2 和诱生型一氧化氮合酶的表达及其意义.现代妇产科进展,2003,12:364.
4 Xin X,Majumder M,Girish GV,et al.Targeting COX-2 and EP4 to control tumor growth,angiogenesis,lymphangiogenesis and metastasis to the lungs and lymph nodes in a breast cancer mode.Lab Invest,2012,92:1115-1128.
5 白美玲,张林西,李海军,等.Ang-2、COX-2 及CD105 联合检测评价食管鳞癌患者预后的意义.中国老年学杂志,2012,32:2238-2240.
6 Takatori H,Natsugoe S,Okumura H,et al.Cyclooxygenase-2 expression is related to prognosis in patients with esophageal squamous cell carcinoma.Eur J Surg Oncol,2008,3:397-402.
7 Saba NF,Choi M,Muller S,et al.Role of cyclooxygenase-2 in tumor progression and survival of head and neck squamous cell carcinoma.Cancer Prev Res,2009,2:823-829.
8 谢竹田,张彧飞,姜文洁.环氧合酶2 表达与结直肠癌预后关系的Meta 分析.齐鲁医学杂志,2014,29:192-195.
9 张莉华,田芬,辛华栋,等.COX-2 在宫颈癌变中的表达及其意义.河北医科大学学报,2010,31:578-580.
10 张莉华,辛华栋,李丽,等.宫颈癌预后影响因素的临床分析及研究.中国热带医学,2013,13:1272-1274,1292.
11 张莉华,段爱红,李丽,等.92 例宫颈癌患者预后影响因素的分析研究.中国医药导报,2013,10:63-65.
12 陆晓楣,李晶,刘畅浩,等.年轻宫颈癌患者的病理特点和预后分析.中国妇产科临床杂志,2011,12:10-13.
13 Sevin BU,Lu Y,Bloch DA,et al.Surgically defined prognostic parameters in patients with early cervical carcinoma A multivariate survival tree analysis.Cancer,1996,78:1438-1446.
14 严鸣,张彦娜,何洁华,等.淋巴脉管间隙浸润对早期宫颈鳞癌预后的影响.癌症,2010,29:468-474.
15 袁冬兰,钱华,王华,等.宫颈鳞状细胞癌组织中NDRG-1、COX-2 、VEGF 的表达及其临床意义.江苏大学学报(医学版),2014,24:250-254.
16 Goel HL,Mercurio AM.VEGF targets the tumour cell.Nat Rev Cancer,2013,13:871-882.
17 王爱亮,刘志强,陆信仰,等.直肠癌中环氧化酶2、血管内皮生长因子C 的表达及与血管、淋巴管生成相关性的研究.中华临床医师杂志,2012,6:1300-1302.
18 胡尔西旦·尼牙孜,忙尼沙·阿布都拉,张蕾.年轻宫颈癌患者预后因素分析.中华实用诊断与治疗杂志,2012,26:104.
19 孙丽霞,刘洁.宫颈癌根治术预后影响因素分析.中国肿瘤临床与康复,2012,19:546-548.
20 李云,殷培伟,李东,等.非小细胞肺癌组织Ki-67 与Cox-2 表达相关性分析.中华肿瘤防治杂志,2014,21:365-367.
21 黄玉钿,张声,郑曦,等.诱导型一氧化氮合酶、环氧合酶-2 与乳腺癌淋巴管生成的关系及其临床意义.中国老年学杂志,2012,32:1125-1127.
22 Goto R,Hoshikawa H,Fujii T,et al.Clinicopathological significance of cyclooxygenase-2 expression in hypopharyngeal squamous cell carcinoma.Oncol Rep,2008,19:645-650.
23 刘晓丽,马礼鸿,王全义,等.COX-2、ERCC-1 在卵巢癌组织中的表达及意义.中国病原生物学杂志,2013,8:739-741.
24 孙秀华,刘柳,何红梅.105 例中晚期胃癌综合治疗的疗效及预后因素分析.大连医科大学学报,2014,36:355-359.
25 郑晓霞,李琼珍,李玲,等.宫颈癌预后状况及其影响因素分析.实用癌症杂志,2014,29:314-316.
26 郭梅梅,刘江伟,贾福鑫,等.Survivin 和COX-2 的表达及与胰腺癌预后的关系.现代生物医学进展,2013,13:3632-3636.

