PGD2对小鼠肺成纤维细胞TGF-β1/Smads信号通路的影响
刘建英,刘代顺,刘振峰,韩冰
(遵义市第一人民医院,贵州遵义563000)
支气管哮喘是由多种细胞(如肥大细胞、T淋巴细胞、嗜酸性粒细胞、中性粒细胞)和细胞组分参与的气道慢性炎症疾病,其特征是可逆的气流受限。过去的研究主要集中在支气管哮喘的气道炎症。近年大量研究发现哮喘患者经常出现不可逆或部分不可逆性气流阻塞及持续的气道高反应性,即使给予积极的抗炎和扩张支气管治疗仍无效,认为其原因与长期气道慢性炎症直接或间接引起气道壁结构改变有关,气道壁的这种结构改变称为气道重构,被认为是除气道慢性炎症之外哮喘的另一个重要特征[1]。2010年6月~2011年12月,本实验通过探讨前列腺素D2(PGD2)对小鼠肺成纤维细胞TGF-β1/Smads信号通路的影响,为支气管哮喘气道重塑提供分子研究基础。
1 材料与方法
1.1 材料 L-929小鼠肺成纤维细胞(第四军医大学提供),胎牛血清、TGF-β2细胞因子、PGD2受体抑制剂Laropiprant(均购买于 Gibco公司,USA),TRIzol、PCR试剂盒(均购买于大连宝生物公司),多克隆兔 TGF-β1抗、多克隆兔 Smad3抗、多克隆兔Smad4抗(美国CsT公司),单克隆鼠β-actin(碧云天),辣根过氧化物酶(HRP)标记的羊抗兔二抗、HRP标记的兔抗鼠二抗、BCA蛋白定量试剂盒、PVDF膜、彩色预染蛋白相对分子质量标准(均购于碧云天),琼脂糖(Biowest公司)。
1.2 方法
1.2.1 MTT比色法检测细胞活力 参照中国国家标准GB/T1688615-1997“医疗器械生物学评价第五部分:细胞毒性试验体外法”进行。将生长状态良好的L-929细胞于实验前1 d传代,第2天用0.25%胰酶消化,1 000 r/min离心5 min,用10%小牛血清的DMEM培养基重悬,调整细胞为2×105/mL,铺于96孔平底板中37℃、5%CO2孵箱中孵育4 h,待细胞贴壁后,即将实验细胞按照时间梯度分为12 h组、24 h组、48 h 组、72 h、96 h 组,分别用 10%胎牛血清DMEM高糖培养基稀释Laropiprant(稀释浓度为 0.3、1、3、10、30 μmol/mL),同时设正常细胞对照,每孔加入100 μL试液,每个稀释度设5个复孔,置于37℃、5%CO2孵箱中孵育24 h,加入5 mg/mL MTT 20 μL/孔(每毫升 PBS 中溶解 5 mg MTT,经0.22 μL滤膜滤过以除菌和去不溶物质,低温、避光保存),37℃、5%CO2培养箱中继续孵育4 h后,用预温的PBS清洗2遍,弃去上清,加入溶解液DMSO 100 μL/孔,于微型振荡器上振荡5 min,使结晶物充分溶解,使用酶联免疫检测仪在波长490 nm处测定各孔吸光度(OD)值。根据测定的OD值计算其相对的细胞生长抑制率。抑制率=[(对照组OD值-给药组OD值)/对照组OD值]×100%。
1.2.2 RT-PCR 法检测 TGF-β1、Smad3、Smad4 的mRNA 将对数生长期的L-929细胞以5×104/mL接种于25 mL培养瓶内,接种24 h,按Laropiprant浓度梯度将细胞分为空白对照组、0 μmol/mL 组、0.3 μmol/mL 组、1 μmol/mL 组、3 μmol/mL 组、10 μmol/mL组,除空白对照组外,每组分别加入2.5 ng/mL TGF-β2,继续培养 24 h,用 TRIzol 法提取细胞总RNA,根据PCR试剂盒将RNA逆转录为互补DNA(cDNA)进行PCR。逆转录反应体系:10×RNA PCR buffer 5 μL,25 mmol/L MgCl24 μL,10 mmol/L dNTP 1 μL,Oligo dT 50 pmol,Rnasin 20 U,逆转录酶 5 U,cDNA 10 μL,补加 DEPC 处理水至 20 μL。于热循环仪中95℃预变性5 min,再进行95℃变性1 min、57℃退火1 min、72℃延伸1 min,共35个循环。最后将PCR产物进行溴化乙锭染色,并通过2%琼脂糖凝胶电泳,紫外灯下观察。用凝胶图像分析系统采集图像。LABWORKS分析软件对扩充基因的电泳条带进行灰度分析。光密度表示为实验值/β-actin,分别进行3次取平均值。各检测指标引物序列:TGF-β1:上游 5'-CGGAATTCATGGTCCACAGCATTCCGCTG-3',下游5'-CGGGATCCCTAATTGATCCCGCTGCTCA-3';Smad3:上游 5'-TGAACACCAAGTGCATTACCA-3',下游5'-GGAGGTAGAACTGGCGTCTCT-3';Smad4:上游5'-ACATTGGATGGACGACTTCAG-3',下游 5'-TCAATTCCAGGTGAGACAACC-3'。
1.2.3 Western blotting 法 检 测 TGF-β1、Smad3、Smad4蛋白表达量 按Laropiprant浓度梯度将细胞分为空白对照组、0 μmol/mL 组、0.3 μmol/mL 组、1 μmol/mL组、3 μmol/mL组,除空白对照组外每组分别加入2.5 ng/mL TGF-β2,继续培养24 h。提取总蛋白,BCA法测定浓度。以每孔40 mg上样,用10%的聚丙烯酸胺凝胶电泳分离蛋白,半干法转移至PVDF膜,稀释多克隆兔 TGF-β1抗(1∶500)、多克隆兔Smad3 抗(1∶500)、多克隆兔 Smad4 抗(1∶500),单克隆鼠β-actin(1∶500)4℃孵育过夜,洗膜后,HRP标记的羊抗兔二抗(1∶1 000)、HRP标记的兔抗鼠二抗(1∶1 000)孵育6 h,用发光试剂盒显示蛋白条带,使用Gensnap凝胶成像系统拍照。光密度=实验值/βactin,分别进行3次取平均值。
1.2.4 统计学方法 采用SPSS19.0统计软件。计量数据以±s表示,组间比较采用单因素方差分析。以P≤0.05为有统计学差异。
2 结果
2.1 Laropiprant对小鼠肺成纤维细胞活力的影响细胞生长抑制率随Laropiprant浓度增高和作用时间延长呈上升趋势,Laropiprant在浓度达到1 μmol/mL,作用时间为24~96 h时,细胞生长抑制率明显提高(见图1)。
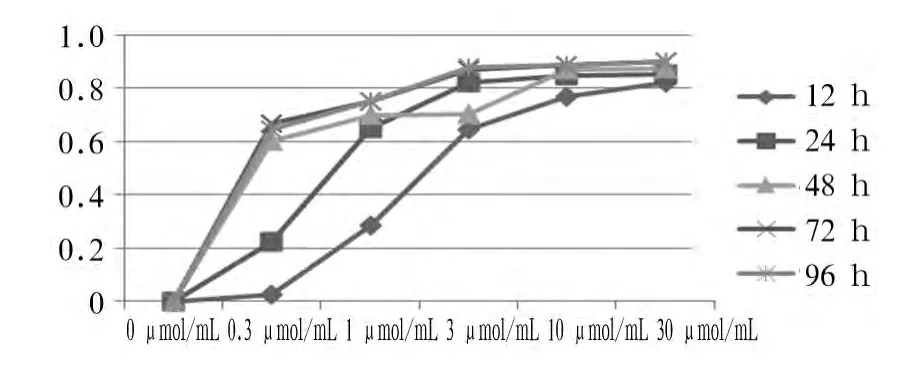
图1 Laropiprant对小鼠肺成纤维细胞活力的影响
2.2 PGD2对小鼠肺成纤维细胞 TGF-β1的影响 如图2A、2B所示,当加入PGD2刺激剂TGF-β2后在小鼠成纤维细胞中TGF-β1mRNA及蛋白表达增加;但加入Laropiprant后,随着其浓度增加,细胞TGF-β1mRNA及蛋白表达逐渐降低,与 Laropiprant 0 μmol/mL 组相比,Laropiprant 1、3、10 μmol/mL 组TGF-β1mRNA 及蛋白降低(P 均 <0.05)。
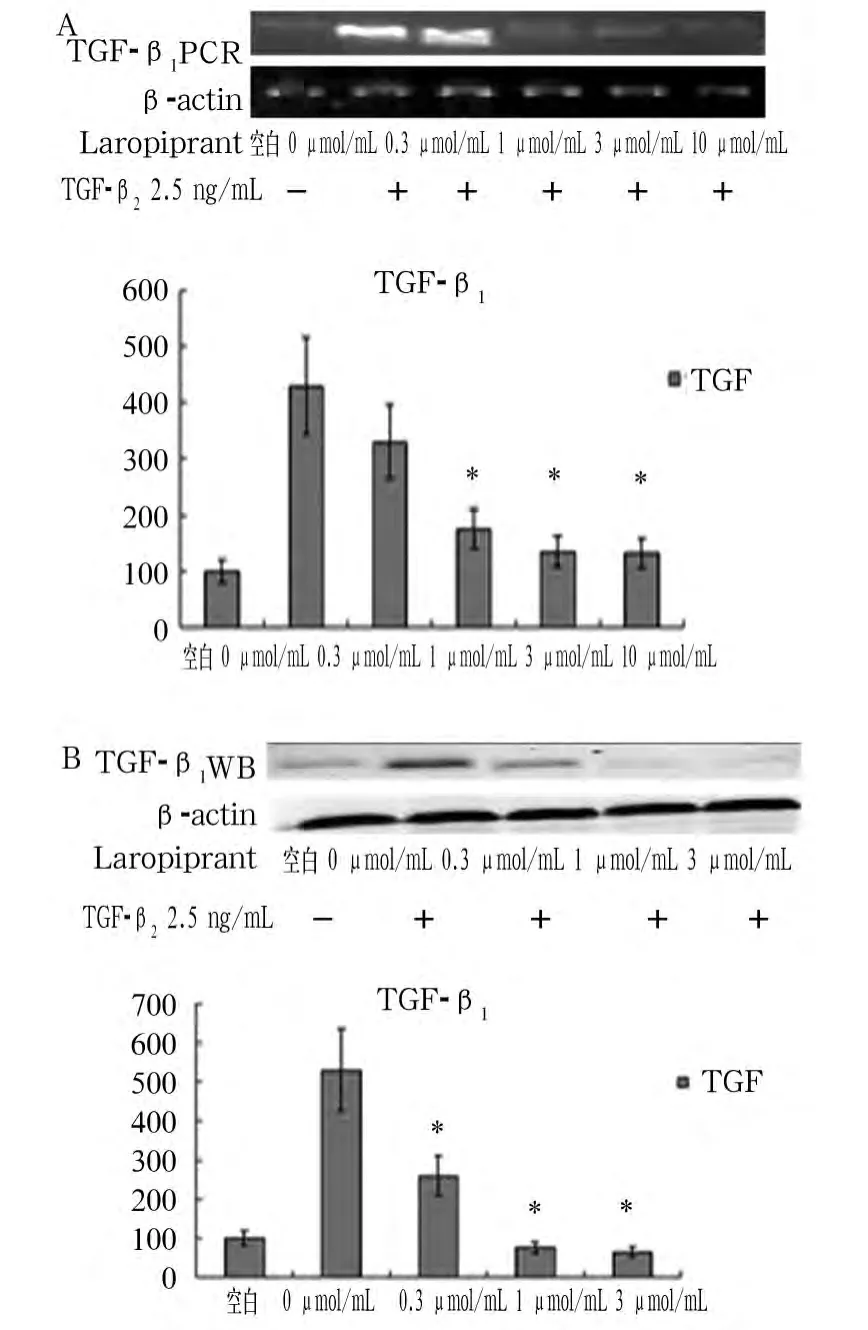
图2 PGD2对小鼠肺成纤维细胞TGF-β1的影响
2.3 PGD2对小鼠肺成纤维细胞Smad3的影响 如图3A、3B所示,当加入TGF-β2后,小鼠肺成纤维细胞Smad3 mRNA及蛋白表达增加,但加入Laropiprant后,随着其浓度增加,细胞Smad3 mRNA及蛋白表达逐渐降低,与 Laropiprant 0 μmol/mL组相比,Laropiprant对Smad3 mRNA及蛋白的抑制在Laropipratnt 0.3、3 μmol/mL 组增强(P 均 <0.05)。
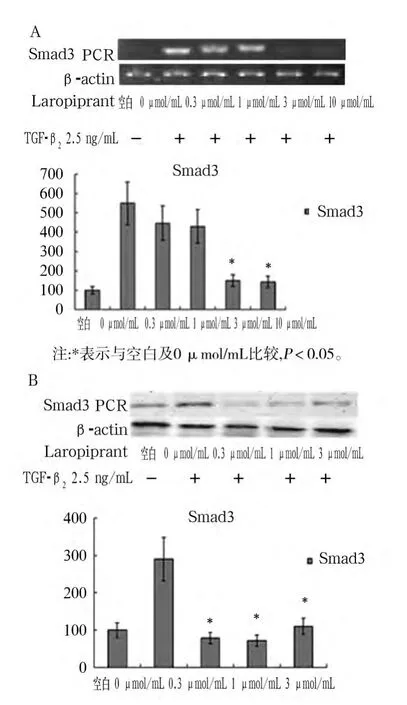
图3 PGD2对小鼠肺成纤维细胞Smad3的影响
2.4 PGD2对小鼠肺成纤维细胞Smad4的影响如图4A、4B所示,当加入TGF-β2后,小鼠肺成纤维细胞Smad4 mRNA及蛋白表达增加,但加入Laropiprant后,随着其浓度增加,细胞Smad4 mRNA及蛋白表达逐渐降低,与Laropiprant 0 μmol/mL组相比,Laropiprant对Smad4 mRNA及蛋白的抑制在Laropiprant 3、10 μmol/mL 组增强(P 均 <0.05)。
3 讨论
近年来,支气管哮喘气道重构越来越受到重视,但引起和加重哮喘气道重构的因素还不完全了解。目前研究表明,PGD2对哮喘免疫反应起着双向调控作用,可作为炎症介质产生致炎作用。Song等[2]在支气管哮喘患者吸入尘螨后,对其支气管肺泡灌洗液进行检测,发现其中的PGD2浓度可增加15倍。PGD2不仅诱导了支气管收缩,并且促使支气管收缩的效应强于组胺30倍。在支气管哮喘患者受到抗原的刺激后,其气道内存在大量PGD2。Sedej等[3]通过培养人胎儿肺成纤维细胞(HFL-1)进行体外实验,证明了PGD2不仅抑制HFL-1对人纤连蛋白起趋化作用的因子,而且还可以减缓成纤维细胞的迁移,主要是通过Ca2+依赖的蛋白激酶A信号通路来发挥作用。在气道炎症损伤后修复过程中,成纤维细胞太少不利于损伤的修复,而成纤维细胞过多则会使组织结构发生改变,从而使气道相应功能丧失。

图4 PGD2对小鼠肺成纤维细胞Smad4的影响
Murata 等[4]的研究表明,TGF-β1在气道炎症和纤维化中发挥了重要作用,其是刺激成纤维细胞增殖及胶原分泌的主要细胞因子。有学者在支气管哮喘患者支气管肺泡灌洗液中发现TGF-β1水平显著高于健康对照组,变应原刺激24 h后的TGF-β1水平更高;同时采用原位杂交和免疫细胞化学方法检测患者的哮喘气道黏膜,发现其TGF-β1表达显著增加和免疫反应显著增强,增加的量和疾病的严重程度直接相关。Schwartz等[5]在研究PGD2/DP信号转导对支气管哮喘发生的作用时发现,PGD2/DP信号不仅能抑制成纤维细胞的迁移,也可以调整成纤维细胞介导前胶原纤维的收缩反应。本实验以小鼠肺成纤维细胞为研究对象,通过应用PGD2特异性刺激剂TGF-β2刺激细胞,运用RT-PCR和Western blotting来检测 TGF-β1、Smad3、Smad4 的表达,结果发现随着刺激剂 TGF-β2的浓度增加,细胞TGF-β1、Smad3、Smad4 的表达升高;但加入 Laropiprant后,随着其浓度增加,细胞 TGF-β1、Smad3、Smad4 mRNA及蛋白表达逐渐降低;与Laropiprant 0 μmol/mL组比较差异有统计学意义。提示在小鼠气道慢性炎症过程中,PGD2可能对细胞TGF-β1、Smad3、Smad4的表达具有调控作用,这种机制在慢性气道炎症引起的气道重构中可能发挥了至关重要的作用。但是本实验仍未涉及其具体调控机制的研究,此外,在活体复杂环境下,PGD2对 TGF-β1/Smads的调控规律也有待进一步研究。
[1]Nagashima H,Nakamura Y,Kanno H,et al.Effect of genetic variation of IL-13 on airway remodeling in bronchial asthm[J].Allergol Int,2011,60(3):291-298.
[2]Song WL,Stubbe J,Ricciotti E,et al.Niacin and biosynthesis of PGD2by platelet COX-1 in mice and humans[J].J Clin Invest,2012,112(4):1459-1468.
[3]Sedej M,Schröder R,Bell K,et al.D-type prostanoid receptor enhances the signaling of chemoattractant receptor-homologous molecule expressed on T(H)2cells[J].J Allergy Clin Immunol,2012,129(2):492-500.
[4]Murata T,Aritake K,Tsubosaka Y,et al.Anti-inflammatory role of PGD2in acute lung inflammation and therapeutic application of its signal enhancement[J].Proc Natl Acad Sci U S A,2013,110(13):5205-5210.
[5]Schwartz JI,Liu F,Wang YH,et al.Effect of laropiprant,a PGD2receptor 1 antagonist,on estradiol and norgestimate pharmacokinetics after oral contraceptive administration in women[J].Am J Ther,2009,16(6):487-495.

