西红花酸对RAW264.7巨噬细胞TLR4/NF-κB信号通路的抑制作用及机制探讨
杨如会,刘并进
(丽水学院医学院,浙江丽水323000)
西红花酸是西红花的主要有效成分,可从茜草科植物栀子果实中提取[1]。前期动物实验结果显示,其可抑制炎症性疾病核因子-κB(NF-κB)途径的激活[2,3];进一步的研究显示,西红花酸可以通过抑制蛋白激酶C-θ的磷酸化PKCθ从而抑制NF-κB上游通路中IKKβ的激活[4]。Toll样受体(TLRs)是机体细胞免疫中的关键受体,在天然免疫和获得性免疫中起着核心作用[5]。TLR4是 TLRs家族中的重要亚型,除了可以识别微生物等外源性物质外,还可作为内源性物质的信号传导途径。在TLR4信号传递途径上,一条是通过翻译起始区结构域招募接头分子MyD88对信号通路进行传导[6]。另一条是通过招募接头蛋白TRIF进行信号传递[7]。2013年4月~2014年2月,我们采用TLR4配体LPS刺激RAW264.7巨噬细胞,同时用西红花酸和 MyD88 siRNA进行干预,以期探讨西红花酸对巨噬细胞TLR4/NF-κB信号途径的作用是否通过MyD88信号通路实现。
1 材料与方法
1.1 材料 药品和试剂:西红花酸:砖红色粉末,由中国药科大学药理实验室精制(含量≥98%,HPLC),实验时以二甲基亚砜(DMSO)溶解,再以PBS稀释成所需浓度,DMSO的终浓度不超过0.01%(v/v);RAW264.7细胞株:中科院上海细胞库;LPS、zymosan A:Sigma 公司;MyD88、p-JNK、NF-κB/p65 和 GADPH一抗:abcam公司;TNF-α、IL-6 ELISA试剂盒:Uscnk公司;转染试剂LipofectamineTM2000:Invitrogen公司。小鼠MyD88基因特异性siRNA由上海吉玛制药公司根据NCBI数据库中MyD88(NM_010851.2)分别设计3条针对MyD88基因的3条siRNA,分别为:sr-1正义5'-GACUGAUUCCUAUUAAAUA-3',反义 5'-UAUUUAAUAGGAAUCAGUC-3';sr-2正义5'-CGUUCUCUACCAUAGAGGC-3',反义 5'-GCCUCUAUGGUAGAGAACGC-3';sr-3:正义 5'-GCAUUUUAAAGCAACCUGG-3',反义5'-CCAGGUUGCUUUAAAAUGC-3';阴性对照为无义序列NC siRNA。
1.2 MyD88 siRNA转染及最佳siRNA的确定RAW264.7巨噬细胞用含10%胎牛血清的DMEM高糖培养基(含100 IU/mL青霉素和100 IU/mL链霉素)在37℃、5%CO2条件下培养,根据细胞生长情况,每隔2~3 d换液1次。细胞转染方法:将4条MyD88 siRNA分别和转染试剂按照说明书中的比例混合,加入细胞培养皿中,24 h后提取各基因和蛋白,RT-PCR和Western blotting法确定出最佳siRNA。
1.3 分组 MyD88 siRNA转染24 h后换无血清培养基继续培养12 h进行实验分组:NC siRNA转染组(A 组)、空白对照组(B 组)、LPS 500 μg/L 组(C组)、LPS 500 μg/L+西红花酸(10-5mol/L)+MyD88 siRNA转染组(D 组),LPS 500 μg/L+西红花酸(10-5mol/L)组(E组)。每组设6个平行复孔,按上述条件分别处理24 h后提取蛋白和基因备用。
1.4 RAW264.7 巨噬细胞 IL-6、MCP-1、TNF-α、IFN-β和iNOS mRNA的检测 采用RT-PCR法。根据 GeneBank 基因序列设计 IL-6、MCP-1、TNF-α、IFN-β、iNOS mRNA引物序列,由上海生工生物工程公司合成,引物序列如下:MyD88:5'-CTATCACCTCCAGGTTTCTA-3',5'-GAAGACATTGAGCCACCTTA-3',299 bp;IL-6:5'-AGTTGCCTTCTTGGGACTGA-3',5'-GCCACTCCTTCTGTGACTCC-3',521bp;TNF-α:5'-ACGGCA-TGGATCTCAAAGAC-3',5'-GGTCACTGTCCCAGCATCTT-3',550 bp;iNOS:5'-GTGGTGACAAGCACATTTGG-3',5'-GGCTGGACTTTTCACTCTGC-3',487 bp;MCP-1:5'-TGAGGTGGTTGTGGAAAAGG-3',5'-CCTGCTGTTCACAGTTGCC-3',382 bp;IFN-β:5'-AGCAGCTGAATGGAAAGATCAAC-3',5'-GGATGGCAAAGGCAGTGTAAC-3',124 bp;GAPDH:5'-TGCTCGAGATGTCATGAAGG-3',5'-TTGCGCTCATCTTAGGCTTT-3',522 bp。收集各组处理后细胞,用TRIzol提取总RNA,紫外分光光度计测定核酸的浓度和纯度,转录成cDNA,BIO-RAD PCR仪进行基因扩增,PCR 反应条件:94 ℃、5 min,94 ℃、45 s,55 ℃、40 s,72℃、60 s,然后第2~4个步骤进行30个循环,最后72℃、5 min,反应结束后4℃保存,收集扩增产物进行琼脂糖电泳分析。对PCR反应产物进行1.0%(w/v)琼脂糖凝胶100 VA电泳45 min,用凝胶图像分析系统采集图像。图像分析:Quantity One v4.62 Software分析软件对扩充基因的电泳条带进行灰度分析,以目的条带的光密度值与相应的GADPH条带的光密度值进行比较。
1.5 RAW264.7 巨噬细胞 NF-κB/p65、p-JNK 蛋白的检测 提取细胞总蛋白,BCA法测定蛋白定量,制备10%聚丙烯酰胺凝胶,进行SDS-PAGE电泳,并实施PVDF转膜,Western blotting法检测p-JNK、NF-κB/p65 和 GADPH 蛋 白 表 达,采 用Bio-Rad凝胶成像系统进行分析,蛋白表达量用光密度值表示,以GADPH作为内参对照。
1.6 RAW264.7细胞培养液中 TNF-α 和 IL-6的水平的检测 采用ELISA法。收集不同方法处理的RAW264.7细胞的上清液,按ELISA试剂盒说明操作,每组设6个复孔,检测细胞因子TNF-α和IL-6水平。
1.7 统计学方法 采用SPSS10.0统计软件。计量资料以±s表示,两组比较采用配对t检验,总体差异显著性分析采用方差分析(one-way AVONA)。P≤0.05为差异有统计学意义。
2 结果
2.1 各组 TNF-α、MCP-1、iNOS、IL-6、IFN-β mRNA比较 见表1。
2.2 各组 p-JNK、NF-κB/p65 蛋白表达及 TNF-α、IL-6水平比较 见表2。
3 讨论
巨噬细胞表面TLR4属于TLRs家族重要模式识别受体,作为炎症信号传递门户蛋白,能够识别特定类型微生物的保守分子成分,从而激活信号转导途径,诱导炎症反应;还参与机体细胞增殖与分化以及炎症细胞凋亡等生理过程[8]。NF-κB在TLR4下游信号通路处于枢纽位置,NF-κB家族由一组转录因子构成,其中p65是其中的一个核转录因子,其活化后,NF-κB与IκB解离并进入细胞核,在细胞核内与DNA特定序列结合,调节炎性细胞因子、细胞增殖(抗凋亡)等基因的转录,参与炎症调节、淋巴细胞成熟、体液免疫、固有免疫和免疫器官的活化等。
表 1 各组 TNF-α、MCP-1、iNOS、IL-6 和 IFN-β mRNA 相对表达量(±s)
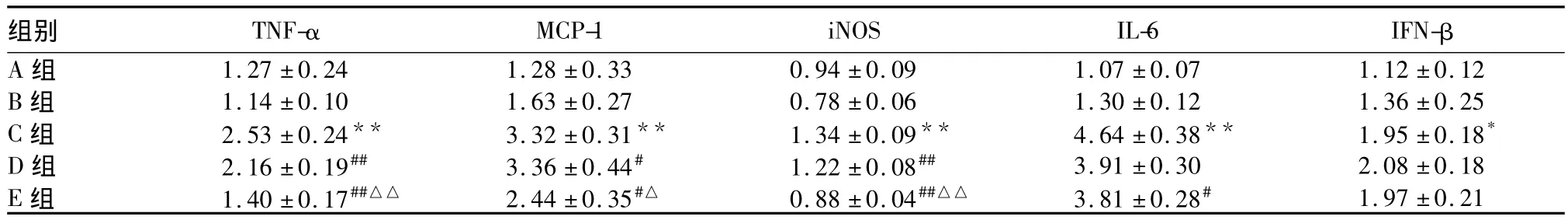
表 1 各组 TNF-α、MCP-1、iNOS、IL-6 和 IFN-β mRNA 相对表达量(±s)
注:与 B 组比较,*P <0.05,**P <0.01;与 C 组比较,#P <0.05,##P <0.01;与 D 组比较,△P <0.05,△△P <0.01。
组别 TNF-α MCP-1 iNOS IL-6 IFN-β A 组 1.27±0.24 1.28±0.33 0.94±0.09 1.07±0.07 1.12±0.12 B 组 1.14±0.10 1.63±0.27 0.78±0.06 1.30±0.12 1.36±0.25 C 组 2.53±0.24** 3.32±0.31** 1.34±0.09** 4.64±0.38** 1.95±0.18*D 组 2.16±0.19## 3.36±0.44# 1.22±0.08## 3.91±0.30 2.08±0.18 E 组 1.40±0.17##△△ 2.44±0.35#△ 0.88±0.04##△△ 3.81±0.28#1.97±0.21
表2 各组 p-JNK1/2、NF-κB/p65 蛋白及 TNF-α、IL-6 水平比较(±s)

表2 各组 p-JNK1/2、NF-κB/p65 蛋白及 TNF-α、IL-6 水平比较(±s)
注:与 A组比较,**P <0.01;与 B 组比较;#P <0.05,##P <0.01;与 C 组比较,△P <0.05,△△P <0.01。
组别 p-JNK1/2 NF-κB/p65 TNF-α(pg/mL) IL-6(pg/mL)A组0.92±0.09 1.04±0.08 14.01±1.35 16.22±1.62 B 组 0.94±0.05 1.17±0.07 14.49±1.24 15.61±1.93 C 组 1.30±0.14* 2.03±0.09** 40.16±5.08** 82.10±8.97**D 组 1.17±0.07# 2.03±0.13# 37.59±4.33** 76.88±8.83**E 组 1.01±0.06#△ 1.78±0.09#△ 20.05±4.26##△△ 40.32±6.74##△△
目前认为,除TLR3外,TLR/NF-κB通路有两条途径,MyD88依赖的信号通路主要介导NF-κB活化、细胞因子的产生。调控启动细胞因子如MCP-1、TNF-α、IL-6等的表达、增强后继炎症因子如iNOS的表达;或者TRAF-6激活JNK途径(引起JNK1/2的磷酸化),引导下游通路转录活化蛋白-1的激活;TLR4的非MyD88依赖途径,通过细胞因子IRF3的激活调控IFN-β等相关基因的表达,另外,TRIF还可以与RIP1相互作用,激活IKK1-IKK2-NEMO复合物,进而激活NF-κB。TLR4可被LPS等配体激活,通过MyD88依赖和非依赖两条途径进行信号传递。
在本实验中,LPS是TLR4的特异性配体,LPS刺激 RAW264.7巨噬细胞后,炎症因子 TNF-α、MCP-1、iNOS、IFN-β 和 IL-6 mRNA 明显升高,NF-κB的活性上调;并引起JNK1/2的磷酸化,激活下游炎症通路,引起相关炎症因子TNF-α和IL-6的表达增加。在给予西红花酸干预后,MyD88依赖途径的炎症因子TNF-α、MCP-1、iNOS和IL-6均有明显下降,p-JNK和NF-κB/p65可被西红花酸抑制,下游炎症因子TNF-α和IL-6也明显降低,和前期研究[2]相一致。通过siRNA对MyD88进行基因沉默后,西红花酸对TLR4信号通路的上述作用被阻断,说明西红花酸对TLR4信号通路的作用可能与MyD88相关。在本研究结果表1中可以看出,在TLR4非MyD88信号通路中,LPS刺激同样可以引起IFN-β mRNA升高,但西红花酸对 IFN-β的作用不明显,在对MyD88进行基因干扰后,IFN-β mRNA没有明显变化。说明在非依赖MyD88信号的TRIF途径中,西红花酸和MyD88作用均不明显。
综上认为,西红花酸对TLR4/NF-κB信号途径的抑制作用主要是通过MyD88依赖途径实现的。
[1]Xi L,Qian Z,Xu G,et al.Beneficial impact of crocetin,a carotenoid from saffron,on insulin sensitivity in fructose-fed rats[J].J Nutr Biochem,2007,18(1):64-72.
[2]Yang R,Yang L,Shen X,et al.Suppression of NF-κB pathway by crocetin contributes to attenuation of lipopolysaccharide-induced acute lung injury in mice[J].Eur J Pharmacol,2012,674(2-3):391-396.
[3]Yan J,Qian Z,Sheng L,et al.Effect of crocetin on blood pressure restoration and synthesis of inflammatory mediators in heart after hemorrhagic shock in anesthetized rats[J].Shock,2010,33(1):83-87.
[4]Yang L,Qian Z,Ji H,et al.Inhibitory effect on protein kinase Ctheta by Crocetin attenuates palmitate-induced insulin insensitivity in 3T3-L1 adipocytes[J].Eur J Pharmacol,2010,10(642):47-55.
[5]Turner ML,Cronin JG,Healey GD,et al.Epithelial and stromal cells of bovine endometrium have roles in innate immunity and initiate inflammatory responses to bacterial lipopeptides in vitro via Toll-like receptors TLR2,TLR1,and TLR6[J].Endocrinology,2014,155(4):1453-1465.
[6]Zeng-Brouwers J,Beckmann J,Nastase MV,et al.De novo expression of circulating biglycan evokes an innate inflammatory tissue response via MyD88/TRIF pathways[J].Matrix Biol,2014,(35):132-142.
[7]Brieger A,Rink L,Haase H.Differential regulation of TLR-dependent MyD88 and TRIF signaling pathways by free zinc ions[J].J Immunol,2013,191(4):1808-1817.
[8]丁志祥,钱高潮,张琪.血脉通颗粒对动脉粥样硬化小鼠外周血单核细胞 TLR4、IL-6、TNF-α 的影响[J].山东医药,2013,53(44):4-6.

