豹源猫杯状病毒ORF2基因的扩增、克隆及原核表达
(吉林农业大学动物科技学院,吉林长春130118)
(吉林农业大学动物科技学院,吉林长春130118)
为制备猫杯状病毒血清学检测抗原,本研究根据实验室保存的1株豹源猫杯状病毒基因序列设计引物,扩增了开放阅读框2(ORF2)中1 734 bp的核苷酸序列,将其克隆至表达载体pET-28a上,构建了pET-28a-FCV1734重组质粒。将该质粒转化大肠杆菌,诱导表达产物经SDS-PAGE和Western blot检测,证明所表达的蛋白具有良好的反应原性。
猫杯状病毒;ORF2基因;表达
猫杯状病毒(Feline calicivirus,FCV)是引起猫及猫科动物口腔和上呼吸道感染的病原,单独感染常不会引起严重的疾病,和其他病原发生混合感染可加重病情[1]。轻者出现口腔溃疡、牙周炎、结膜炎等症状,重者引发肺炎、肠胃炎和跛行等。该病毒最早在1957年被分离得到,全基因序列由Carter M J等测定[2]。FCV引发的猫传染性鼻-结膜炎呈世界性分布,所有的猫科动物都易感,也有感染狗的报道[3]。近年来,出现了高致死性变异强毒株[4],在意大利[5]、法国[6]和英国[7]已有报道。
FCV呈二十面体对称,无囊膜,病毒粒子直径为30~39 nm。衣壳蛋白由32个暗色的中空杯状壳粒构成。病毒核酸为单股正链RNA,基因组全长约7.8 kb,有3个开放阅读框(ORF)。ORF1编码非结构蛋白。ORF2编码病毒的主要结构蛋白VP1,分为6个区域(A~F),其中C、D、E含有多抗原位点,C和E为可变区域。ORF2先合成75 kDa的前体衣壳蛋白,后经蛋白酶加工切除后,形成62 kDa的衣壳蛋白[8]。ORF3编码大小约为12 kDa的结构蛋白VP2。不同FCV毒株之间ORF2可变区的差异较大,各毒株间同源性在57%~79%[9]。
本研究根据实验室保存的1株豹源猫杯状病毒ORF2比较保守的区域设计了1对引物,扩增获得了1 734个核苷酸序列,克隆至表达载体pET-28a上,转化入大肠杆菌进行了表达,并以Western blot检测了重组蛋白的反应原性,为该病毒血清检测抗原的制备奠定了基础。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒大肠埃希菌DH5α工程菌、Bl21(DE3)工程菌购自北京全式金公司;质粒pET-28a和含有豹源FCV ORF2基因的质粒均为本实验室保存和构建。
1.1.2 主要试剂ExTaq DNA聚合酶、T4 DNA连接酶、限制性内切酶EcoR I和Xho I购自TaKaRa公司;猫杯状病毒抗体由本实验室自制,HRP标记的y羊抗猫二抗购自美国BETHYL公司;Protein Marker质粒小量提取试剂盒购自OMEGA公司,琼脂糖凝胶购自西班牙BIOWEST公司,琼脂糖电泳回收试剂盒购自AXYGEN公司,Proten Marker购自北京全式金公司;DAB显色试剂盒购自北京中杉桥生物公司。
1.2 方法
1.2.1 引物的设计及合成根据本实验室已经完成全基因序列测定的豹源FCV的ORF2序列设计引物,选择的酶切位点为EocR I/Xho I,扩增目的片段长度为1 734 bp。上游引物序列:CCGGAATTCCGGATGTGCTCAACCTGCGCTAA;下游引物序列:CCGCTCGAGGTTAATGACATAGCCCAATTTTAGTGTG。引物送往生工生物工程上海股份有限公司合成。
1.2.2 目的基因片段的扩增以本实验室保存的含有豹源FCV ORF2的质粒为模版,用高保真ExTaq DNA聚合酶进行目的基因的扩增。扩增体系为:模板2 μL、dNTPs 2 μL,PCR缓冲液2.5 μL,上、下游引物各0.5 μL,ExTaq DNA聚合酶0.3 μL,双蒸馏水17.2 μL。反应条件:95℃预变性5 min, 94℃变性30 s,退火温度60℃30 s,72℃延伸1.5 min,共35个循环,72℃最终延伸10 min。反应结束后,将PCR产物于1%的琼脂糖凝胶电泳进行检测。
1.2.3 目的基因片段和质粒的酶切及回收将扩增的目的片段回收后,利用EocR I和Xho I分别进行单酶切,再对pET-28a质粒进行EocR I和Xho I酶切。酶切体系为:EcoR I酶1 μL,10×H缓冲液1 μL,PCR产物4 μL,水4 μL,37℃作用4 h,小牛肠碱性磷酸酶(CIAP)0.2 μL/管,37℃作用1 h。按照AXYGEN胶回收试剂盒说明书回收酶切产物。
1.2.4 重组质粒pET-28a-FCV1734的构建及鉴定将经酶切的目的片段和pET-28a质粒用T4 DNA连接酶连接过夜,转化到DH5α工程菌中,37℃培养过夜;挑取单个菌落,涂布于50 μg/mL卡纳霉素的LB培养基中,震荡培养,按照OMEGA质粒提取试剂盒提取质粒。以EocR I和Xho I酶切鉴定重组质粒,将阳性质粒送上海生工生物公司测序。
1.2.5 外源基因的表达及Western blot分析将含有重组质粒pET-28a-FCV1734的大肠杆菌接种于含卡那霉素(50 μg/mL)的液体LB培养基中,37℃180 r/min培养过夜;次日以1%(W/W)的浓度接种相同LB培养基,37℃180 r/min摇菌培养,当菌液OD600值达0.6~0.8时,加入IPTG(终浓度为0.8 mmol/L)在25℃条件下诱导6~8 h;取诱导菌10 000 r/min离心2 min,弃去上清,加入50 mL PBS将菌重悬,10 000 r/min离心2 min,重复2次。将重组菌在冰浴上超声破碎7 min,间隔3~5 s;7 000 r/min离心15 min,分别取上清和沉淀加入4倍上样缓冲液,煮沸后进行SDS-PAGE(浓缩胶为5%,分离胶为15%)分析。同时设pET-28a空载体做对照,经考马斯亮蓝染色观察结果。常规方法进行电转移,4℃5%脱脂奶粉封闭过夜,TBST洗涤3次,每次5 min;FCV阳性血清37℃60 r/min摇床孵育1 h,同上方法洗涤;HRP标记羊抗猫IgG,37℃60 r/min摇床孵育1 h,洗涤同上。中山金桥DAB试剂盒显色分析。
2 结果和分析
2.1 目的基因片段的扩增以本实验室保存的含有豹源FCV ORF2的质粒为模版,进行PCR扩增,于1%的琼脂糖凝胶电泳,结果如图1所示,在1 734 bp处出现与预期大小相符的目的条带。
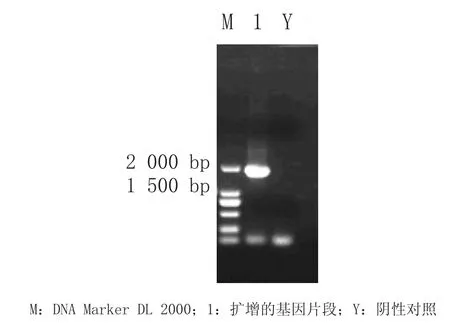
图1 PCR结果Fig.1 The result of PCR
2.2 重组质粒pET-28a-FCV1734的构建及鉴定将连接产物转化到大肠埃希菌DH5α工程菌,提取质粒后进行EcoR I和Xho I双酶切鉴定,酶切后于1%的琼脂糖凝胶电泳检测酶切,结果如图2所示,分别在5 000 bp和1 734 bp出现与预期大小相同的核苷酸条带。由此证明,FCV 1734核苷酸片段成功连入pET-28a表达载体中。基因测序结果与已知序列完全一致。
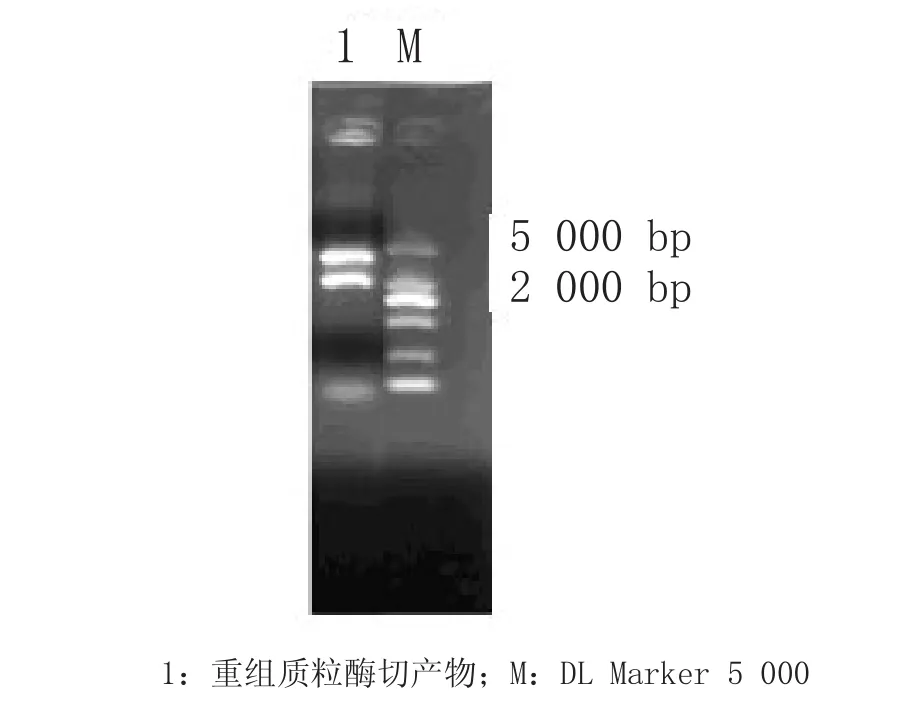
图2 重组质粒pET-28a-FCV1734的酶切鉴定Fig.2 Identification of the recombinant plasmid pET-28a-FCV1734 by enzyme
2.3 外源基因的表达及鉴定经IPTG诱导,重组菌超声破碎,SDS-PAGE电泳结果如图3,从图3中可见,在70 kDa出现的目的蛋白,与预期蛋白大小相符合。
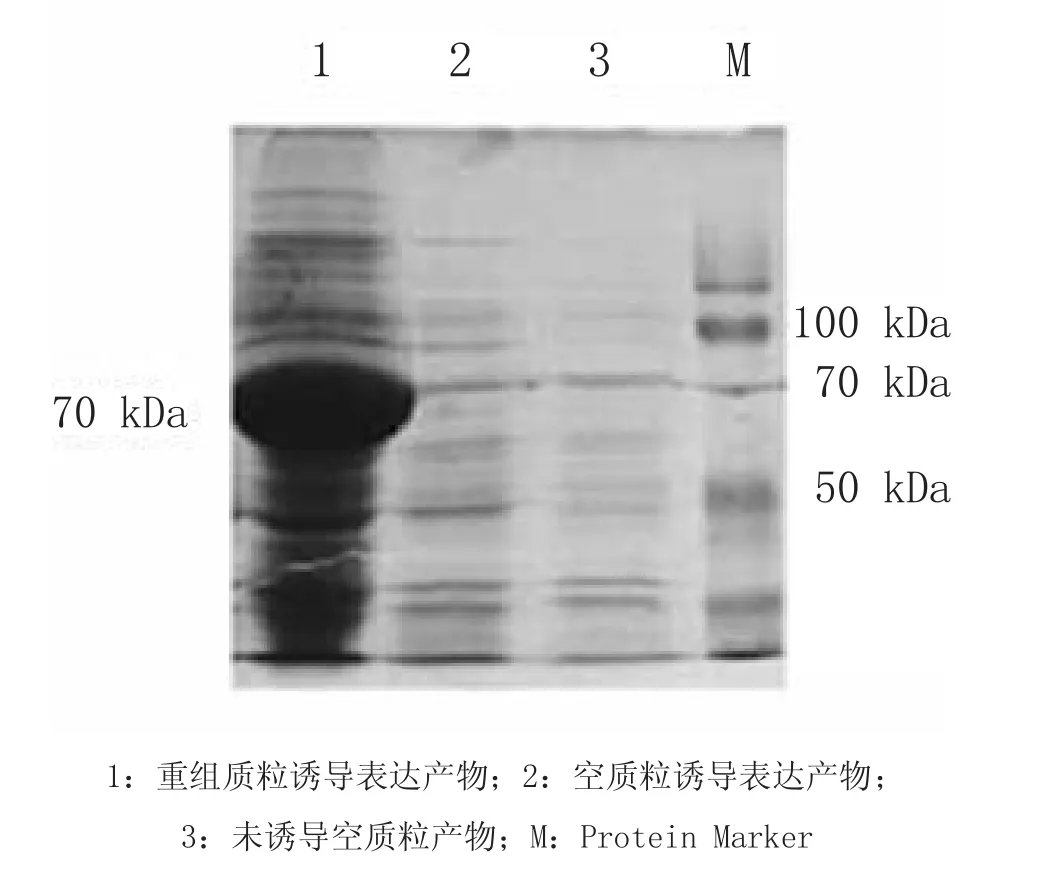
图3 SDS-PAGE结果Fig.3 The result of SDS-PAGE
以常规方法进行电转、封闭、FCV阳性血清、二抗孵育后,DAB试剂盒显色结果如图5,在70 kDa处有特异性条带,证明表达的蛋白能够与FCV的阳性血清、HRP羊抗猫IgG酶标二抗反应。由此说明,表达产物具有良好的反应原性。
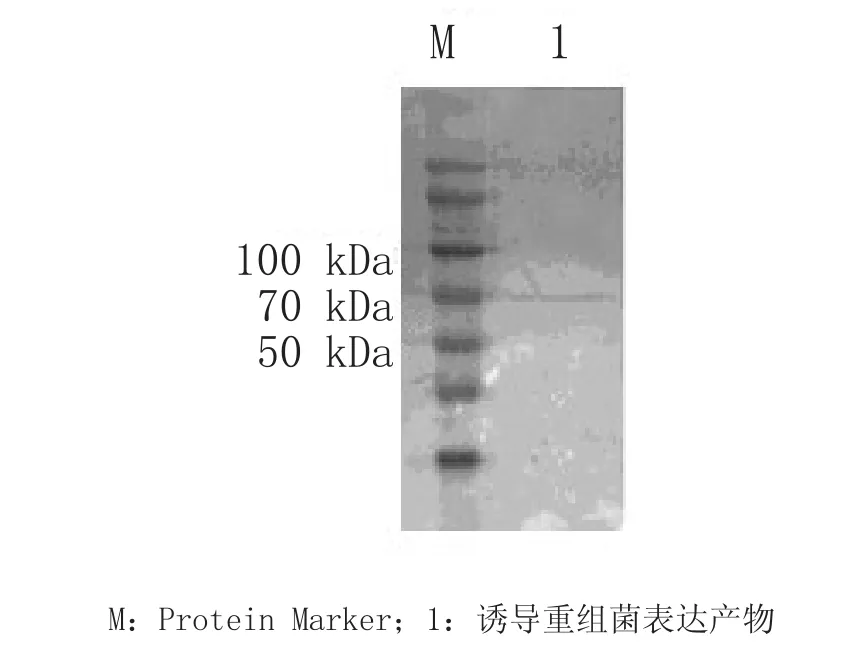
图4 Western blot结果Fig.4 The result of Western blot
3 讨论
FCV ORF2编码的衣壳蛋白由A~F 6个区域构成,其中,C、D和E区含有多个抗原表位,其相对比较保守,且与病毒的进化关系密切[10]。此外,在ORF2基因上存在起始密码子和终止密码子,其中的1 734 bp的基因序列中含有ORF2的所有抗原表位,因此,本试验选择了该段序列进行了扩增、克隆、表达和活性分析以制备FCV血清学检测用抗原。
由FCV引起的猫传染性鼻结膜炎在临床症状上与由猫疱疹病毒1型引起的猫传染性鼻气管炎难以区别,且常和其他病原混合感染,给该病的临床诊断带来困难[11]。因此,建立病原学和血清鉴别诊断方法有实际意义。Martella V等[12-14]建立了对FCV检测的普通PCR方法,姜雪等[15]建立了荧光定量PCR检测方法,均可以用于该病的确诊。Robert C.H.Lau等[16]建立了FCV间接ELISA方法,用来评估猫杯状病毒减毒疫苗的免疫原性;Merial[17]利用间接ELISA方法检测猫传染性鼻气管炎病毒、猫细小病毒和FCV抗体。目前,国内尚无检测FCV的血清学商品试剂盒。本研究利用本实验室分离得到的1株豹源FCV,依据已知的基因序列设计了引物,成功克隆到表达载体pET-28a上,获得了重组表达质粒pET-28a-FCV1734并进行了原核表达,表达的蛋白经Western blot检测表明具有良好的反应原性。本试验结果为FCV血清学检测抗原的制备奠定了基础。目前,笔者以该重组抗原初步建立了FCV间接ELISA方法,正在开展我国猫传染性鼻结膜炎的血清学调查研究。
[1]Elizabeth S,Williams,Ian K.Infectious diseases of wild mammals[M].Third edition,Iowa:Iowa state university press,2001,4:280-291.
[2]王祥生,夏咸柱,范泉水,等.虎暴发锥虫一起[J].中国兽医科技,1999,29(7):34-35.
[3]Horimoto T,Takeu Y,Iwatsuki-Horimoto K,et al.Analysis of the capsid protein Gene of a Feline-like Calicivirus Isolated from a Dog [J].Vet M icrobiol,2002,84(4):315-322.
[4]Schorr-Evans E M,Poland A,Johnson W E,et al.AnEpizooticofHighlyVirulentFeline Calicivirus Disease in a Hospital Setting in New England[J].J Feline Med Surg,2003,5 (4):217-226.
[5]Battilani Mara,Vaccari Francesca,Carelle Maria Stella,et al.Virulent feline calicivirus disease in a shelter in italy:A case description[J].ResearchinVeterinaryScience, 2013,1:25-28.
[6]Reynolds Brice S,Poulet Hervé,Pingret Jean-Luc,etal.Anosocomialoutbreakoffeline calicivirus associated virulent systemic diseaseinFrance[J].JournalofFelineMedicine&Surgery,2009,11(8):633-644.
[7]Coyne KP,Jones BRD,Kipar A,et al.A lethal outbreakofdiseaseassociatedwithfeline calicivirusinfectionincats[J].VetRec, 2006,158(16):544-550.
[8]谢守玉,张健騑.猫杯状病毒分子生物学特征及研究进展[J].中国动物传染病学报,2010,18(6):79-83.
[9]高玉伟,夏咸柱,扈荣良,等.猎豹与虎猫杯状病毒的分离及其超变区基因比较研究[J].中国预防兽医学报,2003,25(3):179-182.
[10]赵艳丽,董宏伟,陈小庆,等.猫杯状病毒基因及其抗原多样性研究进展[J].中国预防兽医学报,2014,36(3):251-254.
[11]陆承平.兽医微生物学[M](第5版)北京:中国农业出版社,2012:470-471.
[12]Martella V,Pratelli A,Gentile M,et al. Analysis of the capsid protein gene of a felinelikecalicivirusisolatedfromadog [J].Vet Microbio,2002,85(4):315-322.
[13]Coyne K.P.,Dawson S.,Radford A.D.,et al. Longtermanalysisoffelinecalicivirus prevalenceandviralsheddingpatternsin naturally infected colonies of domestic cats [J].Vet.Microbiol.2006,118:12-25.
[14]Holst B.S.,Berndtsson L.T.,Englund L.Isolationoffelineherpesvirus-1andfeline calicivirusfromhealthycatsinSwedish breedingcatteries[J].FelineMed.Surg, 2005,7:325-331.
[15]姜雪,高玉伟,胡桂学,等.猫杯状病毒荧光定量PCR检测方法的建立及初步应用[J].吉林大学学报,2013,51(5):973-977.
[16]Robert C.H.Lau,Alison J.Halliday,Hugh Davies.Evaluation of the immunogenicity of attenuated feline calicivirus vaccines by ELISA [J].Veterinary Microbiology,1992,6:139-146.
[17]Merial.AlternativeEarlyLifeVaccination Programs for Companion Animals[J].Elsevier. 2007,137(11):67-71.
(编辑:张婷婷)
豹源猫杯状病毒ORF2基因的扩增、克隆及原核表达
刘秋艳,应瑛,王一鸣,陈小庆,赵艳丽,胡桂学⋆
Amplification,Clone and Prokaryotic Expression of ORF2 Gene of Feline Calicivirus Isolated from Leopard
Liu Qiuyan,Ying Ying,Wang Yiming,Chen Xiaoqing,Zhao Yanli,Hu Guixue
(College of Animal Science and Technology,Jilin Agricultural University,JilinChangchun130118)
In order to prepare the antigen for serological detection of Feline calicivirus,the primers were designed in according to the gene sequence of 1 FCV isolated from a leopard preserved in our laboratory.The 1 734 nucleotides in open reading frame 2(ORF2)were amplified and cloned into expression vector pET-28a to construct recombinant plasmid named pET-28a-FCV1 734.The recombinant plasmid was transformed into E.coli.The expression product induced by IPTG was determined by SDS-PAGE and Western blot.The result proved that the expressed protein had good reactogenicity.
Feline calicivirus;ORF2 gene;Expression
S852.65文献标识码:B文章编号:1672-9692(2015)01-0001-04
2015-01-12
刘秋艳(1989-),女,在读硕士,研究方向为动物病毒学。
胡桂学(1963-),男,教授,博士研究生导师,研究方向为动物病毒学。
公益性行业(农业)科研专项(201303042)

