两种粪肠球菌的分离方法比较
(1.辽宁省兽药饲料畜产品质量安全检测中心,辽宁沈阳110016;2.辽宁成大生物股份有限公司,辽宁沈阳110179)
(1.辽宁省兽药饲料畜产品质量安全检测中心,辽宁沈阳110016;2.辽宁成大生物股份有限公司,辽宁沈阳110179)
本研究利用采集的鸡泄殖腔和猪肛门拭子样本400份,采用两种方法分离粪肠球菌并进行对比。结果显示,两种方法对4类样品中粪肠球菌的分离率分别为22%、33%、23%、22%(方法Ⅰ)和86%、91%、87%、82%(方法Ⅱ),说明建立了准确、高效、可靠的粪肠球菌分离方法。
粪肠球菌;分离纯化;方法比较
肠球菌属于1984年从链球菌属中分离出来成为独立的新菌属[1-2],现根据DNA同源性,将其列为肠球菌属,属肠(见兽医微生物学第五版第90页)球菌科。肠球菌在自然界分布广泛,是水、空气、尘埃、人及动物粪便以及健康上呼吸道的常在菌,粪肠球菌和屎肠球菌是引起医院内感染的主要肠球菌种[3],已经成为医院内感染的第二大病原[4-6],但在动物医学领域,对该病原的研究很少[7-9]。美国食品药品监察管理局(FDA)、疾病预防控制中心(CDC)和美国农业部(USDA)共同组成一个全国性的监测网络,监测选定的动物肠道病原菌和动物、零售肉类和人的共生生物对在人医和兽医中有重要意义的抗菌素的耐药性的变化情况[10],该部门从2003年开始监测粪肠球菌的耐药变化情况。我国兽医系统也建立了全国动物源细菌耐药性监测网络,建设了国家兽药安全评价实验室体系[11],2013年起把粪肠球菌作为重点监测目标菌株。本文通过比较传统方法与本实验室自建的分离鉴定方法,对动物源粪肠球菌进行分离和鉴定,摸索出适合实际工作应用的粪肠球菌的一套快速、准确、可靠的分离鉴定方法。
1 材料与方法
1.1 菌株及待分离材料来源质控菌株为ATCC29212,购自中国兽药监察所;待分离材料采自养殖场(户)。
1.2 仪器生物安全柜CLASSⅡ(美国NUAIRE公司);全自动高压灭菌器(日本三洋电器集团);ABT Expression鉴定仪(BIOMERIEUX公司)。
1.3 培养基与材料运送培养基、肠球菌显色培养基、肠球菌肉汤培养基、哥伦比亚血琼脂、革兰氏染色液购自北京陆桥技术有限责任公司;粪肠球菌琼脂培养基购自青岛高科园海博生物技术有限公司;API NaCl 0.85%培养基、ID32E鉴定条均购自BIOMERIEUX公司。
1.4 方法
1.4.1 采样用灭菌棉签采集动物肛门和泄殖腔样品,置于运送培养基中0~4℃保存。
1.4.2 分离纯化方法Ⅰ取拭子样品直接接种于粪肠球菌琼脂平面,36±1℃培养48 h。挑取粪肠球菌可疑菌落,接种于肠球菌显色培养基36±1℃培养48 h。将疑似菌株接种于哥伦比亚血琼脂上36± 1℃培养24 h,备用。
1.4.3 分离纯化方法Ⅱ将拭子样品直接放入肠球菌肉汤中,36±1℃培养24 h。挑取预增菌培养物划线接种于粪肠球菌琼脂培养基36±1℃培养48 h。将疑似菌株接种于哥伦比亚血琼脂上36± 1℃培养24 h,备用。
1.4.4 形态学鉴定挑取肉汤培养物及平板上单菌落分别作革兰氏染色,光学显微镜下观察细菌形态和染色特征。
1.4.5 生化鉴定将上述获得的疑似单菌落,在哥伦比亚血琼脂平板上划线纯化培养不超过24 h。将待检细菌单个菌落,悬浮于3 mL悬浮培养基,制备4.0麦氏浓度的菌悬液,使用自动加样器将菌悬液滴入试纸条反应杯中,每个反应杯中滴入55 μL,菌液和试剂滴加完毕后,37℃培养4 h,用细菌鉴定仪判读。
2 结果与分析
2.1 分离纯化结果粪肠球菌琼脂培养基上带棕色环的棕黑色菌落,边缘光滑无白色润圈的为疑似单菌落,白色菌落为其他菌株,结果见图1~图2。
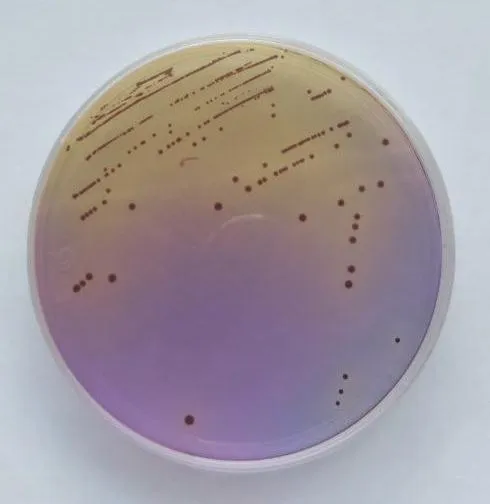
图1 阳性粪肠球菌在粪肠球菌琼脂培养基上的生长形态Fig.1 Positive Enterococcus faecalis growth morphology on Enterococcus faecalis agar medium

图2 阴性对照菌株在粪肠球菌琼脂培养基上的生长形态Fig.2 Negative control strains growth morphology on Enterococcus faecalis agar medium
挑取疑似菌株接种于肠球菌显色培养基培养,红色至紫红色的可疑菌落可进一步确定为粪肠球菌,结果见图3。

图3 粪肠球菌在肠球菌显色培养基上生长状态Fig.3 Enterococcus faecalis growth morphology on Enterococcus chromogenic medium
在肠球菌肉汤中,培养后混浊变黑为疑似粪肠球菌;仍保持澄清透明、棕褐色为阴性,具体结果见图4。

图4 肠球菌肉汤中的生长情况Fig.4 Enterococcus broth growth situation
最终在哥伦比亚血琼脂上菌落圆形、纯白色,表面凸起湿润、有光泽、边缘整齐的菌落确定为阳性粪肠球菌,结果见图5。

图5 粪肠球菌在哥伦比亚血琼脂上的生长状态Fig.5 Enterococcus faecalis growth morphology on Columbia blood agar medium
2.2 鉴定结果检测菌株均为革兰氏阳性菌,细菌呈现圆形或卵圆形,在固体培养基上单个、成对或呈链状排列,链的长短不一、形状各异。两种分离纯化方法得到的疑似菌株经细菌鉴定仪判读后得到的阳性粪肠球菌生化鉴定结果,见表1。

表1 粪肠球菌生化鉴定检验报告单Table1 Enterococcus faecalis biochemical identification inspection report
2.3 两种方法分离率比较通过以上两种试验方法的比较,发现方法Ⅱ的分离率在80%以上,在不同物种不同养殖场分离率都高于方法Ⅰ,具体数据见表2~表3,该方法实用性强,便于推广使用。

表2 两种粪肠球菌分离方法比较Table2 Comparison of two kinds of Enterococcus faecalis separation method

表3 两种分离鉴定粪肠球菌方法比较Table3 Comparison of two kinds of Enterococcus faecalis isolation and identification method
3 讨论
本实验室建立的分离纯化方法Ⅱ,经过3步的分离纯化,粪肠球菌的分离率可达80%~90%,用生化鉴定证明了该方法的阳性率高达98%以上,在实际应用中可省略生化鉴定步骤,作为高效的粪肠球菌筛选方法;而传统的分离纯化方法Ⅰ只有通过生化鉴定最终才能确定是否是阳性菌株,分离效果难以掌控。比较方法Ⅰ和方法Ⅱ详见表3。因此,方法Ⅱ更适用于实际粪肠球菌的分离鉴定。
比较两种方法区别主要是在第一步使用的培养基不同,分别是粪肠球菌琼脂和肠球菌肉汤。粪肠球菌琼脂使用的是平板,肠球菌肉汤使用的是液体培养基,棉签浸浴在肉汤中更利于粪肠球菌的增殖。粪肠球菌琼脂培养基中的月示胨和酵母浸粉提供氮源、维生素、氨基酸和碳源;乳糖是大肠菌群可发酵的糖类;叠氮化钠可抑制革兰阴性菌;溴甲酚紫和TTC(2,3,5-氯化三苯基四氮唑)作为指示剂;琼脂是培养基的凝固剂。肠球菌肉汤培养基中的胰酪蛋白胨和牛肉浸粉、酵母粉提供氮源、维生素和生长因子;氯化钠维持均衡的渗透压;细菌水解七叶苷与柠檬酸铁铵中铁离子反应形成黑色的6,7-二羟基香豆素;柠檬酸钠、牛胆粉和叠氮化钠为选择性抑菌剂,抑制非链球菌的细菌。根据两种培养基的成分和相应的作用,方法Ⅱ中使用的的抑制非链球菌的抑制剂较方法Ⅰ多,从多种途径抑制杂菌的生长,从而达到了良好的分离效果。
[1]齐亚银,剡根强,王静梅,等.致羔羊脑炎型粪肠球菌的分离鉴定[J].石河子大学学报(自然科学版),2005,23(2):200-202.
[2]季尚宁,肖玉珍.土壤灭菌对连作大豆生长发育的影响[J].东北农业大学学报,1996,27(4):326-329.
[3]李光辉.肠球菌感染研究进展[J].国外医学:内科学分册,1999,26(11):471-474.
[4]王豫平,王慕云.肠球菌耐药性研究及对策[J].广西医学,2002,24(1):59-61.
[5]Moellering Jr R C.Emergence of Enterococcus as a significant pathogen[J].Clinical Infectious Diseases,1992:1173-1176.
[6]杜蓉,冯萍.肠球菌的耐药机制研究进展[J].华西医学,2006,21(2):395-396.
[7]苏葳艺,李欣南,韩镌竹.某养殖场鸡源粪肠球菌分离鉴定及耐药性研究[J].现代畜牧兽医,2014,4:48-50.
[8]薛青红,刘燕,杜昕波.猪源粪肠球菌的BIOLOG系统鉴定及其生物学特性[J].中国兽医科学,2006,36(11):876-879.
[9]王亚宾,张红英,陈丽颖,等.临床感染猪肠球菌菌株的分离与鉴定[J].河南农业大学学报,2008,42(5):528-531.
[10]Gilbert J M,White D G,McDermott P F.The US national antimicrobial resistance monitoring system[J].Future Medicine,2007:493-500.
[11]赵晓彤,周铁忠,李欣南.我国动物源细菌耐药性监测现状与耐药性控制策略分析[J].现代畜牧兽医,2013,12:45-48.
(编辑:张婷婷)
两种粪肠球菌的分离方法比较
韩镌竹1,李欣南1⋆,苏葳艺1,杨文腰2
The comparison between two methods to separation and purification of enterococcus faecalis
Han Juanzhu1,Li Xinnan1*,Su Weiyi1,Yang Wenyao2
(1.Liaoning Testing&Inspection Center for Quality&Safety of Veterinary Drugs,Feed and Livestock Products, LiaoningShenyang110016; 2.Liaoning Chengda Company Limited,LiaoningShenyang110179)
400 swab samples collected from chicken cloaca and pig anus were used to compare two methods to separation and purification of enterococcus faecalis.The separation rates of the two methods were 22%、33%、23%、22%(MethodⅠ)and 86%、91%、87%、82%(MethodⅡ).Thus the accurate,fast and reliable method of separation wasestablished.
Enterococcus;Separation and purification;Method comparison
S858.23文献标识码:B文章编号:1672-9692(2015)01-0005-05
2014-11-25
韩镌竹(1985-),女,硕士研究生,主要从事动物源细菌耐药方面工作。
李欣南(1978-),女,博士,主要从事动物源细菌耐药性、微生态制剂、生鲜乳质量安全评价等方面工作。
948课题“兽药监管技术引进”项目编号2011-G14(4)

