一例猪圆环病毒2型与猪肺炎支原体混合感染的诊断
(辽宁省营口市动物疫病预防控制中心,辽宁营口115000)
(辽宁省营口市动物疫病预防控制中心,辽宁营口115000)
辽宁营口某猪场发生猪消瘦、呼吸系统疾病甚至死亡的疫情。采集病料提取病变组织总DNA或RNA进行猪繁殖与呼吸综合征病毒、猪圆环病毒2型、猪细小病毒、猪伪狂犬病病毒、猪瘟病毒、猪肺炎支原体的PCR或RT-PCR检测。PCR扩增出353 bp的猪圆环病毒2型特异性条带和670 bp的猪支原体肺炎特异性条带。诊断为猪圆环病毒2型和猪肺炎支原体混合感染。
猪圈环病毒2型;猪肺炎支原体;混合感染;PCR;诊断
2013年12月,辽宁省营口市某猪场部分断奶猪和育肥猪生长缓慢、体温升高、呼吸困难、消瘦等主要特征的传染病。具体症状为精神沉郁,体温为40~41℃,双耳及四肢末端发绀,妊娠母猪流产,仔猪呼吸困难,育肥猪清晨和傍晚出现咳嗽现象,眼结膜炎,眼睑水肿,有呼吸道症状,后躯无力,共济失调。新生仔猪发生死亡,伴有呕吐、腹泻及发抖,震颤和运动失调等神经症状。根据症状,初步怀疑为猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)、猪肺炎支原体(Mhp)一种或者几种混合感染。
采集病死猪及病危猪的心脏、肝脏、脾脏、肺脏、肾脏等病料进行猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)、猪肺炎支原体(Mhp)的PCR或RT-PCR检测。
1 材料与方法
1.1 样品的采集辽宁省营口市某养猪场送检猪的心脏、肝脏、脾脏、肺脏、肾脏、血清等病料共10份。
1.2 培养基TSA固体培养基,含5%小牛血清和0.5%NAD。
1.3 主要酶和试剂RNA反转录酶、Taq DNA聚合酶、dNTPs、DNA Marker购自TaKaRa公司;琼脂糖凝胶电泳染色剂Goldview购自赛百盛生物公司;蛋白酶K、SDS、Trizol试剂购自欣经科化学试剂公司;苯酚、氯仿、异戊醇及常用化学试剂购自北京市化学试剂公司;生化鉴定试剂盒购白杭州天和微生物试剂有限公司;管式液体样品病毒DNAout试剂盒购自TIANDZ公司。
1.4 引物参考岳丰雄设计引物[1(]见表1),引物由上海Invitrogen合成,用高压灭菌ddH2O溶解配成10 pmol/L,-20℃保存备用。

表1 引物设计Table1 Primer Design
1. 5PRRSV和CSFV的RT-PCR检测
1.5.1 病毒总RNA的提取病毒总RNA的提取按Trizol试剂使用说明书提取样品总RNA进行,室温自然干燥,加入适量DEPC处理过的水溶解沉淀,待RNA沉淀完全溶解后,-20℃保存备用。
1.5.2 RT-PCR反转录反应按Promega公司的使用说明书进行:取总RNA 7μL,加入20 μL反转录体系中,包括4 μL反转录溶液(50 mmol/L,pH 8.3 Tris-HCl。75 mmol/L KCl,3 mmol/L MgCl2,10 mmol/I DTT),6 μL dNTPs,1 μL OligodT引物(50 pmol/L),1 μL M-MLV反转录酶(200 U/ μL)和1 μL RNase Inhibitor(40 U/μL),用DEPC水补至20 μL,42℃水浴1 h,70℃10 min,置-20℃备用。PCR反应程序为:94℃预变性5 min;94℃变性45 s,58.6℃(PRRSV)或55.6℃(CSFV)退火1 min,72℃延伸1 min,30个循环;72℃延伸7 min。取5 μL PCR扩增产物于1%琼脂糖凝胶电泳进行鉴定[2]。
1.6 PCV2和PRV的PCR检测
1.6.1 病毒总DNA的提取采用酚氯仿抽提法提取病料中的DNA,室温干燥,加入20μL灭菌ddH2O,-20℃保存备用。
1.6.2 PCV2和PRV的PCR扩增PCR反应程序为:94℃预变性5 min;94℃变性45 s,58.6℃(PCV2)、55℃(PPV)、61℃(PRV)退火1 min,72℃延伸1 min,30个循环;72℃延伸7 min。取5 μL PCR扩增产物于l%琼脂糖凝胶电泳进行鉴定[3]。
1.6.3 Mhp基因组的提取按TIANDZ公司柱式细菌DNAout试剂盒说明书进行。-20℃备用。
PCR反应体系(50 μL)如下:TaKaRa Taq(5 U/ μL)25 μL;10xPCR Buffer(Mg2+Plus)5 μL;dNTP Mixture(各2.5 mM)4 μL;Mhp基因组溶液5 μL;DDW加至50 μL。混匀后放入PCR自动扩增仪中进行扩增,扩增程序为:95℃预变性3 min;95℃变性1 min,60℃退火1 min,72℃延伸1 min,共30个循环:72℃延伸7 min[4]。
2 结果与分析
PCR产物琼脂糖凝胶电泳图见图1。
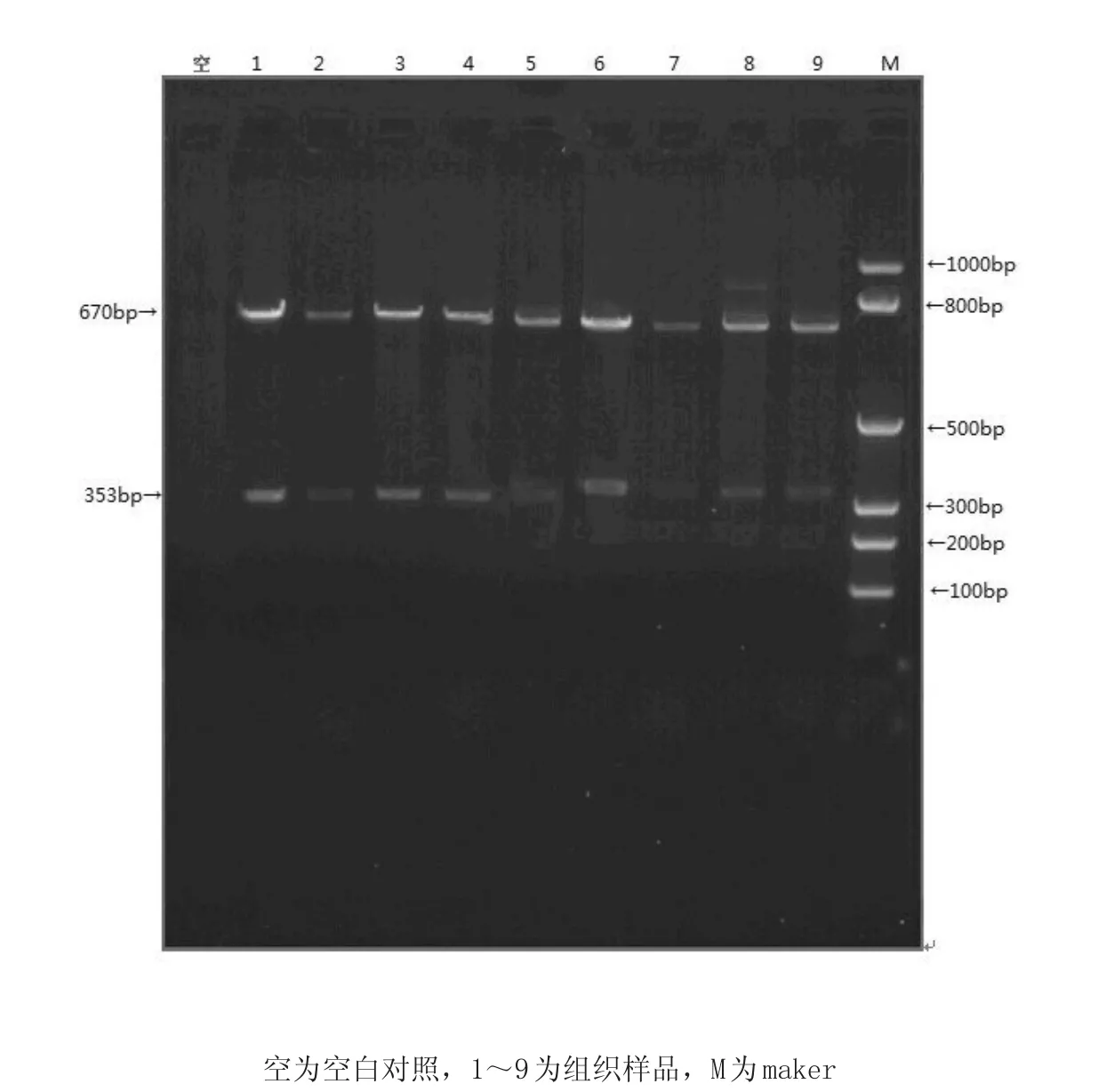
图1 PCR产物琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of.PCR products
PCR或RT-PCR检测结果表明,PCV2扩增为阳性,片段大小约353 bp;Mhp扩增为阳性,片段大小为670 bp;均与预期相符,其他病毒检测结果均为阴性。
3 讨论
通过对猪场进行流行病学调查,并且结合对病死猪的临床症状及剖检变化进行观察和实验室诊断,最终确诊此次猪场发生的疾病为猪圆环病毒2型和猪支原体肺炎的混合感染。猪圆环病毒2型是断奶仔猪多系统衰竭综合征的主要病原[5]。各种年龄、不同性别的猪都可以感染,但以哺乳期和育成期的猪最易感,病死率可达10%[6]。猪圆环病毒2型及其相关疾病已在全世界范围内发生与流行,它属于一种免疫抑制性疾病[7],PCV-2主要侵害机体的免疫系统,单核细胞和巨噬细胞是PCV-2的靶细胞,可以造成机体的免疫抑制[8-9]。
猪支原体肺炎属于猪的一种高发慢性呼吸道传染病,主要症状为气喘,主要病理变化为肺脏的肉变、胰变,病变呈对称性分布。此病在畜牧业发达的国家普遍流行,同时也广泛存在于世界各国,在我国也属养猪业的主要接触性传染病之一。如若诊治不及时甚至可能造成死亡,也可继发其他病原体感染,包括猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、伪狂犬病毒(ADV)以及猪流感病毒(SIV)。多病原混合感染导致产生所谓的猪呼吸系统疾病综合征(porcine respiratorydisease complex,PRDC)[10]。本病例可能为圆环病毒2型引发猪免疫能力下降,导致继发猪支原体肺炎。
PCR扩增是一种快速、特异、易于操作、广泛应用于实验室的检测方法。本次发病在临床初步诊断的基础上,采用PCR方法进行了实验室诊断,从而确定有猪圆环病毒2型和猪肺炎支原体感染,确诊为猪圆环病毒2型、猪肺炎支原体混合感染。
针对该病例的诊断,猪场应该加强管理,及时隔离病患猪只,阻断疾病蔓延,改善饲养条件,提高猪只的免疫力,饲养技术专业化,尽量做到自繁自养,合理用药,不滥用抗生素,建立准入和淘汰制度,维护健康猪群[11]。
[1]岳丰雄.鉴别PCV2、PPV、PRV、PRRSV、CSFV多重PCR诊断方法的建立及初步应用[D].乌鲁木齐:新疆农业大学,2008.
[2]SEGALES J,ROSELL C,D0MING0 M.Pathological findingsassociatedwithnaturallyacquired porcine circovirus type 2 associated disease [J].V Microbial,2004,98(2):137-149.
[3]RoSELL C,SEGALED J,RAMOs_VARA j A,et a1. Identification of porcine circovirus in tissue of pigs with porcine dermatitis and nephropathy syndrome[J].V Rec,2000,146(2): 40-43.
[4]丁敏.实时荧光PCR技术检测猪肺炎支原体研究[D].北京:中国农业科学院,2008.
[5]Allan G M,M eehan B M,Todd D,et a1.Novel porcinecircovirusfrompigswithwasting disease syndrome[J].Vet Rec,1998,l42:467-468.
[6]Pallares C,Neumann G,Grutze I,et a1.Case report:Porcine circovirus type 2 infection in an European wild boar[J].Vet Res,2004, 35(2):243 253.
[7]高生智.非典型猪瘟、猪圆环病毒Ⅱ型与猪传染性胸膜肺炎混合感染的诊断[J].甘肃畜牧兽医,2009,209(6):26-27.
[8]Royer R L.Susceptibility of porcine circovirus type 2 to commercial and laboratory disinfection[J].J Swine Health Prod,2007,96 (6):281-284.
[9]陈溥言.兽医传染病学[M].5版.北京:中国农业出版社,2007:231-234.
[10]Thacker E L.Immunology of the porcine respiratory disease complex[J].Vet Clin North Am Food Anim Prac,2001,17(3):551-565.
[11]赵东升,刘有昌,李祥健,等.猪肺炎支原体与其他病原的相互作用[J].养猪,2008,(5):66-68.
(编辑:张婷婷)
一例猪圆环病毒2型与猪肺炎支原体混合感染的诊断
谷建
Diagnosis of mixed infection of porcine circovirus 2 and mycoplasma hyopneumoniae
Gu Jian
(Yingkou city animal disease prevention and control center,LiaoningYingkou115000)
A pig farm in Yingkou broke out disease which caused swine weight loss,disease of respiratory system,even death.Samples of diseased pigs were collected.Total DNA and RNA of the sampleswereextracted.Porcinereproductiveandrespiratorysyndromevirus(PRRSV),porcine circovirus type 2(PCV2),classic swine fever virus(CSFV),pseudorabies virus(PRV),porcine parvovirus(PPV)and mycoplasma hyopneumoniae(Mhp),were detected by PCR or RT-PCR.A 353 bp production which correspond to porcine circovirus type 2 was amplified and a 670 bp production which correspond to mycoplasma hyopneumoniae was amplified.Finally,the diagnosis was a mixed infection of PCV2 with MHP.
Porcine circovirus type 2;Mycoplasma hyopneumoniae;Mixed infection;PCR;Diagnosis
S858.28文献标识码:A文章编号:1672-9692(2015)01-0040-04
2014-11-24
谷建(1983-),男,兽医师,硕士,主要从事动物疫病防控与检测工作。
book=4433,ebook=47

