猪传染性胸膜肺炎放线杆菌血清2型PCR程序优化及分子鉴定
(1.河南省农业科学院畜牧兽医研究所,河南郑州450002;2.河南省滑县动物卫生监督所,河南滑县456400)
(1.河南省农业科学院畜牧兽医研究所,河南郑州450002;2.河南省滑县动物卫生监督所,河南滑县456400)
猪接触性传染性胸膜肺炎(porcine contagious pleuropneumonia,PCP)又称坏死性胸膜肺炎,是由胸膜肺炎放线杆菌引起的一种高度接触传染性、致死性呼吸道传染病。以急性出血性纤维素性肺炎和慢性纤维素性坏死性胸膜炎为主要特征。各种年龄、性别的猪对本病均易感,急性者死亡率高,慢性者常能耐过。猪传染性胸膜肺炎放线杆菌有15个血清型,不同血清型之间没有或仅有较弱的交叉保护作用,这给猪传染性胸膜肺炎放线杆菌的诊断防治和免疫预防带来了很大的困难。因此建立一种快速血清型分子鉴定方法尤为重要。为了快速、简便的建立猪传染性胸膜肺炎放线杆菌血清型分子鉴定的方法,本研究所从临床发病疑似病例猪肺脏和气管中分离到的放线杆菌,首先经过血清型鉴定,确定部分血清型为2型,为了确定血清型鉴定的准确性,在此基础上,采用分子鉴定的方法,对这些菌株进行鉴定,确定分离到的11株菌为猪胸膜肺炎放线杆菌血清2型。这为猪传染性胸膜肺炎放线杆菌血清型分子鉴定及防治提供了理论依据,为今后临床血清型定型提供了一种简便方法。
猪胸膜肺炎放线杆菌;分子鉴定;血清2型
PCP又称坏死性胸膜肺炎,是由胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)引起的一种急性呼吸道传染病,以急性出血性纤维素性肺炎和慢性纤维素性坏死性胸膜炎为特征的呼吸道疾病[1-3]。该病在世界范围内广泛分布,常呈地方性流行,造成严重的经济损失,严重阻碍了当地养猪业的健康发展。APP血清型较多,并且各个血清型之间没有或仅有较弱的交叉保护作用,这给APP的防治和免疫预防带来很大的困难。目前PCP已成为猪临床发病中最为严重的疾病之一,该病已成为猪传染病研究中的热点之一。
目前已报道的APP有15个血清型,15个血清型又分为生物Ⅰ型和生物Ⅱ型[4-6]。生物Ⅰ型包括血清型1~12型和15型,生物Ⅱ型的生长包括血清型13和14。其中血清型1和5型又可分为A和B两个亚型,即血清型1A、1B和5A、5B[7-9]。各种年龄的猪均可感染,病猪、耐过猪和带菌猪是本病暴发和流行的潜在传染源,无临诊症状有病理变化猪,或无临诊症状无病理变化阴性带菌猪较常见,给本病的控制和净化根除带来困难[10-12]。对现代养猪业的危害较大,给养猪业造成巨大的经济损失,成为影响现代化养猪业健康发展的主要呼吸系统疾病。
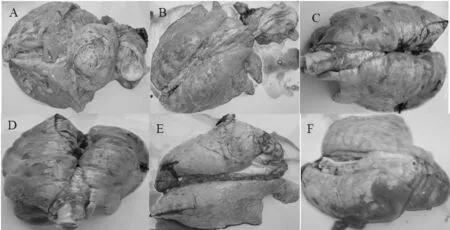
图1 临床胸膜肺炎放线杆菌肺脏和气管病例Fig.1 Clinical cases of Porcine contagious pleuropneumoniaActinobacillus pleuropneumoniaelung and tracheal
APP血清型较为复杂,并且各个血清型之间没有或有较弱的交叉反应,市场没有一种疫苗可以预防所有APP的发生,所以摸清各个地方和地区的流行血清型,采用含有本血清型的疫苗才能取得较好的效果。本研究为了建立一种简便快速的血清定型方法,从临床疑似病例猪肺脏和气管(见图1)中分离到的APP进行血清型分子鉴定,确定分离到得11株菌为APP血清2型。该研究为猪传染性胸膜肺炎放线杆菌的临床诊断和治疗及疫苗预防和血清型分子鉴定提供了理论依据和指导。
1 材料与方法
1.1 材料NAD(烟酰胺嘌呤二核苷酸)购于大连宝生物工程有限公司,APP 1型至12型阳性血清购自中国兽药监察所。95%乙醇、无水乙醇等试剂均为国产分析纯。普通营养琼脂、普通血清肉汤培养基、麦康凯培养基、LB琼脂培养基、胰蛋白胨大豆琼脂(TSA)、巧克力培养基、脑心浸液琼脂(含10%犊牛血清和100 μg/mL NAD)。
1.2 方法
1.2.1 APP真空冷冻干燥菌株的恢复培养把菌株从-80℃的冰箱中取出,用75%的酒精脱脂棉球擦净安培瓶,用火焰加热器顶端,滴少量无菌水使之破裂,用无菌镊子敲下已破裂的顶端。接种于脑心浸液琼脂(含10%犊牛血清和100 μg/mL NAD)平板上,置于体积分数为5%的CO2培养箱中培养24 h,提取单菌落进行纯化培养。
1.2.2 细菌血清型鉴定取纯培养的细菌,制备适宜浓度的细菌液,与不同血清型APP标准阳性血清进行平板凝集试验,观察凝集现象,确定分离菌的血清型。
1.2.3 PCR分子鉴定
1.2.3.1 APP基因组提取及模板制备将胸膜肺炎放线杆菌接种于脑心浸液琼脂(含10%犊牛血清和100 μg/mL NAD)平板上,置于体积分数为10%的CO2培养箱中培养24 h,按细菌基因组提取试剂盒(LifeFeng Cat#DK622-01)进行DNA的提取。
1.2.3.2 PCR引物设计根据Genbank已发表的猪传染性胸膜肺炎放线杆菌基因序列,从编码荚膜多糖的碱基序列设计一对引物。
上游引物5′-ACTATGGCAATCAGTCGATTCAT-3′
下游引物3′-CCTAATCGGAAACGCCATTCTG-5′
预期扩增片段为500 bp,引物由上海生工生物工程有限公司,用超纯净水稀释为25 pmol/ μL,备用。
1.2.3.3 PCR反应条件及扩增程序以上述DNA为模板,按以下体系进行PCR扩增:总体积为50.0 μL,超纯水37.0 μL,10×Buffer(Mg2+)5.0 μL,dNTPs,4.0 μL(2.5 mmol/μL),正向引物2 μL(25 pmol/μL),反向引物2 μL(25 pmol/ μL),Taq enzyme,0.5 μL(5 U/μL),模板DNA,0.5 μL。
PCR扩增程序为:95℃预变性3 min,94℃变性1 min,56℃退火1 min,72℃延伸1 min,72℃最后扩展10 min。
1.2.3.4 PCR扩增产物的检测取5 μL扩增产物和2 μL Loading Buffer混匀,加到含EB的1.5%的琼脂糖凝胶中,同时加入对照和DNA Marker(DL 2 000),电压为120 V,电泳1 h左右。
1.2.3.5 PCR产物的回收PCR扩增得到的片段经琼脂糖凝胶电泳鉴定,在紫外灯照射下,按DNA回收试剂盒的方法,在紫外灯照射下从琼脂糖凝胶中切取特异性条带,切取条带时,尽量去掉多余的琼脂糖凝胶,用(UNIQ-10)柱式DNA胶回收试剂盒回收胸膜肺炎放线杆菌PCR扩增产物,回收方法参照产品说明书(Cat#SK1131)。
1.2.3.6 PCR产物的连接将回收的PCR产物分别与pUCm-T载体按T-载体PCR产物克隆试剂盒方法连接。
①在一个标准的10 μL连接反应体系中,加入50 ng pUCm-T载体、0.2 pmol的回收PCR片段、1 μL 10×ligation Buffer和1 μL的T4 DNAligase,其余用水补足。
②反应体系:10×ligation Buffer 1 μL,50%PEG 1 μL,pUCm-T载体1 μL,回收PCR片段3 μL,无菌水3 μL,T4 DNA Ligase 1 μL,总体积10 μL。
③16~23℃连接1 h,4℃保存备用。
1.2.3.7 大肠杆菌感受态细胞的制备应用一步法制备高效感受态细胞试剂盒方法操作,详细步骤如下。
①取1 mL A600nm约0.5~0.6的菌到1.5 mL的微量离心管中。
②4000 r/min离心4~5 min,彻底去除上清,再加0.1 mL的预冷的SSCS溶液轻轻悬浮菌体。
③加入100 pg~10 ng用于转化DNA。
④混匀DNA和细胞且在冰上放置30 min,然后在42℃放置90 s,再在冰上放置15~20 min。
⑤加0.8 mL的LB培养基到离心管中,而后在37℃、200 r/min下培养1 h。
⑥将细胞涂布于相应抗性的平板上。
1.2.3.8 连接产物的转化将上一步连接后的DNA产物进行转化。转化步骤如下。
①取100 μL感受态细胞,置于冰上,完全解冻后轻轻将细胞均匀悬浮。
②加入10 μL连接产物,轻轻混匀。冰上放置30 min。
③42℃水浴热激90 s。冰上放置15~20 min。
④加400 μL LB培养基,37℃200~250 r/ min震荡培养1 h。
⑤用枪头吸取200 μL培养菌液,涂布在预先用20 μL 100 mmol IPTG和100 μL 20 mg/mL X-gal涂布的氨苄青霉素平板上。
⑥平板在37℃下正向放置1 h以吸收过多的液体,然后倒置培养过夜。
1.2.3.9 蓝白斑筛选当外源DNA片段插入到pUC57中后,由于外源DNA的核酸序列存在改变了LacZ基因的编码,从而影响了其产物β-半乳糖苷酶α-片段的活性,因此重组克隆在X-gal/ IPTG平板上呈现为白色,而非重组克隆呈蓝色,选择在IPTG/X-gal平板上生长的白色菌落,用枪头挑至含氨苄青霉素的液体培养基,37℃培养过夜。
1.2.3.10 质粒DNA的提取按照质粒DNA提取试剂盒进行操作,其具体步骤如下。
①将过夜培养的1~2 mL细菌12 000 r/min离心15 s,彻底去除上清。
②加入250 μL SolutionⅠ,用枪头活振荡器充分悬浮细菌。
③加入250 μL SolutionⅡ,立即温和混匀(倾斜45度角,顺一个方向,慢慢旋转离心管),使细菌裂解,室温放置2 min。
④加入350 μL SolutionⅢ,立即上下颠倒5~10次,使之充分中和,室温放置5 min。
⑤12 000 r/min,离心10 min。
⑥将步骤5中上清液转移到套放于2.0 mL收集管内的UNIQ-10柱中,室温放置2 min,8 000 r/ min室温离心30 s。
⑦弃收集管中的废液,将UNIQ-10柱放入同一支收集管中,吸取500 μL Wash Solution到UNIQ-10柱,10 000 r/min室温离心1 min。
⑧重复步骤7。
⑨弃收集管中的废液,将UNIQ-10柱放入同一支收集管中,12 000 r/min室温离心2 min,以彻底去除Wash Solution。
⑩将UNIQ-10柱放入新的洁净1.5 mL离心管中,加50 μL l Elution Buffer,室温放置2 min后,10 000 r/min室温离心1 min。离心管中的溶液即为所抽提的质粒DNA。
1.2.3.11 质粒DNA的酶切鉴定将上一步所提质粒各取5 μL于0.75%的琼脂糖凝胶中120 V电泳1 h,在凝胶成像系统下观察并记录结果,挑取DNA条带相对滞后的质粒DNA进行ECORⅠ和PSTⅠ双酶切。
酶切体系如下:总体积20.0 μL,质粒DNA 5.0 μL,ddH2O 11.0 μL,10×H Buffer 2.0 μL,PSTⅠ1.0 μL,ECORⅠ1.0 μL。混匀后,稍微离心,37℃酶切2 h。然后于0.75%的琼脂糖凝胶中120 V电泳45 min,在凝胶成像系统下观察并记录结果。
1.2.3.12 阳性克隆序列测定将上一步酶切鉴定的阳性克隆重组质粒,送上海生工生物工程有限公司测序。用Applied Biosystems(3730XL)测序仪测序仪。所得序列于NCBI数据库中数据比对与传染性胸膜肺炎放线杆菌2型的同源性达99%以上。
2 结果与分析
2.1 细菌血清型菌株的纯培养物分别与1型~12型APP标准阳性血清进行平板凝集试验,结果发现,分离到的11株菌均与标准Ⅲ型阳性血清呈现明显的凝集现象,与其他标准阳性血清和生理盐水对照均不发生凝集反应。凝集试验结果表明分离到的11株菌均为胸膜肺炎放线杆菌血清2型。
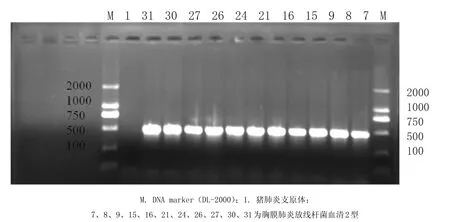
图2 猪胸膜肺炎放线杆菌PCR产物电泳结果Fig.2 The PCR results of Actinobacillus pleuropneumoniae
2.2 PCR产物的检测、克隆及测序PCR产物经凝胶电泳,然后在凝胶成像仪中观察,见图2。
从图2可以看出,以APP为模板,均能扩增出与预期一致的一条500 bp核酸片段,而猪肺炎支原体没有扩增出该片段。
所得PCR产物经测序,与GenBank已发表的胸膜肺炎放线杆菌血清型2型的同源性达99%以上。
3 讨论
猪传染性胸膜肺炎在世界各国流行,给养猪业造成严重的经济损失[13]。胸膜肺炎放线杆菌血清型较多,不同国家和地区流行的血清型不同。在墨西哥,1a,3,5a,5b和7血清型[14],许多欧洲国家主要是2、9血清型,北美主要是1、5血清型[15,16],加拿大和美国主要是1、5、7血清型,德国主要是2、7、9血清型[17],英国主要是3和8血清型[18],澳洲主要为1、7、12血清型,日本主要为2、5血清型,韩国主要为2、4、5、7血清型,我国主要是1、2、3、4、5、7、8、9、10血清型[19-20]。本试验临床病例中分离胸膜肺炎放线杆菌,并以标准阳性血清,采用平板凝集试验对11株APP分离菌进行了血清型鉴定,并采用PCR方法对血清型2型的分子鉴定进行了优化,结果这11株菌均为血清2型,这为该猪场猪传染性胸膜肺炎放线杆菌的预防控制和免疫防控提供了重要的依据。
猪传染性胸膜肺炎是规模化猪场中主要的呼吸系统疾病之一。同时,引起猪群发生呼吸道症状的疫病还有猪支原体肺炎、猪传染性萎缩性鼻炎、副猪嗜血杆菌病等。目前,抗生素是治疗细菌性疾病的关键,由于临床用药的不规范及滥用药物导致细菌耐药性增加,以及导致疾病对动物机体的损伤无法用药物来恢复等,导致抗生素在治疗细菌性疾病上没有明显效果。临床分离出大量多重耐药菌株,抗生素的应用已经很难达到控制本病的发生。因此开展血清型鉴定、细菌耐药性、流行病学和疫苗的研究具有重大意义。
胸膜肺炎放线杆菌血清型比较复杂,具有地方特异性,同时各血清型之间也很难产生较强的交叉保护作用。感染本病后往往容易出现继发感染,增加了防控的难度。另外,感染过本病且耐过的猪成为潜在的传染源。因此,及时、准确地分离鉴定APP,研制新型兽药制剂及新型疫苗,对防控本病具有重要的指导意义。
[1]Yuan F,Liao Y,You W,et al.Deletion of the znuA virulence factor attenuatesActinobacillus pleuropneumoniaeand confers protectionagainsthomologousorheterologous strain challenge[J].Vet Microbiol,2014,174 (3-4):531-539.
[2]Tobias TJ,Bouma A,van den Broek J,et al. TransmissionofActinobacilluspleuropneumoniaeamongweanedpigletsonendemically infectedfarms[J].PrevVetMed,2014,117 (1):207-214.
[3]KlinkenbergD,TobiasTJ,BoumaA,etal. Simulation study of the mechanisms underlying outbreaks of clinical disease caused by Actinobacilluspleuropneumoniaeinfinishing pigs[J].Vet J,2014,202(1):99-105.
[4]Tobias TJ,Klinkenberg D,Bouma A,et al.A cohortstudyonActinobacilluspleuropneumoniaecolonisationinsucklingpiglets[J]. Prev Vet Med,2014,114(3-4):223-230.
[5]Li L,Sun C,Yang F,et al.Identification ofproteinsofPropionibacteriumacnesfor use as vaccine candidates to prevent infection by the pig pathogen Actinobacillus pleuropneumoniae[J].Vaccine,2013,31(45): 5269-5275.
[6]Damte D,Lee SJ,Yohannes SB,et al.Comparative activities of selected fluoroquinolones againstdynamicpopulationsofActinobacillus pleuropneumoniae in an in vitro model of time-killcontinuouscultureexperiment[J]. IntJAntimicrobAgents,2013,42(6):544-552.
[7]Shin MK,Kang ML,Jung MH,et al.Induction of protective immune responses against challengeofActinobacilluspleuropneumoniaeby oral administration with Saccharomyces cerevisiae expressing Apx toxins in pigs[J].Vet ImmunolImmunopathol,2013,151(1-2):132-139.
[8]Seo KW,Kim SH,Park J,et al.Nasal immunizationwithmajorepitope-containingApxIIA toxinfragmentinducesprotectiveimmunity against challenge infection with Actinobacilluspleuropneumoniaeinamurinemodel[J]. VetImmunolImmunopathol,2013,151(1-2): 102-112.
[9]Oh Y,Ha Y,Han K,et al.Expression of leucocyte function-associated antigen-1 and intercellular adhesion molecule-1 in the lungs of pigs infected with Actinobacillus pleuropneumoniae[J].JCompPathol,2013,148(2-3):259-265.
[10]Assavacheep P,Rycroft AN.Survival of Actinobacillus pleuropneumoniae outside the pig [J].Res Vet Sci,2013,94(1):22-26.
[11]Tobias TJ,Bouma A,Klinkenberg D,et al. Detection of Actinobacillus pleuropneumoniae inpigsbyreal-timequantitativePCRfor theapxIVAgene[J].VetJ,2012,193(2): 557-560.
[12]Perry MB,Angen O,MacLean LL,et al.An atypical biotype I Actinobacillus pleuropneumoniae serotype 13 is present in North America[J].Vet Microbiol,2012,156(3-4):403-410.
[13]Damte D,Suh JW,Lee SJ,et al.Putative drug and vaccine target protein identificationusingcomparativegenomicanalysisof KEGGannotatedmetabolicpathwaysofMycoplasma hyopneumoniae[J].Genomics,2013,102 (1):47-56.
[14]Serrano-Rubio LE,Tenorio-Gutierrez V,Suarez-Guemes F,et al.Identification of Actinobacillus pleuropneumoniae biovars 1 and 2inpigsusingaPCRassay[J].MolCell Probes,2008,22(5-6):305-312.
[15]Jolie RA,Mulks MH,Thacker BJ.Cross-protection experiments in pigs vaccinated with Actinobacilluspleuropneumoniaesubtypes1A and 1B[J].Vet Microbiol,1995,45(4):383-391.
[16]Jessing SG,Angen O,Inzana TJ.Evaluation ofamultiplexPCRtestforsimultaneous identificationandserotypingofActinobacillus pleuropneumoniae serotypes 2,5,and 6[J].J Clin Microbiol,2003,41(9):4095-4100.
[17]Sebunya TN,Saunders JR.Haemophilus pleuropneumoniae infection in swine:a review[J]. JAmVetMedAssoc,1983,182(12):1331-1337.
[18]Dubreuil JD,Jacques M,Mittal KR,et al. Actinobacilluspleuropneumoniaesurface polysaccharides:theirroleindiagnosis and immunogenicity[J].Anim Health Res Rev, 2000,1(2):73-93.
[19]Zhou L,Jones SC,Angen O,et al.PCR specificforActinobacilluspleuropneumoniae serotype 3[J].Vet Rec,2008,162(20):648-652.
[20]McDowell SW,Ball HJ.Serotypes of Actinobacilluspleuropneumoniaeisolatedinthe BritishIsles[J].VetRec,1994,134(20): 522-523.
(编辑:郭雪峰)
猪传染性胸膜肺炎放线杆菌血清2型PCR程序优化及分子鉴定
李海利1,朗利敏1,徐引弟1,焦文强1,朱文豪1,张立宪1,张青娴1,游一1,候自花1,杨素新2,许峰1,郑万录1,王克领1⋆
PCR program optimization and molecular identification of Actinobacillus pleuropneumoniae serotype 2
Li Haili1,Lang Limin1,Xu Yindi1,Jiao Wenqiang1,Zhu Wenhao1, Zhang Lixian1,Zhang Qingxian1,You Yi1,Hou Zihua1,Yang Suxin2, Xu Feng1,Zheng Wanlu1,Wang Keling1*
(1.Animal Husbandry and Veterinary Research Institute,Henan Academy of Agricultural Sciences,Henan Zhengzhou450002; 2.Animal Health Supervision Institute of Huaxian,HenanHuaxian456400)
Porcine contagious pleuropneumonia also known as necrotic pleuropneumonia,is a highly contagious and lethal respiratory infectious disease caused by Actinobacillus pleuropneumoniae. The main characteristic of this disease are acute hemorrhagic fibrinous pneumonia and chronic fibrinous necrosis.Pigs at all ages and gender were susceptible to this disease and caused acute mortality.Actinobacillus pleuropneumoniae has 15 serotypes,there are no or weakly cross protection between different serotypes,which brought great difficulties to control,diagnosis and im-mune prevention this disease.So it is particularly important to establish a rapid molecular identification method for serotype.In order to establish a rapid,simple method to identify Porcine Contagious pleuropneumoniae serotype,this research identified Actinobacillus pleuropneumoniae from swine lung and trachea with clinical of suspection,through serotype identification,determined type 2 serotype.In order to determine the accuraate serotype,the method of molecular identification was studied.11 isolated strains were identified as serotype 2 Actinobacillus pleuropneumoniae.This provides a theoretical basis for molecular identification the infectious porcine Actinobacillus pleuropneumoniae serotype,and provides a simple method for the future clinical serum identification.
Porcine contagious pleuropneumoniaActinobacillus pleuropneumoniae;Molecular identification;Serotype 2
S852.619文献标识码:B文章编号:1672-9692(2015)01-0033-07
2014-12-25
李海利(1982-),男,博士,助理研究员,主要从事动物传染病临床诊断及防控研究工作。
王克领(1964-),男,本科,副研究员,主要从事兽医传染病防控研究工作。
河南省农业科学院博士科研启动基金;河南省农业科学院优秀青年科技基金(2013YQ22)
book=3388,ebook=42

