基于定点突变改善中性植酸酶催化特性及结构-效应分析
王祖鹏,许 伟,邵 荣,韦 萍
(1.南京工业大学生物与制药工程学院,江苏 南京 211816;2.盐城工学院海洋与生物工程学院,江苏 盐城 224051)
基于定点突变改善中性植酸酶催化特性及结构-效应分析
王祖鹏1,2,许 伟2,邵 荣2,韦 萍1,*
(1.南京工业大学生物与制药工程学院,江苏 南京 211816;2.盐城工学院海洋与生物工程学院,江苏 盐城 224051)
对前期设计的来源于淀粉液化芽孢杆菌DSM 1061的3 种中性植酸酶突变体(D148E/H149R、Q67E/N68R、D191E)的稳定性及催化效率等进行研究,并对影响其性质的结构因素进行分析。结果表明:与野生酶相比,在85 ℃条件下,突变体D191E半衰期延长了4.3 min,但催化效率下降为野生酶的48.9%;突变体D1 48E/H149R催化效率为野生酶的229%,半衰期与野生酶基本一致;突变体Q67E/N68R催化效率为野生酶的93%,半衰期延长了0.7 min。圆二色光谱分析结果显示,D148E/H149R催化效率提高最为显著,α-螺旋含量由野生酶中11.79%降至2.90%,无规卷曲含量增加;Q67E/N68R性质与野生酶接近,其二级结构变化最小;D191E催化效率降低,α-螺旋含量增加至24.59%。对野生酶和突变酶的同源模型分析发现,残基D191具有较大的B因子值,不利于酶的热稳定性,各突变残基周围的氢键有所变化。同源模型的分析也将为植酸酶的进一步改良提供理论依据。
中性植酸酶;定点突变;催化效率;圆二色光谱
植酸酶是一类能催化植酸盐降解成肌醇和无机磷的酶的总称[1]。植酸酶作为饲料添加剂,能够提高植物性饲料中磷的利用率和单胃动物对矿质元素的吸收率,并能减少磷对环境的污染[2]。植酸酶来源广泛,普遍存在于细菌[3-4]、真菌[5]以及动植物组织[6]中。目前商品化的植酸酶几乎都是酸性植酸酶,然而酸性植酸酶仅适合胃中pH值呈酸性的单胃动物以及少数鱼类如虹鳟等,不适用于我国水产养殖量最大的消化道为中性的鲤科鱼类[7]。来源于芽孢杆菌的中性植酸酶属于3-植酸酶(EC 3.1.3.8)和β-螺旋桨植酸酶[8- 9],其具有最适pH值接近中性、酶活性高、热稳定性好[10]等特性,可广泛应用于鱼类饲料。
近年来,中性植酸酶基因工程菌的构建及其活性的提高成为广大科研人员关注的热点。有学者成功将芽孢杆菌植酸酶基因在大肠杆菌中表达,但存在重组酶活性偏低等问题[11-12]。利用生物信息学对现有的大量酶进行统计分析,结合定点突变等分子生物学技术,对现有的酶进行设计改造,可以使其具有预期的优良性质[13-14]。不少学者利用这些手段对植酸酶的构象和催化机理进行研究,Osman等[15]利用同源建模结合定点突变的方法证实了Y78位于芽孢杆菌(Bacillus sp.)植酸酶的催化活性中心。Zeng Yifang等[16]利用晶体模型阐述了Bacillus植酸酶与二价金属离子复合并与底物结合催化的机理。酶的热稳定性是酶的重要性质之一,热稳定性的增加能拓宽酶的应用范围[17],将这些手段相结合能较快获得兼具高活力和热稳定性的中性植酸酶。在中性植酸酶的分子改造方面,Oh等[18]对淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)DS11植酸酶进行了一系列的单点突变研究。结果发现突变酶D314A、E211A、E260A和Y159F丧失活性,其余几种突变酶催化效率kcat/Km显著下降,最高仅为野生酶的48.81%。Shim等[19]对来源于B. amyloliquefaciens DS11的植酸酶进行突变,但得到D56A、D56E、D308A、D308E等突变体的催化效率kcat/Km与野生酶相比均有所降低。
本实验室前期已获得来源于B. amyloliquefaciens DSM 1061的新型中性植酸酶基因[8],并在大肠杆菌(Escherichia coli)BL21(DE3)中进行了高效表达[20]及定点突变研究,获得3 种中性植酸酶突变体(D148E/H149R、Q67E/N68R和D191E)[21]。本研究对中性植酸酶3 种突变体的催化效率和热稳定性进一步研究,通过圆二色光谱分析突变酶的结构变化,利用同源建模的方法探讨可能影响酶热稳定性的因素,对突变部位的氢键及突变残基的B因子进行分析,为后期酶学性质的进一步改良提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
重组E. coli BL21(DE3)/pET22b(+)-phyc菌株为盐城工学院生物实验室构建并保存。
LB培养基:酵母膏5 g、蛋白胨10 g、NaCl 10 g、121 ℃条件下高压蒸汽灭菌20 min。
1.1.2 试剂
植酸钠、蛋白Marker 生工生物工程(上海)股份有限公司;酵母膏、蛋白胨 英国Oxoid公司;考马斯亮蓝G250、考马斯亮蓝R250、咪唑、三羟甲基氨基甲烷(Tris) 国药集团药业股份有限公司;蛋白纯化试剂盒 北京康为世纪生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV752N紫外-可见分光光度计 上海佑科仪器仪表有限公司;CT15RT高速冷冻离心机 上海天美生化仪器设备工程有限公司;DYY-8C垂直电泳仪 北京六一仪器厂;J-810型圆二色光谱仪 日本Jasco公司。
1.3 方法
1.3.1 中性植酸酶的诱导表达
将保存于-80 ℃的3 种含中性植酸酶突变基因的菌株及原始菌株在含氨苄(终质量浓度100 μg/mL)的LB平板划线,置于37 ℃的培养箱中倒置培养。挑取原始菌株及突变菌分别转接到新鲜的LB液体培养基中,在37 ℃条件下,180 r/min振荡培养至对数生长期(OD600 nm≈0.6~0.8),分别加入诱导剂异丙基硫代半乳糖苷(终浓度1.0 mmol/L),置于20 ℃条件下,180 r/min诱导表达6 h。取适量诱导后的培养液,8 000 r/min离心15 min收集菌体,用无菌水洗涤2 次后,菌体重悬于0.5 mL(pH 7.0,50 mmol/L)Tris-HCl缓冲液中,超声波破碎菌体细胞。破胞条件为:超声功率400 W,工作时间3 s,间歇3 s,在冰浴环境中循环200 次。将超声破碎后的样品在12 000 r/min、4 ℃条件下离心10 min,取上清即为粗酶液。
1.3.2 突变酶的纯化
蛋白质纯化采用Ni-Agarose 6×His标签蛋白纯化试剂盒在4 ℃条件下进行纯化。纯化步骤如下:用10 倍体积平衡液(20 mmol/L咪唑、50 mmol/L Tris、500 mmol/L NaCl)平衡层析柱,平衡结束后将粗酶液上样,进样速率为0.25 mL/min。上样结束后,用平衡液洗去杂蛋白,再用洗脱液(500 mmol/L咪唑、50 mmol/L Tris、500 mmol/L NaCl)洗下目的蛋白,纯化效果利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)检测。将含目的蛋白的洗脱液置透析袋(截留分子质量8~14 kD)中透析除盐。
1.3.3 中性植酸酶酶学性质测定
中性植酸酶的酶活力测定方法参考GB/T 18634-2009《饲用植酸酶活性的测定 分光光度法》,并稍作修改。植酸钠终浓度为5.0 mmol/L,反应体系CaCl2的终浓度为2 mmol/L,缓冲体系为Tris-HCl缓冲液(0.25 mol/L,pH 7.0)。取0.2 mL酶液与上述底物混合,反应总体积6 mL。将上述混合物置于37 ℃条件下反应30 min,加入4 mL显色及终止液终止反应,于415 nm波长处测定无机磷的含量。
酶活力单位(U)定义:在一定条件下,每分钟释放出1 μmol无机磷所需的酶量为一个酶活力单位。
1.3.3.1 中性植酸酶动力学常数的测定
反应体系中采用不同的底物浓度,使其终浓度分别为0.125、0.25、0.5、1、2、4 mmol/L。置于酶的最适温度和pH值条件下水浴反应30 min,加入4 mL显色及终止液终止反应,测定酶活力,以双倒数作图法确定Km和vmax,并根据酶浓度计算催化常数kcat,进一步求得催化效率kcat/Km[21]。
1.3.3.2 中性植酸酶半衰期测定
半衰期是指特定温度下酶活力丧失一半的时间,是表征酶热稳定性的一个重要参数。将野生酶和突变酶在85 ℃条件下分别保温0、2、4、6、8、10 min后37 ℃条件下测定酶活力,得出酶活力下降至50%时所对应的保温时间。
1.3.4 中性植酸酶的圆二色光谱扫描
将野生酶与突变酶的浓度调成一致,酶溶液中含有终浓度为2 mmol/L的Ca2+。利用圆二色光谱仪在200~240 nm范围内扫描,测定几种中性植酸酶突变体的圆二色性。
2 结果与分析
2.1 中性植酸酶的SDS-PAGE分析

图1 植酸酶的SDS-PAGGEE图Fig.1 SDS-PAGE of mutant phytases
对大肠杆菌中表达的中性植酸酶突变酶蛋白纯化后进行SDS-PAGE检测,如图1所示,结果表明经过镍柱纯化后获得单一条带,即为均一的植酸酶蛋白,已达到电泳纯。突变酶分子质量与野生酶一致[20],约为42 kD。
2.2 中性植酸酶动力学参数
运用Lineweaver-Burk双倒数作图法,绘制野生酶及突变酶的动力学曲线,通过方程求得植酸酶的动力学常数。再根据vmax=kcat[E]计算催化常数kcat,进一步计算催化效率kcat/Km。表1列出了野生酶和突变酶的米氏常数、最大反应速率等动力学参数。与野生酶相比,D148E/H149R的最大反应速率vmax提高了62%,其催化效率提高最为显著,为野生酶的229%。D148E/H149R的米氏常数Km变化不明显,只降低了5%,但其催化效率有大幅提高,推测这与最大反应速率的提高有关。Q67E/N68R的最大反应速率比野生酶下降了11.8%,催化效率为野生酶的93.0%。D191E的最大反应速率下降为野生酶的51.3%,催化效率降低明显,仅为野生酶的48.9%。Oh等[18]对来源于B. amyloliquefaciens DS11的植酸酶进行研究,获得的突变体R122E催化效率仅为野生酶的48.81%。Shim等[19]得到的突变体催化效率也普遍降低,突变体D308E催化效率最高,也仅为野生酶的94.04%。与之相比,本课题组获得的突变体D148E/H149R催化效率提高幅度更为显著。Tran等[22]对来源于Bacillus sp. MD2的碱性植酸酶突变,获得的突变体E229V的最高活力达到37.8 U/mg,与本研究所得到的突变体D148E/H149最高反应速率32.19 U/mg接近。
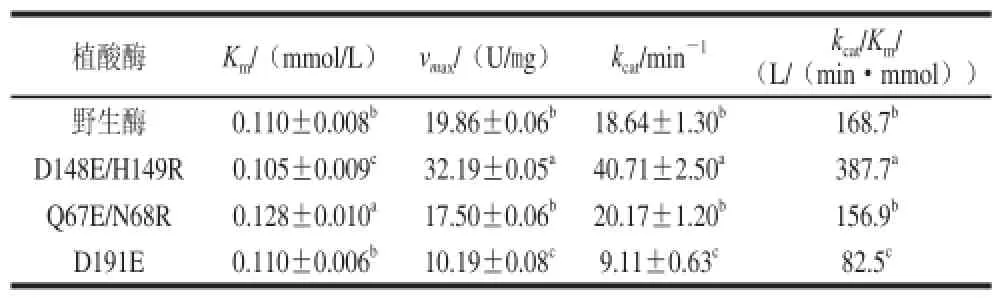
表1 植酸酶的动力学参数Table 1 Kinetic parameters of mutant phytases
2.3 中性植酸酶半衰期
在特定的条件下,酶的半衰期越长,说明酶的稳定性越好。在含有2 mmol/L Ca2+的环境中,85 ℃条件下保温不同时间,酶活力残留曲线如图2所示,突变体D148E/H149R、Q67E/N68R 与野生酶变化趋势接近,而D191E酶活力下降缓慢。野生酶的半衰期为3.5 min,D148E/H149R的半衰期与野生酶接近,为3.6 min,Q67E/N68R的半衰期为4.2 min;D191E的半衰期最长,为7.8 min。与野生酶相比,D191E的半衰期延长了4.3 min,热稳定性显著提高。Yao Mingze等[23]得到的来源于大肠杆菌的植酸酶,在85 ℃条件下处理,酶的剩余活力下降显著,最终稳定在20%左右,本课题组获得的突变体D148E/H149R、Q67E/N68R以及野生酶的变化与之相似,而D191E显示出较好的热稳定性。
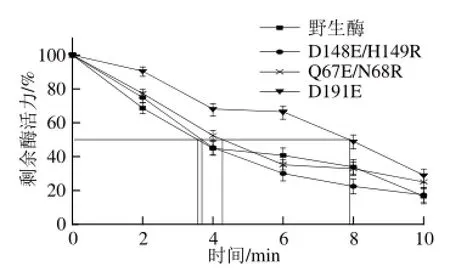
图2 植酸酶的热稳定曲线Fig.2 Thermal inactivation curves of mutant phytases
2.4 中性植酸酶的圆二色光谱
圆二色光谱是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法,已受到研究者的广泛关注[24]。如张耀华等[25]利用圆二色光谱研究了pH值对植酸酶稳定性的影响,发现当溶液pH值由5变为8时,植酸酶二级结构变化较大,α-螺旋含量由84.27%变为29%。利用圆二色光谱分析蛋白质的二级结构可以发现突变酶和野生酶蛋白结构间的差异。野生酶及突变酶的圆二色光谱如图3所示,D191E、D148E/H149R的圆二色光谱与野生酶相差较大,Q67E/N68R则与野生酶最为相近。利用CDPro软件对数据进行处理,计算出野生酶及突变酶的各个二级结构的含量,如表2所示。野生酶α-螺旋的含量为11.79%,β-折叠含量为41.26%。圆二色光谱显示酶的空间结构与酶的活力密切相关,D148E/H149R酶催化效率提高,α-螺旋含量降低至2.90%,无规卷曲含量增加;D191E催化效率降低,α-螺旋含量提高至24.59%;Q67E/N68R性质与野生酶接近,二级结构变化最小。Correia等[26]利用圆二色光谱分析温度和溶剂对植酸酶稳定性的影响,当热处理温度由25 ℃升高至60 ℃,3-植酸酶α-螺旋含量由61.3%降至23.9%,6-植酸酶的α-螺旋含量由49.0%下降到15.9%,无规卷曲含量均增加。本研究中,突变酶二级结构的改变可能是由于突变后的氨基酸改变影响了原有酶蛋白α-螺旋等结构的形成,其中D148E/H149R中α-螺旋的含量减少,无规卷曲的含量增加,使得酶分子柔性增加,利于酶与底物的结合,获得更高的催化效率;而D191E则相反,α-螺旋含量的增加可能提高了酶的刚性,使得酶热稳定性提高,与文献[26]报道相吻合。
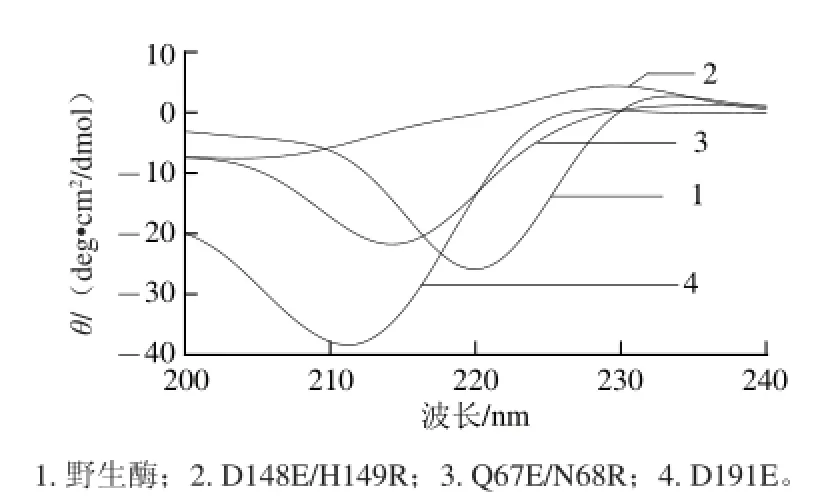
图3 植酸酶的圆二色光谱Fig.3 Circular dichroism of mutant phytases
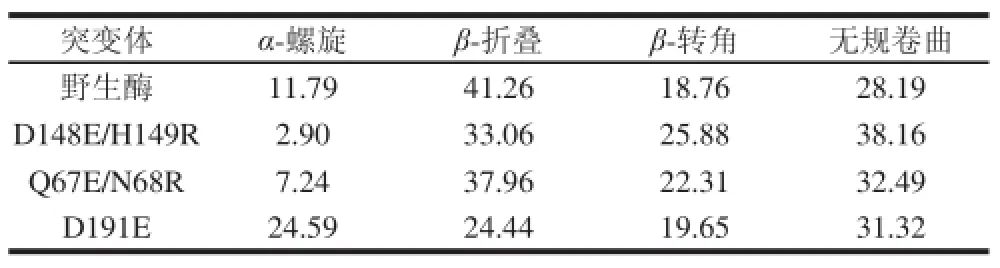
表2 植酸酶的二级结构含量Table 2 Secondary structure contents of phytases determined by CD spectroscopy%
2.5 突变残基部位氢键的变化
稳定蛋白质三维结构的作用力主要是一些非共价键或次级键包括氢键、范德华力、疏水作用、盐键等。其中氢键是使酶蛋白高级结构稳定的重要作用力[27]。利用SWISS-MODEL服务器,对删除信号肽的野生酶和突变酶进行同源建模,利用软件Swiss-PdbViewer 4.10对突变酶的同源模型进行分析,统计氨基酸残基5 Å半径内突变前后氢键的变化。如表3和图4所示,突变后氨基酸残基周围的氢键数目及位置有所变化。通过同源模型观察到突变后E191残基的OE2能与N193残基的ND2间形成氢键,研究也证实,将D191残基突变成谷氨酸之后,酶的热稳定性显著增加,推断这样形成的氢键能有效地增加酶分子表面的刚性,从而增加酶的稳定性[27]。与野生酶相比,突变体Q67E/N68R的氢键数目有所增加,发现将N68残基突变为精氨酸后,其能与D62形成2个氢键。结果表明,Q67E/N68R稳定性略有提高,推测这与氢键数目的增加有关。突变体D148E/H149R与野生酶相比,5Å的半径内氢键增加了2个,将H149残基突变成R149之后能够与D191残基间形成氢键,氢键数目也有所增加,但热稳定性的提高并不明显。

表3 突变残基的氢键变化统计Table 3 Hydrogen bond number around mutation residues of phytases
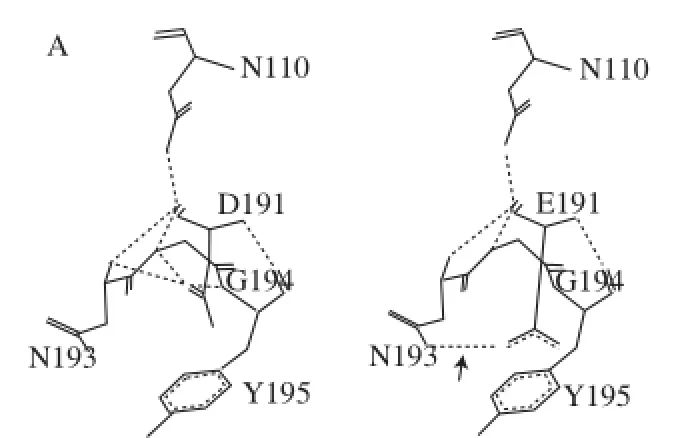
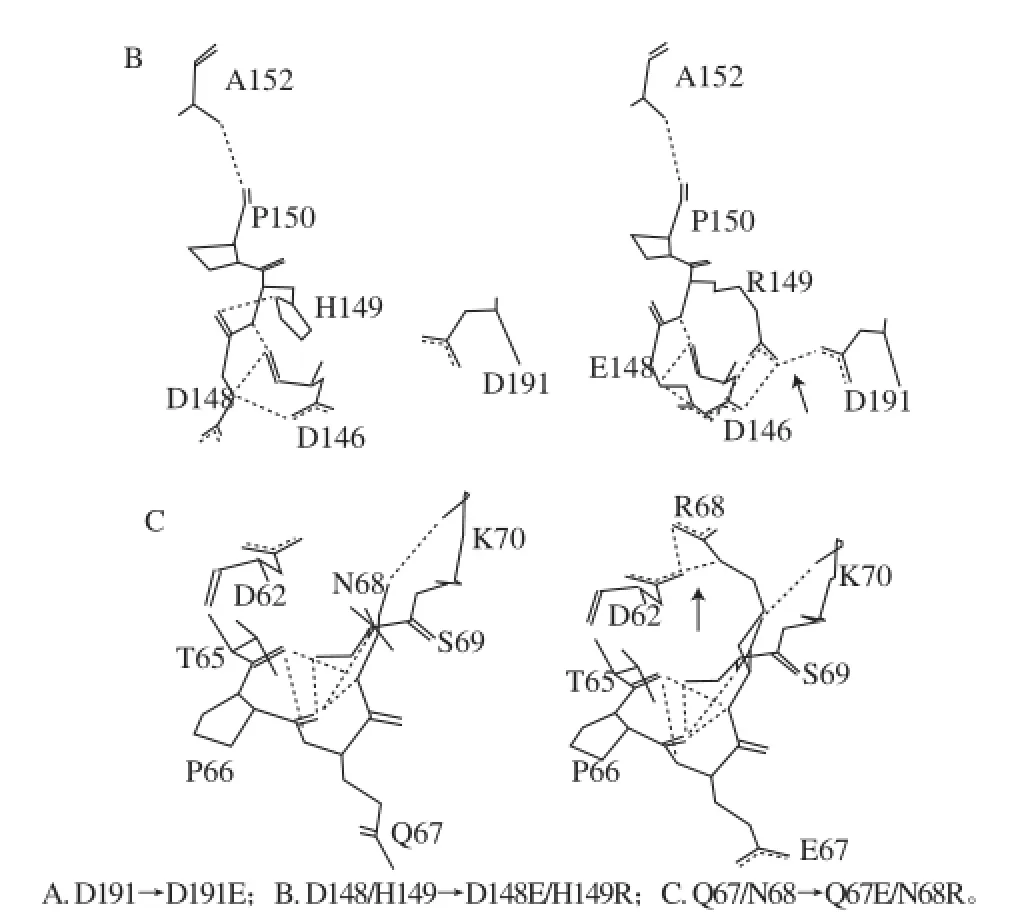
图4 突变前后残基氢键的变化Fig.4 Changes of hydrogen bonds before and after the mutation of phytases
2.6 突变残基的B因子值分析
B因子值体现了晶体中原子电子密度的“模糊度”,即蛋白质分子在晶体中的构象状态。B因子值越高,“模糊度”越大,相应部位的构象就越不稳定[28],对蛋白质的稳定性影响越大。可以根据B因子值来分析稳定性。Reetz等[29]根据测定各个氨基酸残基的B因子值选择不利于蛋白质稳定的氨基酸残基进行突变来提高酶的热稳定性。利用网站服务器(http://spinportal.magnet.fsu. edu/bfactors/)对中性植酸酶各个氨基酸的B因子值进行预测。所选突变氨基酸的B因子值如表4所示。D191残基的B因子值最高,说明D191残基所处部位最不稳定,理论上对植酸酶的热稳定性影响最大。结果也证实,在这些突变残基中,D191残基对植酸酶的热稳定性影响最大,将D191这一氨基酸残基突变后得到的D191E热稳定性大幅提高。而H149、N68等氨基酸残基的B因子值相对较小,说明其构象稳定,对酶的热稳定性影响不大,D148E/H149R、Q67E/N68R这两个突变体热稳定性改善不是很明显。

表4 植酸酶残基的B因子值Table 4 B-factor values of amino acid residues in phytases
2.7 突变体结构与功能关系分析
突变体D148E/H149R、Q67E/N68R、D191E位于酶分子的表面,未对植酸酶的保守序列进行改变,避免了对活性中心改变而造成的酶催化活力的丧失。酶活力和稳定性通常存在着一种平衡[30],突变后酶活力的提高往往造成稳定性的下降,与之类似,本研究中突变体D148E/H149R催化效率是野生酶的2.29 倍,但半衰期与野生酶相近;与野生酶相比,突变体D191E稳定性大幅度提高,但催化效率却显著下降。从其结构模型可以看出,D191残基位于蛋白质的Loop环上,谷氨酸代替天冬氨酸之后拥有更大的侧链,同时能和N193残基的ND2形成氢键,推测这增加了酶蛋白表面的刚性。研究显示β-螺旋植酸酶分子酶的活性中心比较狭窄[31],D191残基这一改变可能影响到了酶活力中心与底物的结合,从而使得其催化效率降低明显。通常情况下氢键的数目增加后,酶的稳定性会提高,但氢键只是影响酶结构稳定性的因素之一,如D191残基突变后,在氢键数目未增加的情况下,稳定性却大幅提高,说明还存在其他诸多因素影响着蛋白质的稳定性,在今后的研究中,将进一步探索使得突变体稳定性大幅提升的原因。另外D191残基的B因子值比较大,说明了D191构象的不稳定,突变后其热稳定性得到大幅度提高。圆二色光谱显示D191E的α-螺旋结构含量明显增加,这使得酶表面的刚性增加,也与热稳定性的提高有关。D148、H149是位于酶表面的非保守氨基酸,圆二色光谱显示D148E/H149R的α-螺旋含量降低最显著,无规卷曲含量明显增加,可能使得酶柔性增加,能更好地与底物结合,从而提高催化效率。Q67、N68同样是位于酶表面的非保守氨基酸,突变体Q67E/N68R的二级结构与野生酶相似,α-螺旋等结构含量未发生明显改变。
3 结 论
获得的突变体D148E/H149R的最大反应速率vmax提高了62%,催化效率为野生酶的229%,提高了植酸酶的利用率。Q67E/N68R催化效率是野生酶的93.0%,半衰期延长了0.7 min,性质改变不明显。85 ℃条件下D191E的半衰期比野生酶延长了4.3 min,能更好地避免因高温而造成的酶活力损失。圆二色光谱显示突变酶之间结构存在差异,与野生酶相比,D148E/H149R的α-螺旋含量降低,无规卷曲含量增加。同源模型结构显示,突变残基周围氢键数目和位置均有所改变,对突变残基的B因子值进行分析,发现D191的B因子值较高,D191E热稳定性的提高与不稳定残基D191的突变有关。研究中所获得的突变体多数是在单一方面性能的大幅改善,要获得高催化效率及热稳定性优良的植酸酶需要经过多次突变和反复地筛选,酶分子同源模型的构建也为后期对酶学性质的进一步改良提供依据。
[1] SINGH B, KUNZE G, SATYANARAYANA T. Developments in biochemical aspects and biotechnological applications of microbial phytases[J]. Biotechnology and Molecular Biology Review, 2011, 6(3): 69-87.
[2] 许伟, 邵荣, 余晓红, 等. 中性植酸酶结构与功能关系研究进展[J].盐城工学院学报: 自然科学版, 2010, 23(4): 9-12.
[3] BAWANE R, TANTWAI K, RAJPUT L P S, et al. Molecular analysis of phytase gene cloned from Bacillus subtilis[J]. Advanced Studies in Biology, 2011, 3(3): 103-110.
[4] PANDEE P, SUMMPUNN P, WIYAKRUTTA S, et al. A thermostable phytase from Neosartorya spinosa BCC 41923 and its expression in Pichia pastoris[J]. Journal of Microbiology, 2011, 49(2): 257-264.
[5] BHAVSAR K, BUDDHIWANT P, SONI S K, et al. Phytase isozymes from Aspergillus niger NCIM 563 under solid state fermentation: biochemical characterization and their correlation with submerged phytases[J]. Process Biochemistry, 2013, 48(11): 1618-1625.
[6] 马玺, 赵玉华, 单安山. 麦类籽实中植酸酶的活性及体外降解植酸盐效果的研究[J]. 中国饲料, 2007(16): 13-16.
[7] 许伟, 仇明, 余晓红, 等. 芽孢杆菌植酸酶基因的克隆及生物信息学分析[J]. 食品科学, 2011, 32(7): 202-206.
[8] 李晓龙, 杨合同, 扈进冬, 等. 植酸酶的多样性及其分类[J]. 微生物学通报, 2010, 37(5): 738-747.
[9] 吴琪,王红宁, 刘世贵.芽孢杆菌植酸酶分子生物学研究进展[J].中国生物工程杂志, 2005(B04): 180-185.
[10] IGBASAN F A, MÄNNER K, MIKSCH G, et al. Comparative studies on the in vitro properties of phytases from various microbial origins[J]. Archives of Animal Nutrition, 2000, 53(4): 353-373.
[11] 陈艳, 孙建义, 赵学新, 等. Bacillus amyloliquefaciens中性植酸酶基因的原核表达及蛋白纯化和性质[J]. 食品与生物技术学报, 2005, 24(2): 60-65.
[12] RAO D E, RAO K V, REDDY V D. Cloning and expression of Bacillus phytase gene (phy) in Escherichia coli and recovery of active enzyme from the inclusion bodies[J]. Journal of Applied Microbiology, 2008, 105(3): 1128-1137.
[13] 陈文聪, 胡朝晖, 朱庆义. 生物信息学的进展及其在分子微生物学研究中的应用[J]. 分子诊断与治疗杂志, 2011, 3(3): 207-211.
[14] 丁彦蕊,蔡宇杰, 须文波. 用同源建模法探索提高脂肪酶的耐热性[J].计算机与应用化学, 2007, 24(11): 1535-1538.
[15] OSMAN A A, BABU P R, VENU K. Prediction of substrate-binding site and elucidation of catalytic residue of a phytase from Bacillus sp.[J]. Enzyme and Microbial Technology, 2012, 51(1): 35-39.
[16] ZENG Yifang, KO T P, LAI Huilin, et al. Crystal structures of Bacillus alkaline phytase in complex with divalent metal ions and inositol hexasulfate[J]. Journal of Molecular Biology, 2011, 409(2): 214-224.
[17] RATHI P C, RADESTOCK S, GOHLKE H. Thermostabilizing mut ations preferentially occur at structural weak spots with a high mutation ratio[J]. Journal of Biotechnology, 2012, 159(3): 135-144.
[18] OH B C, CHANG B S, PARK K H, et al. Calcium-dependent catalytic activity of a novel phytase from Bacillus amyloliquefaciens DS11[J]. Biochemistry, 2001, 40(32): 9669-9676.
[19] SHIM J, OH B C. Characterization and application of calciumdependent β-propeller phytase from Bacillus amyloliquefaciens DS11[J]. Journal of Agricultural and Food Chemistry, 2012, 60(30): 7532-7537.
[20] 路国伟, 许伟, 邵荣, 等. 新型中性植酸酶在大肠杆菌中的高效表达、纯化及酶学性质[J]. 食品科学, 2012, 33(21): 153-156.
[21] XU Wei, WANG Zupeng, SHAO Rong. Site-directed mutagenesis of a neutral phytase from Bacillus amyloliquefaciens: infl uencing activity and stability[C]// Advanced Materials Research, Switzerland: Trans Tech Publications, 2014: 271-278.
[22] TRAN T T, MAMO G, BUXO L, et al. Site-directed mutagenesis of an alkaline phytase: influencing specificity, activity and stability in acidic milieu[J]. Enzyme and Microbial Technology, 2011, 49(2): 177-182.
[23] YAO Mingze, WANG Xi, WANG Wei, et al. Improving the thermostability of Escherichia coli phytase, AppA, by enhancement of glycosylation[J]. Biotechnology Letters, 2013, 35(10): 1669-1676.
[24] 沈琼, 黄滨, 邵嘉亮, 等. 运用圆二色谱研究酶与化合物相互作用的机理[J]. 中山大学学报: 自然科学版, 2006, 45(4): 62-64.
[25] 张耀华, 姚明泽, 卢文亮, 等. 大肠杆菌植酸酶在毕赤酵母中的表达与纯化[J]. 应用与环境生物学报, 2012, 18(4): 678-681.
[26] CORREIA I, AKSU S, ADAO P, et al. Vanadate substituted phytase: immobilization, structural characterization and performance for sulfoxidations[J]. Journal of Inorganic Biochemistry, 2008, 102(2): 318-329.
[27] 陈惠, 王红宁, 杨婉身. F43Y及I354 M, L358F定点突变对植酸酶热稳定性及酶活性的改善[J]. 中国生物化学与分子生物学报, 2005, 21(4): 516-520.
[28] 张海龙, 宋时英, 林政炯. 酶活性部位关键残基的晶体学温度因子[J].中国科学: C辑, 1999, 29(1): 9-16.
[29] REETZ M T, SONI P, FERNANDEZ L. Knowledge-guided laboratory evolution of protein thermolability[J]. Biotechnology and Bioengineering, 2009, 102(6): 1712-1727.
[30] YASUKAWA K, INOUYE K. Improving the activity and stability of thermolysin by site-directed mutagenesis[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2007, 1774(10): 1281-1288.
[31] SHIN S, HA N C, OH B C, et al. Enzyme mechanism and catalytic property of propeller phytase[J]. Structure, 2001, 9(9): 851-858.
Improvement of Catalytic Properties and Structure-Activity Relationship of Neutral Phytase Based on Site-Directed Mutagenesis
WANG Zupeng1,2, XU Wei2, SHAO Rong2, WEI Ping1,*
(1. College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211816, China; 2. School of Marine and Biological Engineering, Yancheng Institute of Technology, Yancheng 224051, China)
Three mu tations (D148E/H149R, Q67E/N68R and D191E) of neutral phytase from Bacillus amyloliquefaciens DSM 1061 have designed in our previous study. Enzymatic properties such as thermostability and catalytic effi ciency were studied in this paper. The structural changes were analyzed to explore the relationship with properties of mutant phytases. The results showed that the half-life of D191E was 4.3 min longer than that of wild-type phytase at 85 ℃, but its catalytic effi ciency reduced to 48.9% of wild-type phytase. The catalytic effi ciency of mutant D148E/H149R was increased to 229% of wild-type phytase although the half-life was similar. The catalytic efficiency of Q67E/N68R was 93% of wild-type phytase and the half-life was extended by 0.7 min. Circular dichroism showed that the catalytic effi ciency of D148E/H149R was improved most obviously while the content of α-helix decreased from 11.79% to 2.90%, and the content of random coil was increased. The structure of Q67E/N68R changed little and its properties were closed to those of wild-type phytase. The α-helical content of D191E increased to 24.59% while the catalytic effi ciency decreased a lot. Using homologous models to analyze the factors which may affect the thermal stability of phytases, we found that the B-factor value of D191 was high so that it was unfavorable to the stability of phytase. The hydrogen bonds around mutation residues also changed. Homologous model analysis will provide the theoretical basis for further study of phytase.
neutral phytase; site-directed mutagenesis; catalytic effi ciency; circular dichroism
Q55
A
1002-6630(2015)19-0118-06
10.7506/spkx1002-6630-201519021
2014-12-18
国家自然科学基金青年科学基金项目(31101912);江苏省自然科学基金项目(BK2011420);江苏省“青蓝工程”项目
王祖鹏(1990-),男,硕士研究生,研究方向为酶工程。E-mail:wzp9012@163.com
*通信作者:韦萍(1961-),女,教授,博士,研究方向为生化工程。E-mail:weiping@njtech.edu.cn

