从长白山阔叶林中筛选β-葡萄糖苷酶产生菌及其酶学性质研究
刘 欢,段文强,金 龙
(1.通化师范学院制药与食品科学学院,长白山食品工程研究中心,吉林 通化 134000;2.通化市卫生学校,吉林 通化 134000)
从长白山阔叶林中筛选β-葡萄糖苷酶产生菌及其酶学性质研究
刘 欢1,段文强2,金 龙1
(1.通化师范学院制药与食品科学学院,长白山食品工程研究中心,吉林 通化 134000;2.通化市卫生学校,吉林 通化 134000)
利用马丁氏培养基富集、PDA培养基纯化和七叶灵培养基显色,从长白山阔叶林中初步筛选出6 株产β-葡萄糖苷酶的真菌。对真菌发酵生成的β-葡萄糖苷酶进行提取和纯化,测得10号菌株的β-葡萄糖苷酶活力最高为18.34 U/mL,形态学和分子学结合方法鉴定该菌株为草酸青霉(Penicillium oxalicum)。该菌株所产β-葡萄糖苷酶最适反应温度约为55 ℃,在温度30、40 ℃和50 ℃时较为稳定。最适反应pH值约为5,在pH值为5~6之间相对较稳定。Cu2+对酶活力有较强的抑制作用,而Ag+有较强的激活作用。
草酸青霉;β-葡萄糖苷酶;筛选;酶学性质
长白山阔叶林(broad-leaved forest)是我国长白山山脉、小兴安岭山脉等温带地区最典型的地带性森林植物群落,其产生了大量凋落物质。凋落物质可以增加微生物群落结构多样性,提高微生物生物量,改善土壤酶活性[1-3]。目前,研究人员主要着重于长白山阔叶林生态结构、植物群落、土壤及其微生物群落结构和生物量等方面的研究[4-6],而有关微生物筛选、分离、鉴定和纯化及其应用方面的研究报道较少,可见长白山这一菌源宝库尚未被人们所认知。因此,如何开发利用这些微生物资源将成为今后研究的主要方向。
β-葡萄糖苷酶(β-glucosidase,简称BG),又名纤维二糖酶,是一种能催化水解芳基或烃基与糖基原子团之间糖苷键的酶[7]。β-葡萄糖苷酶在食品加工中用于水解糖苷和生氰物质等,可以促进风味前体物释放、苦味和有毒物质脱除[8-10]。González-Pombo等[11]将陆生伊萨酵母(Issatchenkia terricola)胞外提取纯化的β-葡萄糖苷酶用于葡萄酒酿制中,结果显示酶处理显著增加了单萜类化合物的数量,表现出固定化酶在葡萄酒香气形成中的运用潜能。在饮料加工中,利用β-葡萄糖苷酶对糖苷键的作用增加果汁的香气,可以把苦杏仁苷分解为苯甲醛和氢氰酸以及两分子葡萄糖[12-13];β-葡萄糖苷酶对生氰物质降解以脱除食品加工原料的毒性[14]。因此,β-葡萄糖苷酶的研究具有重要理论和实用价值。
1837年Wohler等首次在苦杏仁汁中发现β-葡萄糖苷酶后,研究人员先后在柑橘等植物的各组织中发现此酶[15-17]。从植物中提取β-葡萄糖苷酶成本过高,所以采用发酵的方法获得[18]。目前,最有效的β-葡萄糖苷酶产生菌是真菌中的曲霉和木霉菌,但这两类菌株普遍存在酶活力偏低的问题,使降解过程中外切葡聚糖酶和内切葡聚糖酶产生的纤维二糖积聚,降低酶解效率[19]。因此,选育具有较强活性的高产β-葡萄糖苷酶菌株就变得极为重要。本研究从长白山阔叶林中筛选产β-葡萄糖苷酶菌株,不仅可以充分利用长白山这一天然的、丰富的菌源库,还可以为获得高产β-葡萄糖苷酶菌株提供新的途径。
1 材料与方法
1.1 材料与试剂
七叶灵培养基:七叶灵1 g/L、柠檬酸铁0.5 g/L、蛋白胨10 g/L、氯化钠5 g/L;种子培养基:微晶纤维素20 g/L、玉米浆干粉10 g/L、葡萄糖10 g/L,调pH值至4.5;发酵培养基:微晶纤维素33 g/L、玉米浆27 g/L、(NH4)2SO45 g/L、KH2PO46 g/L、MgSO41 g/L、CaCO32.5 g/L、吐温-80 2 mL/L、甘油2.5 g/L,调pH值至5.0。
柠檬酸氢二钠、柠檬酸二氢钠、氢氧化钠和盐酸等试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-IFD超净工作台 天津亿诺科学仪器有限公司;GI54DW高压灭菌器 上海江莱生物科技有限公司;ZSD-1160生化培养箱 天津东南仪诚科技有限公司;SBA-40D生物传感分析仪 山东省科学院生物研究所;3-18K高速冷冻离心机 德国Sigma公司;TC-512梯度PCR仪 北京众益中和生物技术有限公司;DYY-7C电泳仪 北京市六一仪器厂;CX31+CCD数字显微镜 上海光学仪器厂。
1.3 方法
1.3.1 菌源样本选择
选择吉林省长白山阔叶林带落叶、腐质土壤为筛选β-葡萄糖苷酶菌株的来源。
1.3.2 菌种分离、纯化和筛选
称取5 g样品于50 mL无菌水中(三角瓶中加入玻璃珠),振荡混匀20 min。取1 mL悬浮液梯度稀释,每个梯度取200 μL涂布于马丁氏平板。取3 个平行,30 ℃恒温培养约3~5 d。真菌采用10-3~10-6稀释度,细菌10-4~10-7,放线菌同细菌。将平板上得到的单菌落取出,接于单个PDA平板上;挑取菌落的时候要选择没有重叠、单一的菌落。将目的菌株接于七叶灵平板上,30 ℃恒温培养约3~5 d。将目的菌株接于发酵培养基中,液体培养5 d,测定酶活力。
1.3.3 发酵
将目的菌株孢子悬液稀释至106~107,接取1 mL至种子培养基中(250 mL三角瓶含有30 mL培养基),28 ℃、180 r/min培养24 h。将种子培养基中的菌丝体按5%接种量接于发酵培养基中,28 ℃、180 r/min培养5 d,离心收集发酵液,进行酶活力测定。
1.3.4 酶活力测定
向柠檬酸缓冲液中加入1 mL酶液。至少要准备2 个稀释度的酶液,一个稀释度在反应条件下释放略少于1.0 mg的葡萄糖,另一稀释度则释放略高于1.0 mg的葡萄糖;加热至50 ℃,添加1.0 mL的底物溶液,混匀;50 ℃水浴反应30 min;沸水浴加热5.0 min,终止反应;冷却,通过生物传感分析仪测定葡萄糖的含量。在上述反应条件下,以1 min产生1 μmol葡萄糖所需的酶量为一个酶活力单位(U)。
1.3.5 形态鉴定
将菌株点接至新的PDA平板,30 ℃条件下培养,自接种起3 d后拍照,观察菌落形态特征。将培养好的菌落用无菌水稀释,吸取15 μL点至干净的载玻片上,盖上盖玻片,用光学显微镜观察菌丝体形态。
1.3.6 分子鉴定
将目的菌株接于CM液体培养基中,置于恒温摇床中,30 ℃、200 r/min培养2 d;将CM液体培养基中的菌丝过滤收集,进行基因组DNA提取;采用ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4 (5’-TCCTCGCCTTATTGATATGC-3’)引物扩增菌株内源转录间隔区(internally transcribed spacer,ITS);采用琼脂糖凝胶电泳检测DNA,置于凝胶成像系统中,对电泳结果进行分析;回收DNA凝胶,对回收片段进行载体的连接与转化;用同一对引物,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,凝胶琼脂糖电泳检测,验证目的基因是否丢失。将有目的条带的菌液送北京奥维森基因科技有限公司测序。测序后将所得序列与GenBank中序列进行BLAST比对。
1.3.7 酶学性质测定[20]
1.3.7.1 最适反应温度测定
用pH 5.0缓冲液稀释β-葡萄糖苷酶,再与底物分别在30、35、40、45、50、55、60、65、70、75、80 ℃条件下反应30 min,测定其酶活力。
1.3.7.2 热稳定性测定
用pH 5.0缓冲液稀释β-葡萄糖苷酶,分别在30、40、50、60、70、80 ℃条件下保温10、20、30、40、50、60 min,然后冷却,将酶液底物在55 ℃条件下反应30 min,测定酶活力。将最高酶活力设为100%,其他条件下酶活力与最高酶活力的比值为相对酶活力。
1.3.7.3 最适反应pH值测定
分别用pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0缓冲液稀释β-葡萄糖苷酶,再与底物在55 ℃条件下反应30 min,测定其酶活力。
1.3.7.4 pH值稳定性测定
用pH值为3.0、4.0、5.0、6.0、7.0、8.0缓冲液稀释β-葡萄糖苷酶,再与底物分别在55 ℃条件下反应30 min,测定酶活力。将最高酶活力设为100%,其他条件下酶活力与最高酶活力的比值为相对酶活力。
1.3.7.5 金属离子对酶活力的影响
用1 mmol/L的K+、Na+、Ag+、Ca2+、Mg2+、Cu2+、Zn2+、Mn2+、Fe3+缓冲液稀释β-葡萄糖苷酶,再与底物分别在55 ℃条件下反应30 min,测定酶活力,其酶活力与不加金属离子缓冲液稀释β-葡萄糖苷酶的比值为相对酶活力。
1.3.7.6 底物特异性
以微晶纤维素、羧甲基纤维素、纤维二糖、水杨苷为底物,将缓冲液稀释的β-葡萄糖苷酶1 mL与1 mL底物缓冲液在55 ℃反应30 min,加入2.0 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)溶液,煮沸5 min后,蒸馏水定容至25 mL,混匀在540 nm波长处测定各管吸光度。
2 结果与分析
2.1 菌种筛选结果
从长白山阔叶林带叶子和土壤分离出19 个菌株,将各菌株点种于七叶灵培养基中,以培养4 d后黑色深浅程度和黑色圆圈直径大小为作为筛选的标准。在19 个菌株中,1、2、7、8、10和16号菌株在七叶灵平板显黑色,黑色深浅程度和黑色圆圈直径大小实验结果见表1。七叶灵显色结果表明,筛选出的1、2、7、8、10和16号6 个菌株出现了黑色。其中10号菌株显色效果最好,七叶灵显色后的现象见图1。将初筛得到6 株菌株进行发酵培养,对生成β-葡萄糖苷酶进行提取和纯化,测定β-葡萄糖苷酶酶活力测定的结果见表1。生物传感分析仪测得10号菌株的β-葡萄糖苷酶活力最高为18.34 U/mL。

表 11 产β-葡萄糖苷酶菌株筛选Table 1 Screening of β-glucosidase-producing fungi
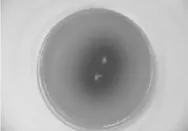
图1 10号菌株在七叶灵培养基上的显色结果Fig.1 Color development of strain 10 on esculin medium
2.2 形态鉴定结果
将10号菌株接种于无菌的PDA培养基上,置于30 ℃培养3 d,观察其菌落形态和菌丝形态。由图2a可知,PDA培养基上,30 ℃培养3 d,10号菌株即形成较典型的菌落。菌落中间呈蓝绿色,边缘为白色,直径约20 mm。由图2b可知,10号菌株的菌丝体细长,孢子个体较大,成串状分布。
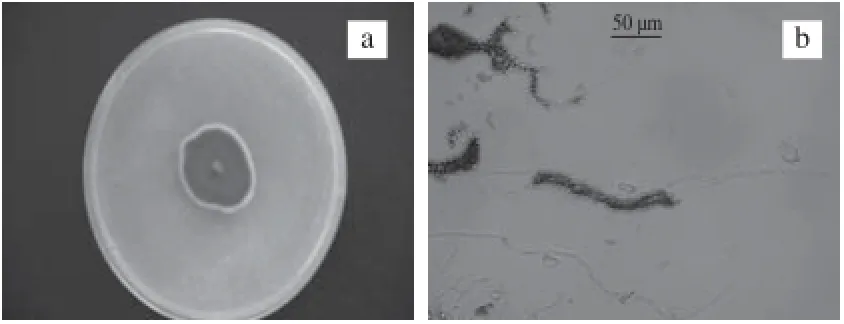
图2 10号菌株3 d菌落形态(a)和菌丝孢子形态(b)(×400)Fig.2 Morphology of bacterial colony of strain 10 (×400)
2.3 测序及序列分析
获得10号菌株基因组DNA,利用ITS引物在55 ℃退火温度下,进行PCR反应,经35 个循环后,两个试样均得到目的扩增产物,大小650 bp左右,见图3。
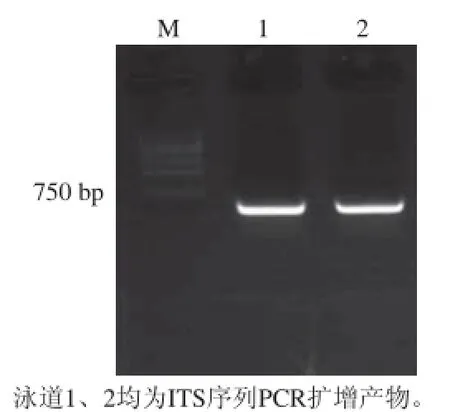
图3 ITS序列PCR扩增电泳图Fig.3 Electrophoresis of amplifi ed ITS sequence
ITS扩增序列如下:
GGAAGTAAAAGTCGTAACAAGGTTTCCGTAGG TGAACCTGCGGAAGGATCATTACCGAGTGAGGGCC CTCTGGGTCCAACCTCCCACCCGTGTTTATCGTACC TTGTTGCTTCGGCGGGCCCGCCTCACGGCCGCCGGG GGGCATCCGCCCCCGGGCCCGCGCCCGCCGAAGAC ACACAAACGAACTCTTGTCTGAAGATTGCAGTCTGAGTACTTGACTAAATCAGTTAAAACTTTCAACAAC GGATCTCTTGGTTCCGGCATCGATGAAGAACGCAG CGAAATGCGATAAGTAATGTGAATTGCAGAATTCA GTGAATCATCGAGTCTTTGAACGCACATTGCGCCCC CTGGTATTCCGGGGGGCATGCCTGTCCGAGCGTCAT TGCTGCCCTCAAGCACGGCTTGTGTGTTGGGCTCTC GCCCCCCGCTTCCGGGGGGCGGGCCCGAAAGGCAG CGGCGGCACCGCGTCCGGTCCTCGAGCGTATGGGG CTTCGTCACCCGCTCTGTAGGCCCGGCCGGCGCCCG CCGGCGAACACCATCAATCTTAACCAGGTTGACCT CGGATCAGGTAGGGATACCCGCTGAACTTAAGCAT ATCAATAAGCGGAGGAA
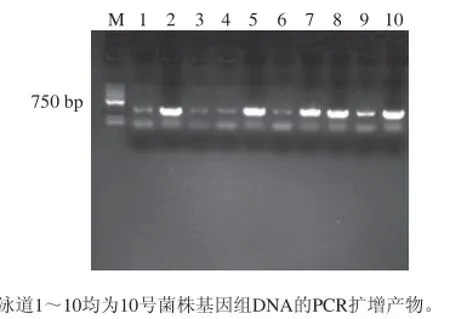
图4 10号菌株验证载体上目的基因的电泳图Fig.4 Electrophoresis of target genes from the carrier of strain 10
由图4可知,经DNA凝胶回收、载体的连接与转化、挑斑、PCR扩增后,取10 个样品进行琼脂糖凝胶电泳检测,10 个样品在650 bp左右均有条带,其中泳道2、5、7、8、10的条带较为清晰,表明载体上的目的基因没有丢失,可将载体送基因公司测序。测序结果表明,ITS片段长度为615 bp,经过在NCBI数据库中BLAST比对发现,菌株与草酸青霉(Penicillium oxalicum)亲缘性最为接近,相似度高达100%,因此鉴定10号菌株为草酸青霉。
2.4 酶学性质
2.4.1 最适反应温度
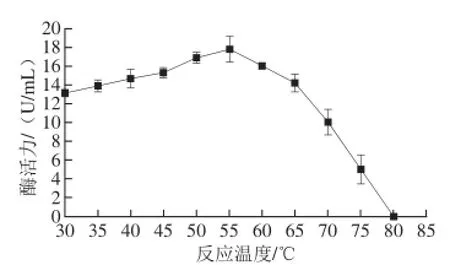
图5 反应温度对β-葡萄糖苷酶酶活力的影响Fig.5 Effect of reaction temperature on the activity of β-glucosidase
由图5可知,β-葡萄糖苷酶酶活力随着温度升高而增加,当反应温度为55 ℃时,β-葡萄糖苷酶酶活力达到最高值为17.84 U/mL,之后β-葡萄糖苷酶酶活力随着温度升高而减小。说明β-葡萄糖苷酶最适反应温度约为55 ℃。
2.4.2 温度对酶稳定性的影响

图6 温度对β-葡萄糖苷酶稳定性的影响Fig.6 Effect of temperature on the stability of β-glucosidase
在不同保温处理条件下,温度对β-葡萄糖苷酶稳定性影响的结果见图6。在保温温度为30、40、50 ℃时,相对酶活力比较稳定;在保温温度为60 ℃和70 ℃时,相对酶活力随着保温时间延长而急剧下降为0。说明在温度30、40、50 ℃时β-葡萄糖苷酶较为稳定。
2.4.3 最适反应pH值

图7 pHH值对β-葡萄糖苷酶酶活力的影响Fig.7 Effect of pH on the activity of β-glucosidase
由图7可知,β-葡萄糖苷酶酶活力随着pH值升高而增加,当pH值为5时,β-葡萄糖苷酶酶活力达到最高值17.01 U/mL,之后β-葡萄糖苷酶酶活力随着pH值升高而减小。说明β-葡萄糖苷酶最适pH值约为5。
2.4.4 pH值对酶稳定性的影响
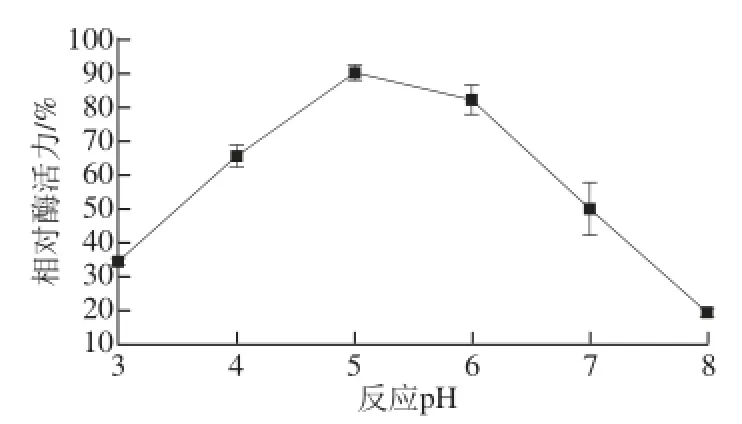
图8 pHH值对β-葡萄糖苷酶稳定性的影响Fig.8 Effect of pH on the stability of β-glucosidase
在不同pH值反应条件下,pH值对酶稳定性影响的结果见图8。β-葡萄糖苷酶相对酶活力随着pH值升高而增加,当pH值为5~6时,β-葡萄糖苷酶相对酶活力变化较小,之后相对酶活力随着pH值升高而急剧减小。说明β-葡萄糖苷酶在pH值为5~6相对较稳定。
2.4.5 不同金属离子对酶活力的影响
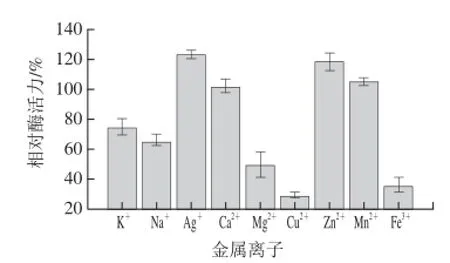
图9 金属离子对β-葡萄糖苷酶酶活力的影响Fig.9 Effect of metal ions on the activity of β-glucosidase
由图9可知,K+、Na+、Mg2+、Cu2+、Fe3+对β-葡萄糖苷酶活力有抑制作用,其中Cu2+抑制作用最明显,相对酶活力仅为29.62%。Ag+、Ca2+、Zn2+、Mn2+对β-葡萄糖苷酶活力有激活作用,其中Ag+激活作用最明显,相对酶活力达到123.23%。
2.4.6 β-葡萄糖苷酶的底物特异性
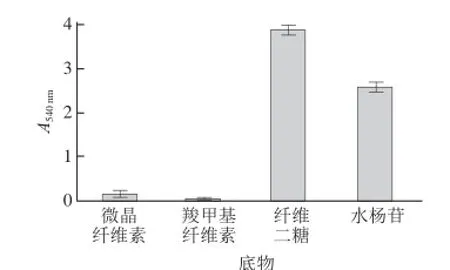
图10 β-葡萄糖苷酶的底物特异性Fig.10 Substrate specifi city of β-glucosidase
β-葡萄糖苷酶底物特异性的测定结果见图10。β-葡萄糖苷酶对微晶纤维素和羧甲基纤维素酶解能力较弱,而对纤维二糖和水杨苷的酶解能力较强。这说明底物种类直接影响β-葡萄糖苷酶酶活力。
3 结论与讨论
本研究利用马丁氏培养基富集、PDA培养基纯化和七叶灵显色技术这一系列方法筛选产β-葡萄糖苷酶菌株,这些方法综合应用才能得到确实可靠的结果[21]。其中,七叶灵显色技术对于产β-葡萄糖苷酶菌株的识别能力快速有效,通过七叶灵培养基上黑色深浅的程度以及黑色圆圈的直径,初步筛选出产β-葡萄糖苷酶的真菌[22]。本研究从菌源地采得样品中分离得到形态不同,且生长较快的菌株共19 株,接入七叶灵培养基,筛选出6 株具有黑色圆圈的菌株。将初筛得到的6 株菌株进行发酵培养,对生成的β-葡萄糖苷酶进行提取和纯化,生物传感分析仪测得10号菌株的β-葡萄糖苷酶活力最高为18.34 U/mL,此菌株产酶的酶活力略高于个别报道[23]。本研究对该菌株进行培养,形成的菌落中间呈蓝绿色、边缘为白色、直径约20 mm,菌丝体细长、孢子个体较大、成串状分布,初步鉴定10号菌株为霉菌。
一般来说对菌种的鉴定都是釆用形态学描述和生理生化特性实验相结合,但是由于菌株之间存在着形态的相似和某些生理性质的相近,使得菌种鉴定的准确性无法得到保证[24]。本研究釆用形态鉴定和分子鉴定(ITS序列分析)相结合的方法对10号菌株进行鉴定,消除菌种鉴定时的误差,确定该菌株为草酸青霉(Penicillium oxalicum),相似度达100%。目前,用来生产β-葡萄糖苷酶的微生物大多为真菌类,研究较多的有木霉属、曲霉属、根霉属和漆斑霉属,对草酸青霉的研究相对较少[25]。研究报道表明,草酸青霉是生产纤维素酶和果胶酶的主要菌株之一,该菌株因具有一定的安全性,研究人员用其产生的酶来提高水果出汁率[26-27]。因此,本研究筛选出草酸青霉不仅丰富了产β-葡萄糖苷酶菌株资源,还可以扩大草酸青霉产β-葡萄糖苷酶在食品领域的应用。
β-葡萄糖苷酶酶活力受温度、pH值、金属离子、底物等条件的影响[28]。本研究发现β-葡萄糖苷酶最适反应温度约为55 ℃,在温度30、40、50 ℃时较为稳定;β-葡萄糖苷酶最适反应pH值约为5,在pH值为5~6相对较稳定;K+、Na+、Mg2+、Cu2+、Fe3+对β-葡萄糖苷酶活力有抑制作用,其中Cu2+抑制作用最明显,相对酶活力仅为29.62%。Ag+、Ca2+、Zn2+、Mn2+对β-葡萄糖苷酶活力有激活作用,其中Ag+激活作用最明显,相对酶活力达到123.23%;该酶对纤维二糖和水杨苷的水解作用较强。本研究表明,获得的菌株所产β-葡萄糖苷酶在中温和偏酸性条件下可以水解低聚糖和糖苷类物质。因此,该酶可以应用在食品加工中细胞壁寡糖和纤维素的降解、糖脂的水解、生氰物质的脱除以及产品风味的改变方面。
[1] COLEMAN D C. From peds to paradoxes: linkages between soil biota and their infl uences on ecological processes[J]. Soil Biology and Biochemistry, 2008, 40(2): 271-289.
[2] GARTNER T B, CARDON Z G. Decomposition dynamics in mixedspecies leafl itter[J]. Oikos, 2004, 104(2): 230-246.
[3] HOORENS B, AERTS R, STROETENGA M. Does initial litter chemistry explain litter mixture effects on decomposition?[J]. Oecologia, 2003, 137(4): 578-586.
[4] 陈法霖, 张凯, 郑华, 等. PCR-DGGE技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响[J]. 应用与环境生物学报, 2011, 17(2): 145-150.
[5] 富宏霖, 王生荣, 韩士杰, 等. 土壤干湿交替对长白山阔叶红松林土壤微生物活性与区系的影响[J]. 东北林业大学学报, 2009, 37(7): 80-81; 86.
[6] 梁宇, 许嘉巍, 胡远满, 等. 长白山阔叶红松林退化生态系统的土壤呼吸作用[J]. 应用生态学报, 2010, 21(5): 1097-1104.
[7] 谢宇, 尚晓娴, 曹黎华. 黑曲霉产β-葡萄糖苷酶液体培养基研究[J].南昌航空大学学报: 自然科学版, 2007, 21(4): 49-52.
[8] 祝霞, 韩舜愈, 蒋玉梅, 等. 酶解处理对‘贵人香’干白葡萄酒香气物质的影响[J]. 甘肃农业大学学报, 2011, 46(2): 129-134.
[9] 潘利华, 罗建平. β-葡萄糖苷酶的研究及应用进展[J]. 食品科学, 2006, 27(12): 803-807.
[10] 李远华. β-葡萄糖苷酶的研究进展[J]. 安徽农业大学学报, 2002, 29(4): 421-425.
[11] GONZÁLEZ-POMBO P, FARINA L, CARRAU F, et al. A novel extracellular β-glucosidase from Issatchenkia terricola: isolation, immobilization and application for aroma enhancement of white Muscat wine[J]. Process Biochemistry, 2011, 46(1): 385-389.
[12] 王鸿飞, 李和生, 董明敏, 等. 柚皮苷酶对柑橘类果汁脱苦效果的研究[J]. 农业工程学报, 2004, 20(6): 174-176.
[13] SU Erzheng, XIA Tao, GAO Liping, et al. Immobilization of β-glucosidase and its aroma-increasing effect on tea beverage[J]. Food and Bioproducts Processing, 2010, 88(2/3): 83-89.
[14] NATA G Z, VALLIER M. Production of a highly glucosetolerant extracellular β-glucosidase by three aspergillus strains[J]. Biotechnology Letters, 1999, 21(3): 219-223.
[15] KRINGS U, BERGER R G. Biotechnological production of fl avours and fragrances[J]. Applied Microbiology and Biotechnology, 1998, 49(1): 1-8.
[16] BARBAGALLO R N, PALMERI R, FABIANO S, et al. Characteristic of β-glucosidase from Sicilian blood oranges in relation to anthocyanin degradation[J]. Enzyme and Microbial Technology, 2007, 41(5): 570-575.
[17] 张卓, 陈晓平. 荞麦中β-葡萄糖苷酶提取条件的研究[J]. 食品与发酵科技, 2010, 46(6): 19-21; 28.
[18] 黄琴, 朱婷, 蒋承建, 等. 产β-葡萄糖苷酶的菌种的筛选, 鉴定及其酶学特性[J]. 基因组学与应用生物学, 2011, 30(5): 590-595.
[19] 陈静, 郝伟伟, 王春梅, 等. 产β-葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析[J]. 食品科学, 2013, 34(5): 191-196.
[20] 付建红, 任晓源, 范秋霜, 等. 从天山花楸中分离筛选纤维素酶产生菌及其酶学性质研究[J]. 食品科学, 2012, 33(23): 228-231.
[21] 赵林果, 孟鹏, 李丽娟, 等. 利用七叶灵显色技术检验和判断β-葡萄糖苷酶的研究[J]. 食品与发酵工业, 2008, 34(12): 163-162.
[22] EDBERG C E, TREPETA R W, KONTNICK C M, et al. Measurement of active constitutive β-glucosidase (Esculinase) in the presence of sodium desoxycholate[J]. Journal of Clinical Microbiology, 1985, 21(3): 363-365.
[23] 覃拥灵, 何海燕, 刘园园, 等. 产β-葡萄糖苷酶野生真菌的筛选鉴定及酶学性质研究[J]. 中国酿造, 2012, 31(3): 53-57.
[24] 唐德芳, 裴小琼, 李晓璐, 等. 黑曲霉β-葡萄糖苷酶的筛选、克隆及表达[J]. 应用与环境生物学报, 2009, 15(3): 423-426.
[25] PYO Y H, LEE T C, LEE Y C. Enrichment of bioactive isofl avones in soymilk fermented with β-glucosidase-producing lactic acid bacteria[J]. Food Research International, 2005, 38(5): 551-559.
[26] 张名爱, 王宝维, 岳斌, 等. 草酸青霉果胶酶分离纯化工艺及酶学性质研究[J]. 食品科学, 2013, 34(9): 175-179. doi: 10.7506/spkx1002-6630-201309036.
[27] 张倩, 王宝维, 张名爱, 等. 鹅源草酸青霉F67产纤维素酶培养条件的优化[J]. 沈阳农业大学学报, 2009, 40(1): 47-52.
[28] 谢宇, 尚晓娴, 胡金刚. β-葡萄糖苷酶纯化及酶学性质研究[J]. 江西农业大学学报, 2008, 30(3): 521-524.
Screening and Enzymatic Characteristics of β-Glucosidase-Producing Fungus from Broad-Leaved Forest in Changbai Mountain
LIU Huan1, DUAN Wenqiang2, JIN Long1
(1. Research Center of Changbai Mountain Food Engineering, College of Pharmaceutical and Food Science, Tonghua Normal University, Tonghua 134000, China; 2. Tonghua City Health School, Tonghua 134000, China)
Six β-glucosidase-producing fungi were screened through enrichment culture in martin medium, purifi cation with PDA medium, and color development with an esculin-based chromogenic medium. β-Glucosidase was extracted and purifi ed from the fermentation broth. Strain 10 revealed the highest β-glucosidase activity of 18.34 U/mL. The strain was identifi ed as Penicillium oxalicum by morphological and molecular methods. The β-glucosidase had optimal temperature of 55 ℃ and was stable at 30, 40, and 50 ℃. The enzyme had optimal pH of 5 and could be stable between pH 5 and 6. Ag+could activate the β-glucosidase while Cu2+could inhibit its activity.
Penicillium oxalicum; β-glucosidase; screening; enzymatic characteristics
Q814
A
1002-6630(2015)19-0180-06
10.7506/spkx1002-6630-201519032
2014-11-07
吉林省科技发展计划项目(20150101117JC;20130522093JH);吉林省教育厅“十二五”科学技术研究项目(2013494)
刘欢(1981-),女,讲师,博士,研究方向为食品发酵与酿造。E-mail:liuhuan800331@163.com

