胶原水解产物生物功能性的研究进展
段 炼,杜 峥,张德胜
(西南大学纺织服装学院,重庆 400715)
胶原水解产物生物功能性的研究进展
段 炼,杜 峥,张德胜*
(西南大学纺织服装学院,重庆 400715)
胶原是动物体内含量最丰富的蛋白质,其特有的三股螺旋结构以及氨基酸序列使得胶原及其水解产物具有生物相容性、生物功能性等诸多优点,可以广泛地应用于生物医学、组织工程、食品保健等领域。本文结合国内外最新研究成果,综述了胶原水解产物的生物功能性,包括抗菌性能、抗氧化性和降血压等。指出我国胶原相关产业的发展除了生产传统的组织工程和医药材料之外,还应该根据其特性,拓展其应用范围,开发出各种具有生物功能性的食品和保健品。
胶原水解产物;抗菌性;抗氧化性;降血压
胶原是生物体内细胞间质的主要组成成分,广泛存在于动物的皮、肌腱、软骨、血管及各种结缔组织中,起着支撑器官及保护机体的作用[1]。迄今为止,已经发现了28 种不同类型的胶原[2]。其中,约9 0%的胶原都是纤维胶原,例如主要分布在皮里的Ⅰ型、主要分布在软骨和玻璃体里的Ⅱ型和主要分布在血管里的Ⅲ型胶原是属于纤维胶原[3]。胶原分子是由3 条α多肽链组成的,在α多肽链中,甘氨酸(Gly)约占氨基酸残基总量的25%~30%,脯氨酸(Pro)约占12%,羟脯氨酸(Hyp)约占10%。氨基酸残基按照Gly-X-Y的顺序呈周期性排列,其中,X与Y常分别为脯氨酸和羟脯氨酸,且3 条左手螺旋的α多肽链相互缠绕,形成一个右手三股螺旋结构[4]。
提取纯化的未变性胶原由于保持了其在动物体内特有的三股螺旋结构,具有低免疫原性、活化血小板、可生物降解性、促进细胞生长等特点[5],使得胶原可以被制成止血海绵、手术缝合线、人工血管、人工皮肤、护肤品和药物载体而广泛应用于生物医学、组织工程和化妆美容等领域[2]。胶原在高温或酶等作用下可以水解成明胶或水解胶原;水解后胶原特有的三股螺旋结构被破坏了[6]。此外,胶原、明胶或水解胶原还可以进一步水解成多肽。新的研究表明[7-8],胶原水解产物具有抗菌性、抗氧化性以及降血压等诸多生物功能性,以此为基础可以开发各种食品、保健品和医学药品,促进我国胶原产业的发展。
1 抗菌性
作为细胞间质的主要成分,胶原会被一些细菌所侵蚀,例如绿脓杆菌可以侵蚀Ⅰ型胶原基质[7]。但是研究发现胶原也具有一定的抗菌性能,例如Jus等[8]将胶原涂覆在羊毛材料外发现其具有抵抗细菌和真菌侵蚀的功效。Abdillahi等[9]的研究表明某些特殊类型的胶原具有天然的灭菌性能:细胞间质中的Ⅵ型胶原在生理环境中可以杀灭革兰氏阳性细菌和阴性细菌,为组织细胞提供了先天性的抗菌保护,其灭菌机理可能与细菌的细胞膜被破坏有关。
由胶原、水解胶原制成的一些多肽具有较强的抗菌性。Gomez-Guillen等[10]分别用鱿鱼胶原和金枪鱼皮胶原制备了分子质量小于1 kD和分子质量在1~10 kD的多肽,并用琼脂扩散法研究了其对常见细菌的抗菌性能,研究结果表明这两种多肽对革兰氏阴性和阳性细菌以及乳酸菌等均具有较好的抗菌性。Kempka等[11]发现将水解胶原和甘露醇溶解并涂覆在草莓表面后有较好的抗菌性能,能延长草莓的保鲜期;当胶原质量分数为7.5%、甘露醇质量分数为2.5%时草莓的保鲜期可达12 d。然而,迄今为止,这些多肽的抗菌机理尚未确定。di Bernardini 等[12]认为多肽抗菌性可能与其氨基酸组成、序列、分子质量以及细菌种类都有关系;Wieprecht等[13]的研究表明带正电荷的抗菌多肽可以通过静电吸附与带负电荷的细菌细胞膜接近,多肽中的疏水性氨基酸则有助于其进入到细菌细胞膜中。Gomez-Guillen等[10]则认为当胶原或水解胶原降解成多肽之后,其分子质量降低,暴露在外的氨基酸残基和电荷增多了,促进了其与细菌细胞膜的相互作用,从而赋予了多肽抗菌性能。此外,胶原制备的氨基酸还可以用来合成抗菌化合物:例如Molinero等[14]将胶原水解制得的氨基酸与月桂酰精氨酸合成了具有表面活性效果的二肽,这种二肽由于带有阳电荷,其对革兰氏阴性和阳性细菌都有很强的抗菌性。
2 抗氧化性
人与外界环境的接触以及人的各种生理活动会使人体内积累大量的自由基。这些自由基如果不能及时清除会加速机体的衰老,引发癌症及其他疾病。一些研究表明胶原具有清除自由基、抗氧化的功效。李春楠等[15]研究了象皮、猪皮和鱼鳞胶原的抗氧化功效,结果表明鱼鳞胶原、象皮胶原和猪皮胶原清除自由基的IC50值分别为0.51、0.42、0.60 g/L,具有一定的抗氧化功效;胶原质量浓度越高,其自由基清除效果越好。Jeevithan等[16]研究了Ⅱ型酸溶银鲨软骨胶原、Ⅱ型酶溶银鲨软骨胶原和Ⅱ型银鲨明胶的抗氧化功效,结果表明它们对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率在16%~24%,且Ⅱ型酶溶银鲨软骨胶原的抗氧化性最好。
此外,很多蛋白质水解产物、多肽和氨基酸都能与活性氧反应并清除自由基,因此它们都具有抗氧化性的功效[17]。其中多肽比氨基酸具有更强的自由基清除能力,因此其抗氧化性比氨基酸更强[18]。相关研究表明胶原的水解产物也具有抗氧化的功效。Ding Jinfeng等[19]从水母中提取制备了水解胶原并研究了其抗氧化和抗疲劳的功效,结果表明小鼠服用这种水解胶原后能表现出更好的运动能力,其血液中的乳酸和尿素氮含量降低了20%~30%,肝糖原和肌糖原含量增加了30%~50%。Mendis[20]及Kim[21]等的研究表明鱿鱼、鱼皮和牛皮制成的明胶均具有抗氧化性的功效。杨芳宁[22]将猪皮胶原降解并制成了多肽,发现其具有较高的抗脂质氧化能力、较强的清除自由基能力和金属螯合能力,且抗氧化活性随着底物浓度的增加而增加。Kim等[23-25]的研究表明明胶制备的多肽抗氧化性要好于其他蛋白源制备的多肽,而且由胶原或明胶制备的多肽可以保护细胞免受自由基的氧化损害。Mendis等[20]的研究表明由鱿鱼皮明胶制备的多肽可以强化人类肺部成纤细胞的细胞存活能力,使其免受叔丁基氢过氧化物诱导的细胞毒性的损害。此外,他们还发现从鳕鱼皮明胶中提取的多肽可以强化谷胱甘肽过氧化物酶、过氧化氢酶和超氧化物歧化酶等抗氧化酶在人肝癌细胞中的活性[26]。
目前胶原及其水解产物抗氧化功效的生物活性机理还有待系统的研究。很多研究表明多肽的抗氧化性能与其氨基酸序列、疏水性和分子质量有关。
2.1 氨基酸序列
明胶和胶原的水解产物的氨基酸组成与胶原类似,富含Gly、Ala、Pro、Hyp、Glu和Asp,但是Met、Cys、His和Tyr含量很少[20,27]。根据Dávalos等[28]的研究,单个氨基酸中抗氧化活性最强的是Trp、Tyr和Met,然后是Cys、His和Phe,其余的氨基酸没有任何的抗氧化活性。然而,很多多肽虽然并不含有上述具有抗氧化活性功能的氨基酸,却依然具有抗氧化功能。例如Kim等[24]从鳕鱼皮中提取了两种具有抗氧化功效的多肽,它们分别由13 个和16 个氨基酸组成,含有Gly-Pro-Hyp的氨基酸序列,且在碳端含有甘氨酸。Li Bo等[29]发现由猪皮胶原水解物制备的多肽中,具有Gln-Gly-Ala-Arg氨基酸序列的抗氧化活性最强。此外,Mendis等[20]的研究表明氨基酸序列为Asn-Gly-Pro-Leu-Gln-Ala-Gly-Gln-Pro-Gly-Glu-Arg的多肽具有抑制自由基的功能。
2.2 疏水性
有的学者则认为由胶原制备的多肽具有抗氧化功能的原因可能与其含有较多的疏水性氨基酸有关,这些疏水性氨基酸可以增加多肽在脂类物质中的溶解度而强化其抗氧化功效[20,24]。Rajapakse等[30]认为由皮胶原制备的多肽比肉类蛋白制得的多肽具有更好的抗氧化性是因为其含有更多的疏水性的Gly和Pro。
2.3 分子质量
Gomez-Guillen等[10]发现从鱿鱼皮水解物制备的多肽都具有抗氧化性,但其抗氧化能力和多肽分子质量有很大的关系:分子质量越低的多肽其抗氧化性越强。Yang[31]和Yang Hongshun[32]等的研究则表明在鱼皮明胶的水解产物中,分子质量低于700 D的多肽的自由基清除能力要比其他的强20%左右。Li Zongrui等[33]研究了分子质量与水解胶原抗氧化功效的关系,结果表明,在研究的39 种海洋鱼类水解胶原中(分子质量大于0.64 kD,小于257 kD),其分子质量越小,水解胶原清除自由基的功效越强。类似地,Chi Changfeng等[34]在研究鱼胶原水解产物抗氧化功效时也发现分子质量越小的水解产物抗氧化性越强。水解制备多肽时所用蛋白酶的种类也决定着水解产物的大小和氨基酸序列,因此也会影响多肽的抗氧化功能。有研究表明,由碱性蛋白酶水解明胶(或胶原)制备的多肽的抗氧化功能要比用胶原酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶或中性蛋白酶等水解明胶制备的多肽要好[27,35]。
3 降低血压
高血压会损伤血管,使身体的重要器官发生缺血和功能受损,甚至危及生命。因此,高血压的防治对于保护人们生命安全具有十分重要的意义。血管紧张素转化酶(angiotensin converting enzyme,ACE)会使无活性的血管紧张素Ⅰ转变为使血管收缩的血管紧张素Ⅱ,引发高血压。因此,抑制ACE的活性可以有效地治疗高血压[36-37]。相关研究表明摄入一些功能性的多肽后,可以抑制ACE的活性,进而减少血管紧张素Ⅱ的产生,达到降低血压的功效[37]。在从蛇毒中提取了具有抑制ACE活性的多肽后,人们尝试人工合成具有这种功能的多肽。但人工合成的这种多肽会引发咳嗽、味觉失调、皮疹等副作用[38]。因此,人们试图从蛋白质等天然产物中提取具有抑制ACE活性功能且副作用较小的多肽。具有抑制血管紧张素转化酶活性功能多肽可以从牛奶、血蛋白、玉米、鹰嘴豆、大豆以及牛、鸡、猪、鱼的肌肉蛋白中提取[39-40]。
有研究表明胶原和明胶经酶解后也能制备具有降血压功效的多肽[41-43],例如从脊椎动物的皮、骨、鳞片以及软体动物的鱿鱼鞘、海参中提取的胶原都可以制备具有抑制ACE活性功能的多肽和水解产物。此类多肽的降血压功能一般是在大鼠体内进行测试的[44]。许多由胶原制备的抑制ACE活性多肽已经进行了动物实验并获得了不错的实验效果。例如大鼠分别口服鸡腿骨胶原水解物和Gly-Ala-Hyp-Gly-Leu-Hyp-Gly-Pro八肽都可以明显地降低其血压[43,45]。Faria等[46]发现大鼠口服猪皮和牛皮胶原水解物后,其血压也明显降低了。由猪皮胶原水解制备的两种多肽(Gly-Pro和Gly-Phe-Hyp-Gly-Pro)也可以降低大鼠的血压[41]。
多肽的ACE抑制功能与其结构之间的关系尚不清楚,但具有这种功效的多肽都有相似的特点:由于ACE的活性位点不能容纳大分子的多肽[47],因此这些多肽肽段较短,分子质量较小。Murray等[48]发现在碳端含有疏水氨基酸的多肽更容易抑制ACE的活性。此外,碳端含有Arg或者Lys也会强烈抑制ACE的活性。胶原和明胶水解物具有抑制ACE的功能则可能是因为其含有大量的疏水氨基酸,例如Pro。Pro可能是抑制ACE活性效果最好的氨基酸,很多具有ACE抑制功能的氨基酸中都含有Pro[49-50]。表1列出了一些由胶原及其水解产物制备的具有抑制ACE活性功效的多肽的结构及ACE活性被抑制一半时所需多肽的浓度(IC50)。
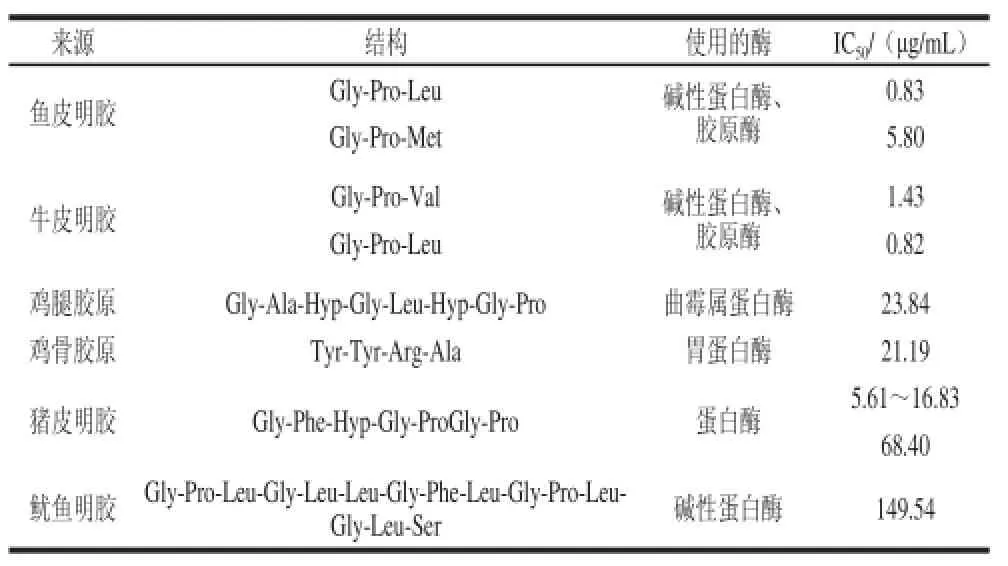
表1 由胶原及其水解产物制备的具有抑制ACE活性功效的多肽结构[51]Table 1 ACE inhibitory peptides derived from collagenous sources[51]
Zhang Yuhao等[52]用酶处理牛皮胶原并制备了具有抑制ACE活性功能的多肽,结果表明使用碱性蛋白酶和胶原酶水解胶原,不需预处理就能制备具有抑制ACE功能的多肽;在酶水解前如果高温高压预处理5 min则可以得到分子质量更小且ACE抑制能力更强的多肽。Kong Qing等[53]则研究了由胶原生产具有降血压功效多肽的生产工艺,比对其进行了优化。结果表明,pH 2、质量浓度为8.23 g/100 mL的胶原溶液在37 ℃条件下用酶酶解3.82 h所得到的产物降血压功效最好;同时使用胃蛋白酶和胰蛋白酶水解的产物抑制ACE活性能力最好(88.25%),其IC50值也最低(141.64 μg/mL)。Zhuang Yongliang等[54]从水母胶原中制备了具有降血压功效的多肽并优化了其制备条件,结果表明,在52.7 ℃、pH 8.63、酶用量为3.46%时,具有降血压功效的多肽产量最高,达到81.7%。
4 结 语
我国的畜牧业和渔业都非常发达,每年的猪、牛、羊以及鱼类的产量都位居世界前列,有着非常丰富的胶原原料。但是和发达国家相比,我国的胶原产业才刚起步,存在着知识普及不足、生产方式较落后、产品附加值较低等缺陷。我们在研究开发胶原相关产品时,除了生产常用的人工皮肤、支架材料等生物医学和组织工程材料之外,还可以结合胶原及其水解产物的抗菌性、抗氧化性及降血压等功效生产各种具有生物功效的食品、保健品及医药用品。例如在生产胶原肠衣时可以添加具有抗菌功效的胶原水解产物,使肠衣在保鲜的同时又能抗菌,食用时更加卫生安全;在生产保健口服液时,可以适当地添加具有抗氧化功效的胶原水解产物,提升产品的保健功效。这样在满足人们不同需要的同时,引入各种前沿的科研成果,提高产品的附加值,促进了胶原相关产业的发展,同时能带来更好的经济效益和社会效益。
[1] 汤克勇. 胶原物理与化学[M]. 北京: 科学出版社, 2012: 3-4.
[2] 李国英. 胶原化学[M]. 北京: 中国轻工业出版社, 2013: 6.
[3] 蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 13-14.
[4] RAMACHANDRAN G N, KARTHA G. Structure of collagen[J]. Nature, 1954, 174: 269-270.
[5] 李国英. 胶原的生物学性质[J]. 中国皮革, 2002(21): 20-21.
[6] 李国英, 张忠楷, 雷苏, 等. 胶原、明胶和水解胶原蛋白的性能差异[J].四川大学学报: 工程科学版, 20 05, 37(4): 54-58.
[7] PLOTKOWSKI M C, CHEVILLARD M, PI ERROT D, et al. Differential adhesion of Pseudomon as aeruginosa to human respiratory epithelial cells in prima ry culture[J]. Journal of Clinical Investigation, 1991, 87: 2018-2028.
[8] JUS S, KOKOL V, GUEBITZ G M. Tyrosinase-catalysed coating of w ool fibres with different protein-based biomaterials[J]. Journal of Biomaterials Science, 200 9, 20(2): 253-269.
[9] ABDILLAHI S M, BALVANOVIĆ S, BAUMGARTEN M, et al. Collagen VI encodes antimicrobial activity: novel innate host defense properties of the extracellular matrix[J]. Journal of Innate Immunity, 2011, 4(4): 371-376.
[10] GOMEZ-GUILLEN M C, LOPEZ-CABALLERO M E, LOPEZ de LACEY A, et al. Sea by-products as real material: new ways of application[M]. Kerala, India: Transworld Res earch Network Signpost, 2010: 89-115.
[11] KEMPKA A P, SANTIN L, BETIOLO C, et al. Develpment of coating using partially hydrolyzed collagen, mannital and applied on strawberry[J]. Boletim do Centro de Pesquisa de Proc essamento de Alimentos, 2012, 30: 53-64.
[12] di BERNARDINI R, HARNEDY P, BOLTON D, et al. Antioxidant and antimicrobial peptidic hydrolysates from muscle protein sources and by-products[J]. Food Ch emistry, 2011, 124(4): 1296-1307.
[13] WIEPRECHT T, DATHE M, EPAND R M, et al. Influence of the angle subtended by the positively charged helix face on the membrane activity of amphipathic, antibacterial peptides[J]. Bioc hemistry, 1997, 36: 12869-12880.
[14] MOLINERO J, JULIA M R, ERRA P, et al. Synthesis and properties on Nα-lauroyl-L-arginine dipeptides from collagen-lauroyl-L-arginine dipeptides from collag en[J]. Journal of the American Oil Chemists’Society, 1988, 65(6): 975-978.
[15] 李春楠, 孙佳明, 张辉. 象皮和拟替代品猪皮、鱼鳞中胶原及其抗氧化活性研究[J]. 中国中药杂志, 2011, 36(16): 2183-2186.
[16] JEEVITHAN E, BAO Bin, BU Yongshi, et al. Type II collagen and gelatin from Silvertip Shark (Carcharhinus albimarginatus) cartilage: isolation, purifi cation, physicochemical and antioxidant properties[J]. Marine Drugs, 2014, 12(7): 3852-3873.
[17] STADTMAN E R, LEVINE R L. Free radical-mediated o xidation of free amino acids and amino acid residues in proteins[J]. Amino Acids, 2003, 25(3/4): 207-2 18.
[18] ELIAS J R, KELLERBY S, DECKER A E. Antioxidant activity of proteins and peptides[J]. Critical Reviews in Food Science and Nutrition, 2008, 48: 430-441.
[19] DING Jinfeng, LI Yanyan, XU Jiajie, et al. Study on effect of jellyfi sh collagen h ydrolysate on anti-fatigue and anti-oxidation[J]. Food Hydrocolloids, 2011, 25: 1350-1353.
[20] MENDIS E, RAJAPAKSE N, BYUN H, et al. Investigation of jumbo squ id (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J]. Life Sciences, 2005, 77: 2166-2178.
[21] KIM S K, MENDIS E. Bioactive c ompounds from marine processing byproducts: a review[J]. Food Research International, 2006, 39: 383-393.
[22] 杨芳宁. 猪皮胶原蛋白抗氧化肽的制备与活性研究[D]. 郑州: 河南科技大学, 2012.
[23] KIM S K, BYUN H G, PARK P J, et al. Angiotensin I converting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 2992-2997.
[24] K IM S K, BYUN H G, NAM K, et al. Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 1984-1989.
[25] KIM S K, KIM Y T, BYUN H G, et al. Purification and characterization of antioxidative peptides from bovine skin[J]. Journal of Biochemistry and Molecular Biology, 2001, 34: 214-219.
[26] MENDIS E, RAJAPA KSE N, KIM S K. Antioxidant properties of a radicals scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 581-587.
[27] A LEMAN A, GIMENEZ B, PEREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptides sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry, 2011, 125: 334-341.
[28] DÁVALOS A, MIGUEL M, BARTOLOME B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67: 1939-1944.
[29] LI Bo, CHEN Feng, WANG Xi, et al. Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry, 2007, 1 02: 1135-1143.
[30] RAJAPAKSE N, MENDIS E, BYUN H G, et al. Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J]. Jo urnal of Nutritional Biochemistry, 2005, 16: 562-569.
[31] YANG J I, HO H Y, CHU Y J, et al. Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia (Rachycentron canadum) skin[J]. Food Chemistry, 2008, 110: 128-136.
[32] YANG Hongshun, WANG Yifen, ZHOU Peng, et al. Effects of alkaline and acid pretreatment on the physical properties and nanostructures of the gelatin from channel catfish skins[J]. Food Hydrocolloids, 2008, 22: 1541-1550.
[3 3] LI Zongrui, WANG Bin, CHI Changfeng, et al. Infl uence of average molecular weight on antioxidant and functional properties of cartilage collagen hydrolysates from Sphyrna lewini, Dasyatis akjei and Raja porosa[J]. Food Research International, 2013, 51: 283-293.
[34] CHI Changfeng, CAO Zihao, WANG Bin, et al. Antioxidant and functional properties of collagen hydrolysates from Spanish mackerel skin as infl uenced by average molecular weight[J]. Molecules, 2014, 19(8): 11211-11230.
[35] QIAN Z J, JUNG W K, KIM S K. Free radical scavenging activity of a novel antioxidative peptide purifi ed from hydrolysate of bullfrog skin, Rana catesbeiana Shaw[J]. Bioresource Technology, 2008, 99: 1690-1698.
[36] ONDETTI M A, CUSHMAN D W. Design of specific inhibitors of angio tensin-converting enzyme-new class of orally active antihypertensive agents[J]. Science, 1977, 196: 441-444.
[37] CHEN Qihe, XUAN Guodo ng, FU Mingliang, et al. Effect of angiotensin I-converting enzyme inhibitory peptide from rice dregs protein on antihypertensive activity in spontaneously hypertensive rats[J]. Asian Pacifi c Journal of Clinical Nu trition, 2009, 16: 281-285.
[38] ATKINSON A B, ROBERTSON J I S. Captopril in the treatment of clinical hypertension and cardiac failure[J]. Lancet, 1979, 2: 836-839.
[39] AHHMED A M, MUGURUMA M. A review of meat protein hydrolysates and hypertension[J]. Meat Science, 2010, 86: 110-118.
[40] JANG A, LEE M. Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Science, 2005, 69: 653-661.
[41] ICHIMURA T, YAMANAKA A, OTSUKA A, et al. Antihypertensive effect of enzymatic hydrolysate of collagen and Gly-Pro in spontaneousl y hypertensive rats[J]. Bioscience, Biotechnology and Biochemistry, 2009, 73: 2317-2319.
[42] PARK C H, KIM H J, KANG K T, et al. Fractionation and angiotensin I-converting enzyme (ACE) inhibitory activity of gelatin hydrolysates from by-products of Alaska pollock surimi[J]. Fisheries and Aquatic Science, 2009, 12: 79-85.
[43] CHENG Fuyuan, WAN Tienchun, LIU Yutse, et al. Determination of angiotensin-I converting enzyme inhibitory peptides in chicken leg bone protein hydrolysate with alcalase[J]. Animal Science Journal, 2009, 80(1): 91-97.
[44] FITZGERALD R, MURRAY B A. Hypotensive peptides from milk proteins[J]. Journal of Nutrition, 2004, 134: 980-988.
[45] SAIGA A, IWAI K, HAYAKAWA T, et al. Angiotensin I-converting enzyme-inhibito ry peptides obtained from chicken collagen hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 9586-9591.
[46] FARIA M, da COSTA E L, GONTIJO J A R, et al. Evaluation of the hypotensive potential of bovin e and porcine collagen hydrolysates[J]. Journal of Medicinal Food, 2008, 11: 560-567.
[47] ONDETTI M A, CUSHMAN D W. Enzymes of the renin-angiotensin system and their inhibitors[J]. Annual Review of Biochemistry, 1982, 51: 283-308.
[48] MURRAY B A, FITZGERALD R. Angiotensin converting enzyme inhibitory peptides derived f rom food proteins: biochemistry, bioactivity and production[J]. Current Pharmaceutical Design, 2007, 13: 773-791.
[49] CONTRETAS M, CARRON R, MONTERO M J, et al. Novel caseinderived pe ptides with antihypertensive activity[J]. International Dairy Journal, 2009, 19: 566-573.
[50] SHIMIZU K, SATO M, ZHANG Y, et al. The bioavailable octapeptide Gly-Ala-Hyp-Gly-Leu-Hyp-Gly-Pro stimulates nitric oxide synthesis in vascular endothelial cells[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 6960-6965.
[51] GOMEZ-GUILLEN M C, GIM ENEZ B, LOPEZ-CABALLERO M E, et al. Functional and bioactive properties of collagen and gelatin from alternative sources: a review[J]. Food Hydrocolloids, 2011, 25: 1813-1827.
[52] ZHANG Yuhao, OLSEN K, GROSSI A, et al. Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation of ACE-inhibitory peptides[J]. Food Chemistry, 2013, 141: 2343-2354.
[53] KONG Qing, CHEN Fe ng, WANG Xi. Optimization of conditions for enzymatic production of ACE inhibitory peptides from collagen[J]. Food and Bioprocess Technology, 2011, 4(7): 1205-1211.
[54] ZHUANG Yongliang, SUN Liping, LI Bafang. Production of the angiotensin-I-converting enzyme (ACE)-inhibitory peptide from hydrolysates of jellyfish (Rhopilema esculentum) collagen[J]. Food and Bioprocess Technology, 2010, 5(5): 1-8.
Bioactive Functions of Collagen Hydrolysates
DUAN Lian, DU Zheng, ZHANG Desheng*(College of Textiles and Garments, Southwest University, Chongqing 400715, China)
As the most abundant protein in animals, collagen and its hydrolysates are biocompatible and biofunctional due to the unique triple-helix and amino acid sequence, and have been widely used in many fi elds. In this article, we have summarized the bioactive functions of collagen hydrolysates according to the latest investigations at home and abroad, including antimicrobial propertie s, antioxidant activity and antihypertensive activity. The development of collagen industry should not be limited to medicinal materials and tissue engineering. Food and health products based on collagen and its hydrolysates should also be developed.
collagen hydrolysates; antimicrobial properties; antioxidant activity; antihypertensive activity
TS209
A
1002-6630(2015)19-0292-05
10.7506/spkx1002-6630-201519053
2014-12-08
中央高校基本科研业务费专项资金一般项目(2120130635);西南大学博士启动项目(SWU114092)
段炼(1985-),男,讲师,博士,研究方向为蛋白质化学及资源化利用。E-mail:duan19850420@163.com
*通信作者:张德胜(1986-),男,助教,硕士,研究方向为蛋白质化学及资源化利用。E-mail:2695117804@qq.com

