L-缬氨酸代谢工程研究进展
苏跃稳,张 昕,王 健(吉林大学生物与农业工程学院,吉林长春130022)
L-缬氨酸代谢工程研究进展
苏跃稳,张昕,王健
(吉林大学生物与农业工程学院,吉林长春130022)
摘要:L-缬氨酸属于支链氨基酸,是人体八种必需氨基酸之一,广泛用于食品、医药、饲料、化妆品等领域。由于其含有特殊的生理功能,市场需求较大,使得L-缬氨酸的生产备受关注。代谢工程有着理性思维的设计,在氨基酸生产中得到广泛应用。主要阐述了L-缬氨酸生物合成途径中的关键酶及其代谢调控,综述了L-缬氨酸合成的代谢工程研究现状,并对利用代谢工程原理进行L-缬氨酸生产菌的理性设计提出展望。
关键词:L-缬氨酸;发酵;生物合成;途径工程
L-缬氨酸是生命体不可或缺的必需氨基酸,在人体代谢中占重要地位。L-缬氨酸可作为人类和动物的营养补充产品,也可作为药物、化妆品的保湿成分、抗生素以及除草剂[1-3]。此外,L-缬氨酸还可作为饲料添加剂,能改善免疫机能[4],2013年对其需求量已经增至2 500 t[5]。目前,大多数企业采用对生产菌进行诱变改造菌种,然而由于菌种遗传背景不明,产量较难提高。研究者运用代谢工程技术构建L-缬氨酸的生产菌,明显提高了其产量。
1 缬氨酸合成途径中涉及的关键酶
谷氨酸棒状杆菌的生物合成途径如图1所示。L-缬氨酸合成的重要前体是丙酮酸,经四步反应合成缬氨酸。L-缬氨酸合成受多个关键酶控制,其中大部分L-缬氨酸合成酶基因已经得到克隆:乙酰乳酸合成酶(AHAS,由ilvBN基因编码),乙酰羟酸异构还原酶(AHAIR,由ilvC基因编码),二羟酸脱水酶(DHAD,由ilvD基因编码),支链氨基酸转氨酶(TA,由ilvE基因编码)。同时胞内的L-缬氨酸由转运蛋白复合体BrnFE(由brnFE基因编码)运至细胞外[6-11]。
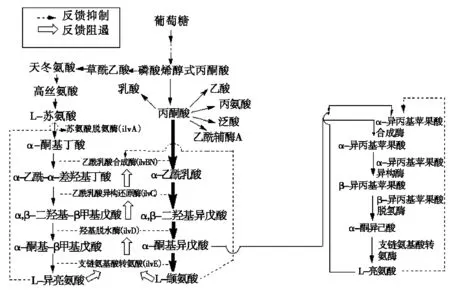
图1 在谷氨酸棒状杆菌中L-缬氨酸的生物合成途径
2 L-缬氨酸合成的代谢工程研究
通过理性设计代谢工程的育种策略,利用代谢工程手段对代谢网络进行有目的的修饰,设计菌株的分解代谢、合成代谢的多步级联反应,这样能最大限度提高L-缬氨酸的产量,并减少副产物的生成,从而避免诱变育种可能对菌体产生的不良影响。
2.1 L-缬氨酸中心代谢途径
对谷氨酸棒状杆菌的生物合成分析表明,菌体摄取葡萄糖经转化产生L-缬氨酸主要经历糖酵解途径(EMP)、磷酸戊糖途径(HMP)、三羧酸循环途径(TCA)等。HMP途径主要提供还原力NADPH,作用于L-缬氨酸合成的乙酰羟基酸异构还原酶的催化反应,是L-缬氨酸合成的关键途径。由于在发酵过程中ATP大部分是以热能形式消耗掉的,而ATP的合成需要NADPH,从而造成NADPH的流失,所以从遗传改造和发酵方面控制,降低TCA循环途径的代谢流,有效提高L-缬氨酸的产量。
2.2增加前体物质的供应
丙酮酸的流向较为广泛,主要有三羧酸循环、L-缬氨酸、L-丙氨酸、L-亮氨酸、L-异亮氨酸等的合成,还有一些有机酸,如乳酸、乙酸等。丙酮酸是L-缬氨酸合成的重要前体物质,降低丙酮酸的旁路消耗,可以提高L-缬氨酸的产量[12]。根据代谢分析模拟敲除aceF基因和mdh基因,灭活丙酮酸脱氢酶复合体和苹果酸脱氢酶,从而减少丙酮酸流失,使其更多地流向L-缬氨酸的合成途径,提高L-缬氨酸的产量。目前研究多集中于优化其细胞内的可用性,一种是敲除多个D-泛酸钙的合成基因panBC,结果造成辅酶A限制丙酮酸脱氢酶反应的有效性,从而使丙酮酸浓度提高30倍,最终提高L-缬氨酸产量。对谷氨酸棒状菌ΔilvAΔpanBC(pJC4ilvBNCD)进行代谢控制分析,根据动态细胞代谢数据建造动力学路径模型,推测丙酮酸供应仍受限制,提高丙酮酸产量以及L-缬氨酸途径基因需要过表达,才能达到较为平衡高产。在L-缬氨酸合成途径中二羟酸脱水酶反应最快,而乙酰羟酸异构还原酶、支链氨基酸转氨酶和L-缬氨酸分泌反应最慢。另外,由于敲除aceE基因,降低编码E1p亚基酶复合物的含量,造成丙酮酸脱氢酶不足,最终使丙酮酸浓度可达17 mmol/L。同时敲除PQO基因(编码丙酮酸/醌氧化还原酶),以乙酸和葡萄糖为碳源,该丙酮酸脱氢酶缺陷型生产菌L-缬氨酸产量可达26.4 g/L,产物最大得率为0.52 mol/mol(L-缬氨酸/葡萄糖)。Kyowa等[13]通过选育,筛出对丙酮酸敏感菌株,从而降低丙酮酸脱氢酶的活性,提高丙酮酸的积累。Blombach等[14]敲除三羧酸循环的aceE基因,从而提高丙酮酸的产量,分批发酵L-缬氨酸产量高达48 g/L。Hou等[15]研究发现大多数L-缬氨酸生产菌迄今还分泌L-丙氨酸高达7.5 g/L。L-丙氨酸跟L-缬氨酸的化学性质相似,这就增加分离纯化的难度和成本。在谷氨酸棒状杆菌中转氨酶AlaT和AvtA是L-丙氨酸的合成酶。谷氨酸棒状杆菌ΔilvAΔpanBC(pJC1ilvBNCD)灭活AlaT基因,可以减少80%的L-丙氨酸合成,不过菌体生长速率也下降50%。
2.3终端代谢途径
在谷氨酸棒状杆菌中L-缬氨酸合成与L-异亮氨酸合成共用AHAS、AHAIR、DHAD和TA这四种酶,主途径对AHAS的亲和性小于L-异亮氨酸途径。这导致丙酮酸优先被利用于合成L-异亮氨酸,对合成L-缬氨酸是不利的[16-17]。
2.3.1过表达主途径基因
乙酰乳酸合成酶包括催化亚基和调节亚基,其中由ilvN编码的小亚基具有调节功能,由ilvB编码的大亚基具有催化功能[18]。在大肠杆菌中存在三种同工酶,AHAS I、AHAS II、AHAS III,而AHAS I的活性最高,其基因ilvBN的启动子具有独特调控途径,是降解物阻遏系统中的cAMP-依赖性蛋白诱导的唯一操纵子,与ilvC基因形成的操纵子是过表达L-缬氨酸的关键[19]。Tobias Bartek等[20]将含基因ilvBNCDE的质粒ΔaceE pJC4ilvBNCE导入缺陷丙酮酸脱氢酶的谷氨酸棒状杆菌中,其中ilvBN基因编码乙酰乳酸合酶过表达,有效转化丙酮酸,减少丙氨酸产生,增加L-缬氨酸产量,有效减少α-酮异戊酸。缬氨酸产量为12.3 g/L,而丙酮酸降为0.09 g/L,α-酮异戊酸降为0.24 g/L。Hoechst等[21]将基因ilvE克隆到pBR322质粒中,使重组质粒导入到大肠杆菌DG30中,构建的工程菌能过表达支链转移酶,可以提高L-缬氨酸的产量。
2.3.2解除调节反馈抑制
乙酰乳酸合成酶受到三种氨基酸的抑制,依次为L-缬氨酸、L-亮氨酸、L-异亮氨酸,其50%抑制浓度分别为0.9、3.1和6 mmol/L[22]。L-缬氨酸合成的第一限速酶是乙酰乳酸合成酶,受L-缬氨酸反馈抑制,也受末端产物多阶阻遏。将乙酰乳酸合成酶调节亚基的Gly-Ile-Ile突变为Asp-Asp-Phe完全解除支链氨基酸对乙酰乳酸合成酶的反馈抑制。可以通过敲除ilvA基因和leuA基因来解除L-异亮氨酸和L-亮氨酸对乙酰乳酸合成酶的抑制,还可以弱化其启动子,降低这两种氨基酸的产量,形成渗透性缺陷型[23]。Holatkod等[24]增强ilvD和ilvE基因的启动子活性,降低ilvA和leuA基因的启动子活性,发酵48 h摇瓶培养积累15.9 g/L。通过对ilvGMEDA操纵子进行基因重组修饰,将ilv操纵子敲除破坏或敲除操纵子中的ilvE基因,减弱苏氨酸脱氨酶活性,减弱旁路代谢流,进而提高L-缬氨酸产量。由于ilvBNC的表达受到转录弱化,而对于转录弱化来说,前导肽的翻译是比较重要的,只是ilvBNC的转录起点和翻译起点相距仅有1 bp,没有核糖体结合点,可以通过改变前导序列缬氨酸的密码子,进而解除弱化。此外,短导肽的转录和ilvBNC的转录还受到2-酮丁酸的诱导,说明ilvBNC的表达不是独立机制,还受其他物质调控。
2.4提高NADPH的策略
NADPH在合成L-缬氨酸中扮演重要角色。每合成1 mol L-缬氨酸需要消耗1 mol葡萄糖和2 mol NADPH。NADPH在合成L-缬氨酸中消耗占总量的39.78%,其产生途径主要是HMP途径,应改变NADPH代谢流,使NADPH更多地流向L-缬氨酸合成途径。NADPH与NADH存在动态平衡,每合成1 mol NADH需要消耗2 mol NADPH,从而造成NADPH流失。而NADPH作用于乙酰羟酸异构还原酶和支链氨基酸转氨酶的催化反应中,提高其催化效率能提高L-缬氨酸的合成。NADH的合成主要在糖酵解途径,关键酶磷酸葡萄糖异构酶(PGI,由pji基因编码)催化合成。敲除该基因可以使葡萄糖更多流向HMP途径,从而提高NADPH产量。另外,通过过表达膜结合转氢酶可促进NADH向NADPH转化[25]。根据代谢网络分析,不同的模式下,改变NADPH的反应通路,产物最大得率由0.5 mol/mol(L-缬氨酸/葡萄糖)提高到1 mol/mol(L-缬氨酸/葡萄糖)。NADPH由异柠檬酸脱氢酶提供,产物最大得率仅为0.5 mol/mol(L-缬氨酸/葡萄糖)。碳通量的重新定向,明显提高磷酸戊糖途径,产生更多NADPH,产物最大得率提高到0.86 mol/mol(L-缬氨酸/葡萄糖),从而减少碳源的浪费。在这条路线上,丙酮酸羧化酶和苹果酸脱氢酶的催化下将NADH的氢传递到NADPH[26]。
2.5 L-缬氨酸的转运
在谷氨酸棒状杆菌中将L-缬氨酸输送到胞内是通过brnQ基因编码的转运蛋白BrnQ完成的,然后通过转运蛋白复合体BrnFE分泌到胞外。如果L-缬氨酸不及时地排出体外,则造成对L-缬氨酸合成途径关键酶受到抑制,同时弱化编码基因的转录,最终造成L-缬氨酸合成减少。研究表明全局调控因子Lrp可结合在lrp和brnF之间的DNA上,能刺激BrnFE的表达[27]。
2.6代谢流的全局调控
传统上代谢工程主要是根据代谢调控机制采用一些常规手段,由基因缺失、基因突变、关键酶表达以及基因重组等来构建新的合成途径。由于L-缬氨酸途径只涉及一种或多种基因的表达或调控,往往只能实现局部途径最优化,很难实现细胞全局最优化。因此从全局分析,综合考察基因的调控与表达、酶活性的调节和细胞内代谢流,同时还涉及细胞能量、辅酶因子、前体等变化的过程,将高通量组学分析技术和构建基因组水平的代谢网络等现代生物技术应用到全局系统代谢工程上,进而对整个合成途径进行全局优化。Park等[28]用代谢网络结合转录组分析对基因进行模拟敲除,构建出高产L-缬氨酸的工程菌。Magnus等[29]将谷氨酸棒状杆菌ΔilvAΔpanBC (pJC4ilvBNCD)根据动态胞内代谢数据,进行代谢控制分析和应用动力学L-缬氨酸路径模型,该模型推测出丙酮酸供应仍是受限的,需要用L-缬氨酸途径的基因过表达进行平衡,经预测DHAD是各反应中最快的,在L-缬氨酸分泌途经序列中,AHAIR、TA和L-缬氨酸排出为反应最慢的。Hasegawa等[30]敲除乳酸脱氢酶基因,过表达关键酶基因ilvBN、ilvC、ilvD以及ilvE,构建工程谷氨酸棒状杆菌,并进行发酵工艺优化,发酵48 h时L-缬氨酸产量达到227 g/L,是目前最高水平。Park等[31]采用代谢工程改造L-缬氨酸生产菌,分析其代谢网络定点敲除基因ilvA、panB、leuA、lacI,解除了其合成途径中反馈抑制,阻断其他途径的消耗,除去发酵副产物,糖酸转化率提高10倍(为0.22 g/g)。其中用转录组分析双重减少lrp基因的表达,lrp基因为转录调节因子,能有效激活ilvIH的表达。因此,将lrp基因导入质粒pTrc184并过表达,较原菌株L-缬氨酸产量可提高22%。另外,过表达ygaZH操纵子,可使E. coli Val(pKBRilvBNCED)(pTrc184ygaZHlrp)产量提高7.61 g/L。
3 展望
代谢工程通过系统分析L-缬氨酸代谢网络,找出关键节点,用特定手段进行改进,对途经进行修饰。代谢工程目的性强,最大程度提高L-缬氨酸产量,减小副产物的产量,也为下游分离提纯降低成本。未来对L-缬氨酸生产菌进行基因水平、蛋白质水平等多层次分析,对L-缬氨酸生产菌所有节点进行全局分析,再结合转录组学、蛋白组学、代谢组学以及计算机建模等现代生物技术进行改良,一定会通过理性设计构建出稳定性好、副产物少,更适合工业化生产的L-缬氨酸生产菌株。
参考文献:
[1]KARAU A,GRAYSON I. Amino acids in human and animal nutrition[J]. Advances in biochemical engineering,2014,143:189-228.
[2]TAKUMI K,NAMIKI I,MICHAEL R. et al. Branched-chain amino acids as pharmacological nutrients in chronic liver disease[J]. Hepatology,2011,54(3):1063-1070.
[3]CHIPMAN D M,DUGGLEBY R G,TITTMANN K. Mechanisms of acetohydroxyacid synthases[J]. Chemical biology,2005,9(5):475-481.
[4]陈熠,彭艺,贺建华,等.添加缬氨酸对泌乳母猪血清和乳中生化免疫指标及激素水平的影响[J].中国饲料,2009(17):15-20.
[5]张伟国,郭燕凤.支链氨基酸生物合成及其代谢工程育种研究进展[J].食品与生物技术学报,2014,33(2):120-126.
[6]LEYVAL D,UY D,DELAUNAY S,et al. Characterisation of the enzyme activities involved in the valine biosynthetic pathway in a valine producing strain of Corynebacterium glutamicum[J]. Journal of biotechnology,2003,104(1/3):241-252.
[7]KEILHAUER C,EGGELING L,SAHM H. Isoleucine synthesis in Corynebacterium glutamicum:molecular analysis of the ilvB-ilvN-ilvC operon[J]. Journal of bacteriology,1993,175(17):5595-5603.
[8]MCHARDY A C,TAUCH A,RÜCKERT C,et al. Genome-based analysis of biosynthetic aminotransferase genes of Corynebacterium glutamicum[J]. Journal of biotechnology,2003,104(1):229-240.
[9]张克旭,陈宁.代谢控制发酵[M].北京:中国轻工业出版社,2005.
[10]孙丽萍,吴海珍,张惠展.第三代基因工程—代谢工程[J].药物生物技术,2000,7(2):71-76.
[11]OLDIGES M,EIKMANNS B J,BLOMBACH B. Application of metabolic engineering for the biotechnological production of L-valine[J]. Applied microbiology and biotechnology,2014,98 (13):5859-5870.
[12]BLOMBACH B,SCHREINER M E,BARTEK T,et al. Corynebacterium glutamicum tailored for high-yield L-valine production[J]. Applied microbiology and biotechnology,2008,79(3):471-479.
[13]KATSUMATA R,HASHIMOTO S. Process for producing L-valine:US5521074[P]. 1996-5-28.
[14]BLOMBACH B,SCHREINER M E,HOLáTKO J,et al. LValineproductionwithpyruvatedehydrogenasecomplex-deficient Corynebacterium glutamicum[J]. Applied and environmental microbiology,2007,73(7):2079-2084.
[15]HOU Xiaohu,GE Xiangyang,WU Di,et al. Improvement of L-valine production at high temperature in Brevibacterium flavum by overexpressing ilvEBN(r)C genes[J]. Journal of industrial microbiology,2012,39(1):63-72.
[16]OLDIGES M,EIKMANNS B J,BLOMBACH B. Application of metabolic engineering for the biotechnological production of L-valine[J]. Applied microbiology and biotechnology,2014,98 (13):5859-5870.
[17]LEE Y T,DUGGLEBY R G. Identification of the regulatory subunit of Arabidopsis thaliana acetohydroxyacid synthase and reconstitution with its catalytic subunit[J]. Biochemistry,2001,40(23):6836-6844.
[18]BLOMBACH B,SCHREINER M E,HOLáTKO J,et al. LValineproductionwithpyruvatedehydrogenasecomplex-deficient Corynebacterium glutamicum[J]. Applied and environmental microbiology,2007,73(7):2079-2084.
[19]BLOMBACH B,ARNDT A,AUCHTER M,et al. L-Valine production during growth of pyruvate dehydrogenase complexdeficient Corynebacterium glutamicum in the presence of ethanol or by inactivation of the transcriptional regulator SugR [J]. Applied and environmental microbiology,2009,75(4):1197-1200.
[20]BARTEK T,ZÖNNCHEN E,KLEIN B,et al. Analysing overexpression of L -valine biosynthesis genes in pyruvate -dehydro ge nase - deficient Corynebacterium glutamicum[J]. Journal of industrial microbiology and biotechnology,2010,37 (3):263-270.
[21]HOECHST.New extrachromosomalelement-containingaliphatict ransminnase gene from Ascherichia coil;alanine,valine,and isoleucine over production:EP265852[P]. 1986-10-29.
[22]BARTEK T,ZÖNNCHEN E,KLEIN B,et al. Analysing overexpression of L -valine biosynthesis genes in pyruvate -dehydrogenase-deficient Corynebacterium glutamicum[J]. Journal of industrial microbiology and biotechnology,2010,37(3):263-270.
[23]LEYVAL D,UY D,DELAUNAY S,et al. Characterisation of the enzyme activities involved in the valine biosynthetic pathway in a valine -producing strain of Corynebacterium glutamicum[J]. Journal of biotechnology,2003,104(1):241-252.
[24]HOLÁTKO J,ELIŠÁKOVÁ V,PROUZA M,et al. Metabolic engineering of the L - valine biosynthesis pathway in Corynebacterium glutamicum using promoter activity modulation[J]. Journal of biotechnology,2009,139(3):203-210.
[25]BARTEK T,BLOMBACH B,LANG S,et al. Comparative13C metabolic flux analysis of pyruvate dehydrogenase complexdeficient,L-valine-producing Corynebacterium glutamicum[J]. Applied and environmental microbiology,2011,77(18):6644-6652.
[26]BARTEK T,BLOMBACH B,ZÖNNCHEN E,et al. Importance of NADPH supply for improved L - valine formation in Corynebacterium glutamicum[J]. Biotechnology progress,2010,26(2):361-371.
[27]LANGE C,MUSTAFI N,FRUNZKE J,et al. Lrp of Corynebacterium glutamicum controls expression of the brnFE operon encoding the export system for L-methionine and branched-chain amino acids[J]. Journal of biotechnology,2012,158(4):231-241.
[28]PARK J H,LEE K H,KIM T Y,et al. Metabolic engineering of Escherichia coli for the production of L-valine based on transcriptome analysis and in silico gene knockout simulation [J]. Proceedings of the national academy of sciences,2007,104 (19):7797-7802.
[29]MAGNUS J B,OLDIGES M,TAKORS R. The identification of enzyme targets for the optimization of a valine producing Corynebacterium glutamicum strain using a kinetic model[J]. Biotechnology progress,2009,25(3):754-762.
[30]HASEGAWA S,UEMATSU K,NATSUMA Y,et al. Improvement of the redox balance increases L-valine production by Corynebacterium glutamicum under oxygen deprivation conditions[J]. Applied and environmental microbiology,2012,78(3):865-875. [31]PARK J H,JANG Y S,LEE J W,et al. Escherichia coli W as a new platform strain for the enhanced production of LValine by systems metabolic engineering[J]. Biotechnology and bioengineering,2011,108(5):1140-1147.
(责任编辑:朱小惠)
Advances in metabolic engineering for L-valine production
SU Yuewen,ZHANG Xin,WANG Jian
(College of Biological and Agricultural Engineering,Jilin University,Changchun 130022,China)
Abstract:As one of eight essential amino acids of human,L-valine belongs to branched-chain amino acid and is widely used in food,medicine,feed,cosmetics and other fields. Because of its special physiological functions,traditional fermentation cannot meet the demand of market,which makes L-valine production a major concern. Rational design of metabolic pathway has been widely used in amino acid production. This review focuses on the key enzymes and their metabolic regulation in L-valine biosynthetic pathway. Moreover,the related metabolic regulation strategy and research status of metabolic engineering of L-valine were summarized. Finally,the rational design of L-valine producing strain was discussed.
Keywords:L-valine;fermentation;biosynthetic pathway;metabolic engineering
作者简介:苏跃稳(1990—),男,山东菏泽人,硕士研究生,研究方向为氨基酸代谢工程,E-mail:suyw0820@126.com.
收稿日期:2015-12-20
中图分类号:TQ92
文献标志码:A
文章编号:1674-2214(2016)02-0118-05