超声酶解制备牡丹籽降血糖肽的响应面优化研究
颜 辉,蔡 豪,贾俊强,江明珠,吴琼英
(江苏科技大学生物技术学院,江苏镇江 212018)
超声酶解制备牡丹籽降血糖肽的响应面优化研究
颜辉,蔡豪,贾俊强,江明珠,吴琼英
(江苏科技大学生物技术学院,江苏镇江 212018)
为获得一种新型的降血糖肽,应用超声辅助酶法制备牡丹籽蛋白源降血糖肽,并通过单因素和响应面实验进行工艺优化。对酶解的7个因素进行筛选,确定5个主要因素进行响应面实验设计优化。最优工艺参数为:温度37.3 ℃,时间21.68 min,超声波功率60.52 W(体积600 cm3),pH8.01,加酶量10202 U/g,2%蛋白浓度,超声波频率28 kHz,此条件下实际抑制率达到40.25%;比相同条件未使用超声的抑制率提高了14.9%。本研究不仅为超声辅助加速制备牡丹籽降血糖肽的研究和实际应用提供基础,也为牡丹籽蛋白的综合利用提供新的方向。
超声波,牡丹籽蛋白,α-葡萄糖苷酶抑制率,酶解反应,响应面法
糖尿病(Diabetes Mellitus,DM)是一种内分泌代谢疾病,慢性高血糖是其主要发病症状。长期高血糖可引起高血压、血管硬化等并发症,进而导致心、脑、肾等重要器官的病变,严重者威胁生命[1]。目前,大部分糖尿病患者为Ⅱ型糖尿病,其中α-葡萄糖苷酶抑制剂是最具临床价值的降血糖药物[2]。α-葡萄糖苷酶抑制剂能够与小肠中的α-葡萄糖苷酶的中心活性部位结合,阻抑酶活性的发挥,阻滞双糖水解为单糖,吸收时间后延,从而降低餐后血糖水平。
有学者研究表明,多肽可以作为一类α-葡萄糖苷酶抑制剂,如山杏、丝素、杂色蛤、蚕茧、蛋清、乳清、鱿鱼肝脏蛋白等蛋白,经过酶解,多肽均有抑制α-葡萄糖苷酶活性,有辅助降低血糖的作用[3-9]。上述蛋白存在成本较高、常规酶解速率慢的缺陷,酶解过程需要一到两个小时甚至更长时间[3-9],难以满足大规模工业生产需要,因此,如何低成本且快速获得多肽是一项亟待解决的问题。
2011年牡丹油被批准成为我国新型的食用油,油料牡丹的种植面积逐年上升,2015年已达200万亩以上[10],榨油后牡丹籽蛋白将成为一种新型的廉价蛋白原料。
超声波这种绿色的加工技术,与常规条件相比具有效率高、设备要求低、减少酶解反应时间等优点[11-12]。吴进菊、张辉、李芳等[13-15]都对超声波辅助酶解蛋白制备肽进行了研究,超声波有提高酶解速率和肽产量的作用。
本实验以牡丹籽蛋白作为原料,采用超声波辅助酶解反应制备降血糖肽,并应用响应面进行工艺优化,以期获得一种高活性牡丹籽降血糖肽及其高效制备方法。
1 材料与方法
1.1材料与仪器
ICR小鼠购自江苏大学实验动物中心(合格证编号:NO.201600100)。
实验材料与试剂:牡丹籽购自山东牡丹科技园;对硝基苯酚-α-D-吡喃葡萄糖苷(pNPG)购自阿拉丁试剂(上海)有限公司;胰蛋白酶购自国药集团化学试剂有限公司。
UV-9600紫外可见分光光度计北京北分瑞利分析仪器公司;GYZ-Y3格亚小型家用榨油机合肥格亚机械自动化有限公司;自制超声波反应器。
1.2实验方法
1.2.1牡丹籽蛋白的制备牡丹籽65 ℃烘干12 h,剥壳,65 ℃烘干8 h,GYZ-Y3格亚榨油机转速63 r/min、热榨模式进行榨油。牡丹籽粕粉碎后与蒸馏水1∶10混均,1 mol/L NaOH溶液调节pH至9.5,50 ℃超声水浴2 h,3800 r/min离心15 min,所得沉淀重复提两次,合并所得溶液,2 mol/L盐酸调节pH至4.5,3800 r/min离心20 min,沉淀冷冻干燥。
1.2.2鼠源α-葡萄糖苷酶制备脱臼处死小鼠,用0 ℃生理盐水洗去杂物,液氮研磨。将pH6.8浓度为0.05 mol/L的PBS与研磨粉混合,按照体积质量比10∶1配比,涡旋提取60 s,4 ℃8000 r/min离心15 min,取上清。
1.2.3检测方法酪氨酸标准曲线与酶活力的测定参照周景祥[16]文章中的方法;α-葡萄糖苷酶抑制率测定参照Hyun[6]的方法,有改动。
配制5 mg/mL pNPG溶液、0.05 mol/L磷酸盐缓冲液(pH6.8)、0.5 mol/L碳酸钠溶液,在试管中依次加入磷酸缓冲液、样品、α-葡萄糖苷酶液和pNPG溶液,反应体系如表1所示:
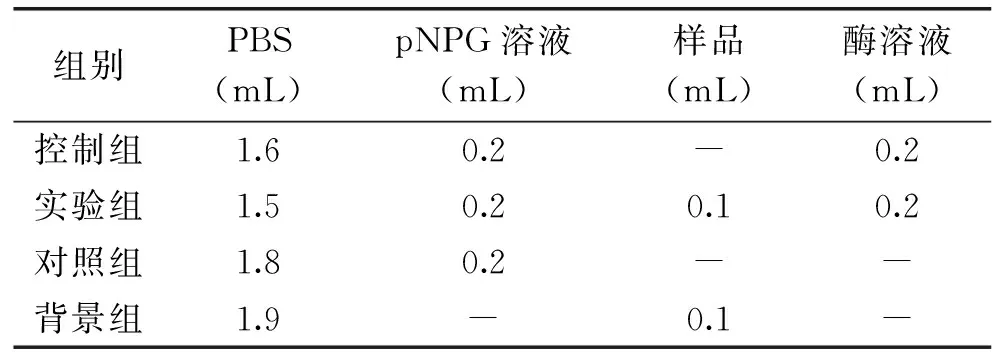
表1 α-葡萄糖苷酶抑制率检测体系组成
混合均匀,水浴37 ℃反应15 min,加入2 mL碳酸钠溶液终止反应,405 nm处检测吸光值。抑制率计算公式如下:
抑制率(%)=[A0-(A-A2)]/(A0-A1)×100
其中A0、A、A1、A2分别为控制组、实验组、对照组、背景组对应吸光值。
1.2.4单因素条件的筛选以α-葡萄糖苷酶抑制率为评价指标,在预实验的基础上选用胰蛋白酶进行实验,设定超声波体积为600 cm3,进行单因素实验。
1.2.4.1加酶量对抑制率的影响 固定底物浓度2%,温度37 ℃,时间20 min,pH8.0,超声波频率28 kHz,超声波功率60 W,考察不同加酶量(2500、5000、7500、10000、12500、15000 U/g)对抑制率的影响。
1.2.4.2底物浓度对抑制率的影响固定加酶量7500 U/g,温度37 ℃,时间20 min,pH8.0,超声波频率28 kHz,超声波功率60 W,考察不同底物浓度(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%)对抑制率的影响。
1.2.4.3温度对抑制率的影响 固定加酶量7500 U/g,底物浓度2%,时间20 min,pH8.0,超声波频率28 kHz,超声波功率60 W,考察不同温度(31、34、37、40、43 ℃)对抑制率的影响。
1.2.4.4时间对抑制率的影响固定加酶量7500 U/g,底物浓度2%,温度37 ℃,pH8.0,超声波频率28 kHz,超声波功率60 W,考察不同时间(0、10、20、30、40、50、60 min)对抑制率的影响。
1.2.4.5pH对抑制率的影响固定加酶量7500 U/g,底物浓度2%,温度37 ℃,时间20 min,超声波频率28 kHz,超声波功率60 W,考察不同pH(6.0、7.0、8.0、9.0、10.0)对抑制率的影响。
1.2.4.6超声波频率对抑制率的影响固定加酶量7500 U/g,底物浓度2%,温度37 ℃,时间20 min,pH8.0,超声波功率60 W,考察不同超声波频率(22、28、35、40 kHz,)对抑制率的影响。
1.2.4.7超声波功率对抑制率的影响固定加酶量7500 U/g,底物浓度2%,温度37 ℃,时间20 min,pH8.0,超声波频率28 kHz,考察不同超声波功率(30、60、90、120、150 W)对抑制率的影响。在单因素实验的基础上进行响应面设计,并根据响应值进行分析。所采集样品经沸水灭酶10 min,8000 r/min离心15 min取上清液检测抑制率。
1.2.5响应面实验设计在单因素实验基础上,选取加酶量(A)、时间(B)、温度(C)、pH(D)和超声功率(E)这5个因素,进行响应面实验设计,如表2所示:

表2 响应面实验的因素和水平编码
1.2.6数据分析响应面模型的建立与数据分析通过Design Expert 8.0.6软件进行计算和分析处理。
2 结果与分析
2.1单因素实验结果
2.1.1不同酶解时间检测其对鼠源性α-葡萄糖苷酶的抑制效果,如图1。

图1 不同酶解时间对抑制率的影响Fig.1 The influence of enzymatic hydrolysis time on inhibition rate
在0~20 min内,抑制率显著上升,20 min之后抑制率略有下降,这可能是继续水解切成无活性小肽[4-5,9,18],也可能是超声处理影响了胰蛋白酶酶活力,导致抑制率的变化[11],因此选择20 min作为实验的最优点。
2.1.2不同底物浓度检测结果如图2。底物浓度在0.5%~2%时,随着蛋白浓度增大,抑制率逐渐上升,2%~3.5%,尽管浓度增加,但抑制率增加极少。在蛋白质浓度较低时,随着蛋白浓度增加,抑制活性的产物多肽也在增多;蛋白浓度进一步增大,酶分子的活性中心逐渐被饱和[5,9,17],因此抑制率上升缓慢。考虑到更加经济因素,选择2%的浓度进行响应面设计。

图2 不同底物浓度对抑制率的影响Fig.2 The influence of substrate concentration on inhibition rate

图3 不同加酶量对抑制率的影响Fig.3 The influence of enzyme amount on inhibition rate

图4 不同pH对抑制率的影响Fig.4 The influence of pH on inhibition rate

图5 不同温度对抑制率的影响Fig.5 The influence of temperature on inhibition rate

图6 不同频率对抑制率的影响Fig.6 The influence of frequency on inhibition rate

图7 不同功率对抑制率的影响Fig.7 The influence of power on inhibition rate
2.1.3不同加酶量加酶量在2500~10000 U/g范围内,加酶量增多,抑制率一直显著上升,超过10000 U/g之后,抑制率有所下降。底物浓度不变时,酶分子增多,酶解加快,抑制活性产物增多;随着加酶量进一步增加,酶分子达到过饱和,只有部分酶能与蛋白结合反应,导致抑制率上升缓慢[5,9,17]。因此选择10000 U/g作为最优加酶量。
2.1.4不同pHpH在6.0~8.0之内,抑制率一直上升,大于pH8.0,抑制率呈下降趋势;pH较低或者较高时都会影响其空间结构[18],导致酶解的效果不佳[5,9],抑制率下降,这表明胰蛋白酶的最适pH在8.0左右。因此选择pH8.0作为最优pH。
2.1.5不同温度温度在31~37 ℃之内,抑制率一直不断上升,37 ℃达到顶点,超过37 ℃抑制率呈下降趋势,表明温度低于或者高于最适温度抑制率均会降低[5,9,18],因此选择37 ℃作为最优温度。
2.1.6不同频率频率在22~28 kHz之内,抑制率显著上升,28 kHz之后,抑制率呈下降趋势,不同频率超声波对胰蛋白酶活力影响导致[18],由于超声波振子频率特殊因素,选择28 kHz进行响应面设计。
2.1.7不同功率功率在30~60 W之内,抑制率一直显著上升,大于60 W,抑制率呈下降趋势;表明低功率的超声促进酶解进行,导致抑制率的增高[11],可能是酶分子的结构遭到高能量强度的超声波破坏,影响了酶的活性,进而导致抑制率下降,这是不同的功率对酶活性的影响导致抑制率的变化[11,19],因此选择60 W作为最优功率。
2.2响应面优化实验
2.2.1响应面实验结果在表2中的水平编码之下,响应面设计和结果见表3:
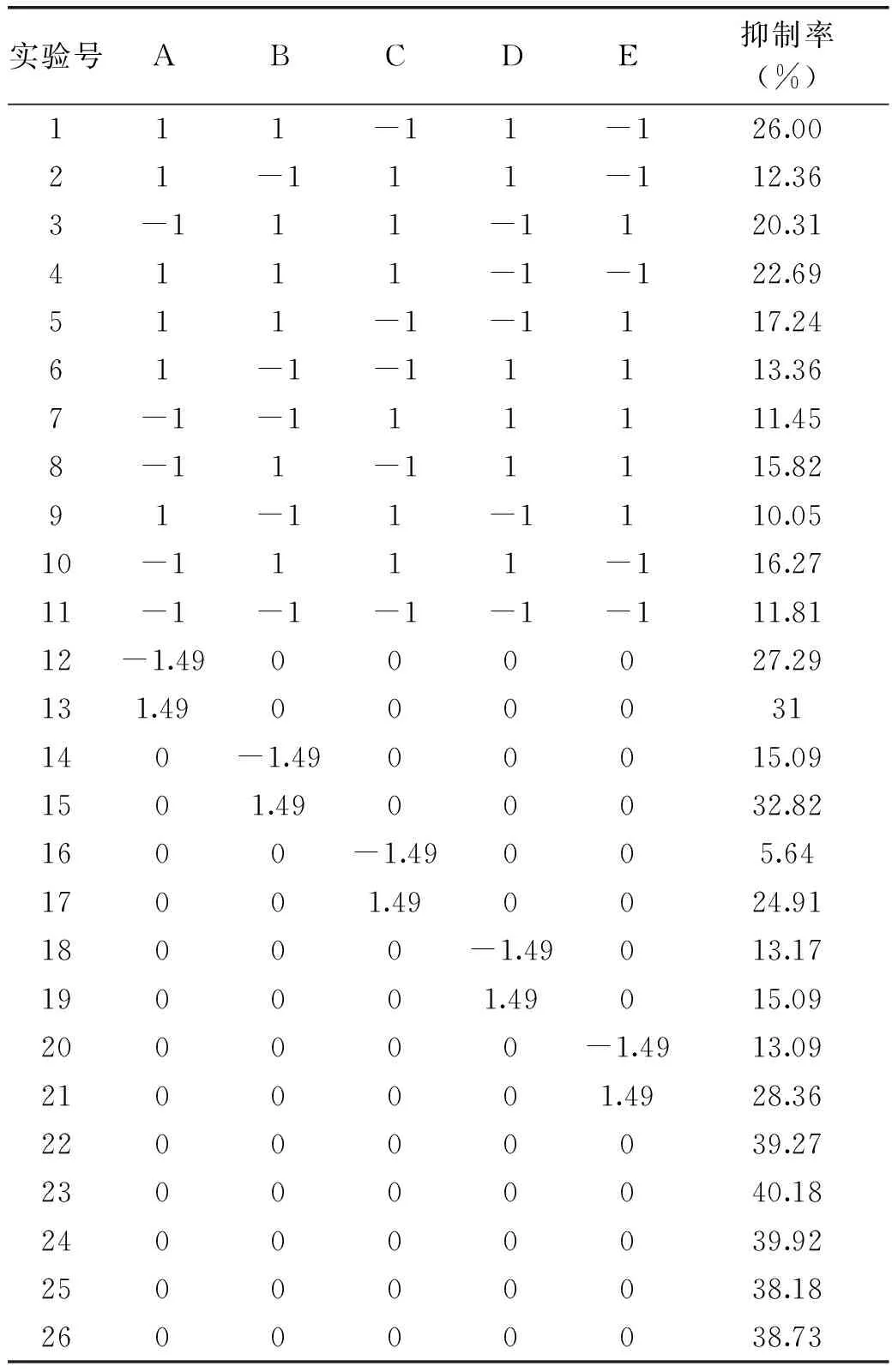
表3 响应面实验设计及其结果
2.2.2模型方差分析回归模型方差分析结果与回归方程系数见表4:

表4 回归方程模型方差分析表

Y(%)=39.03+1.04A+6.13B+6.65C+0.44D+5.31E-2.36AB-8.08AC-7.86AE-9.74BC-3.72BD-9.88BE-8.74CD-13.29CE+44.71DE-4.33A2-6.65B2-10.54C2-11.05D2-8.1E2-51.97ABC
由表4方差分析可知,一次项中B、C、E极其显著,交互项与平方项中各项均显著,各因素重要程度为[20-21]:C(温度)>B(时间)>E(功率)>A(加酶量)>D(pH)。
2.2.3响应面分析根据回归方程,各因素之间交互作用的影响,如图8所示:

图8 各因素交互作用对抑制率影响的响应曲面图Fig.8 The various interactive effects on inhibition rate of response surface plots注:a.加酶量与时间,b.加酶量与温度,c.加酶量与功率,d.时间与温度,e.时间与功率,f.温度与功率。
由图8可以直观的看出各因素交互作用对抑制率的影响,曲线密集或陡峭程度越高则表明对结果响应值得影响越大[22-23]。在本文选定的实验条件参数范围内,由图8a可知,沿着时间方向等高线比加酶量方向等高线更加密集陡峭,时间对α-葡萄糖苷酶抑制率的影响要远大于加酶量对其的影响;图8b中可以看出沿着温度方向等高线比沿着加酶量方向更加密集,坡度也更加陡峭,温度对抑制率的影响要远比加酶量大;图8c中沿着功率方向等高线要比沿加酶量密集,功率对抑制率的影响高于加酶量对其的影响;图8d中沿着温度方向等高线比时间更加密集,温度对抑制率的影响要比时间更大,图8e中时间方向等高线比功率更加密集,时间比功率影响更加显著;图8f中温度方向等高线比功率密集,温度比功率影响更加显著。
2.2.4最优工艺与验证实验经过单因素与响应曲面分析得出酶解牡丹籽蛋白最优工艺条件:温度37.3 ℃,21.68 min,60.52 W(体积600 cm3),pH8.01,加酶量10202 U/g,2%蛋白浓度,28 kHz,在此条件预测抑制率达到40.18%。为验证模型可靠性,进行3次验证,测得抑制率为40.25%,与预测值基本一致,数准确可靠,具有实用性。
2.2.5结果讨论本研究使用超声波辅助酶解的方法制备牡丹籽降血糖肽。普通酶解在温度37.3 ℃,pH8.01,加酶量10202 U/g,底物浓度2%条件下,40 min才到达最佳抑制率,抑制率仅为25.35%,相较而言,超声波辅助酶解的抑制率提高14.9%,这可能是超声波辅助酶解过程对蛋白质、酶分子的结构发生了影响导致的[11-15,18-19],研究结果与林洮等[19]对超声波促进酶解反应的研究结果一致。王晟等[3]通过对木瓜蛋白酶制得山杏蛋白降血糖肽的研究,该肽对α-葡萄糖苷酶抑制类型为非竞争性抑制;本文中牡丹籽降血糖肽的抑制类型有待以后研究。
因此,使用超声波辅助酶解,不仅提高了产量,也缩短了反应时间,达到了预期目的。不仅为Ⅱ型糖尿病患者提供了新型降血糖药物,而且为牡丹籽蛋白的高效化利用提供了新的方向,具有较高的实用前景与价值。
3 结论
本研究采用超声波辅助胰蛋白酶的技术手段制备牡丹籽降血糖肽,通过超声波提高酶解反应速率以及目标产物得率,相较正常酶解,时间缩短为原来的1/2,α-葡萄糖苷酶抑制率却是原来的2倍以上;因此,超声波明显促进多肽的制备效果,在实际生产中极具应用价值。
在本实验中,通过对超声波频率、功率、底物浓度、温度、时间、pH、加酶量的单因素筛选和响应面优化。最终确定最佳工艺参数为:温度37.3 ℃,21.68 min,60.52 W(体积600 cm3),pH8.01,加酶量10202 U/g,2%蛋白浓度,28 kHz,在此条件实际抑制率达到40.25%。
[1]聂莹,陈俊帆,苏东海,等.α-葡萄糖苷酶抑制剂的研究进展及食品源抑制剂的开发前景[J].农产品加工·学刊,2012,(3):18-23.[2]姚军.警惕高血糖的危害[M].医学与保健(上旬版),2008,16(9):42.
[3]王晟,崔洁,顾欣,等.木瓜蛋白酶制备山杏源降血糖肽工艺优化研究[J].食品工业科技,2014,35(9):169-173.
[4]吴晖,罗美琪,赖富饶,等.酶解丝素蛋白制备α-葡萄糖苷酶抑制肽的研究[J].食品科技,2012,37(2):27-31.
[5]李志博,姜文杰,齐阳,等.杂色蛤酶解制备α-葡萄糖苷酶抑制肽的工艺研究[J].食品研究与开发,2013,34(24):135-138.
[6]Hyun Jung Lee,Hyun-Sun Lee,Jang Won Choi,et al. Novel Tripeptides withα-Glucosidase Inhibitory Activity Isolated from Silk Cocoon Hydrolysate[J].Journal of Agricultural and Food Chemistry,2011,59(21):11522-11525.
[7]Zhipeng Yu,Yongguang Yin,Wenzhu Zhao,et al. Novel peptides derived from egg white protein inhibitingα-glucosidase[J]. Food Chemistry,2011,129(4):1376-1382.
[8]Isabelle M. E. Lacroix and Eunice C. Y. Li-Chan. Inhibition of Dipeptidyl Peptidase(DPP)-IV andα-Glucosidase Activities by Pepsin-Treated Whey Proteins[J]. Journal of Agricultural and Food Chemistry,2013,61(31):7500-7506.
[9]王林,王鹏,胡建恩,等.鱿鱼肝脏蛋白中α-葡萄糖苷酶抑制肽的研究[J].食品科技,2015,40(4):315-321.
[10]骆会欣.油用牡丹种,还是不种[N].中国花卉报,2016,1(1):1-4.
[11]黄卓烈,陈小丽,巫光宏,等.超声波对胰蛋白酶活力影响的机理研究[J].中国生化药物杂志,2009,30(4):230-238.
[12]Soria A C,Villamiel M. Effect of ultrasound on the technological properties and bioactivity of food:a review[J]. Trends in Food Science & Technology,2010,21(7):323-331.
[13]吴进菊,张凯丽,周海燕.超声波辅助酶法制备大豆蛋白抗氧化肽的研究[J].食品工业科技,2012,33(17):212-214.
[14]张辉.超声辅助酶解制备麦麸抗氧化肽工艺的研究[J].食品科技,2016,41(1):219-224.
[15]李芳,侯伟伟,任海波,等. 超声波辅助酶解鹰嘴豆蛋白制备抗氧化肽的研究[J].食品研究与开发,2015,36(13):35-38.
[16]周景祥,王桂芹,余涛.蛋白酶和淀粉酶活性检测方法探讨[J].中国饲料,2001(11):23-24.
[17]陈胜军,陈辉,高瑞昌.超声波辅助酶解法提取罗非鱼眼透明质酸工艺条件[J].核农学报,2014,28(8):1446-1452.
[18]朱少娟.超声波加速胰蛋白酶反应及其机理的探讨[D].无锡:江南大学,2004:8-9.
[19]林洮,江漓,赵小虎,高梦祥.超声促进胰蛋白酶酶解米渣蛋白的研究[J].食品研究与开发,2012,33(3):6-9.
[20]张黎明,李瑞超,郝利民,等.响应面优化玛咖叶总黄酮提取工艺及其抗氧化活性研究[J].现代食品科技,2014,30(4):233-239.
[21]贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2011,32(2):79-83.
[22]郑明洋,王元秀,张桂香,等.响应面法优化玉米黄粉蛋白的酶解工艺[J].食品科学,2012,33(4):71-76.
[23]刘奉强,肖鉴谋,刘太泽.应用响应面法优化超声波提取荆芥中总黄酮的工艺[J].南昌大学学报,2011,33(2):149-155.
Optimization of ultrasonic-assisted enzymatic preparation of peony seed hypoglycemic polypeptide by response surface methodology
YAN Hui,CAI Hao,JIA Jun-qiang,JIANG Ming-zhu,WU Qiong-ying
(School of biotechnology,Jiangsu University of Science and Technology,Zhenjiang 212018,China)
In order to get a new type of hypoglycemic peptide,ultrasonic-assisted enzymatic was used to prepare peony seed hypoglycemic peptide,and the process was optimized by one-factor and response surface experiments. Five factors were determined to be optimized by the response surface methodology from the seven factors of enzymolysis. The optimal process parameters were temperature of 37.3 ℃,time of 21.68 min,power of 60.52 W(volume of 600 cm3),pH8.01,enzyme of 10202 U/g,protein concentration of 2%,frequency of 28 kHz,and the actual inhibition rate was 40.25% under this condition,which was increased by 14.9% compared with the no ultrasonic condition. This study not only provided basis for ultrasonic assisted preparation of peony seeds hypoglycemic peptide,but also gave a new utilization direction of peony seed protein.
ultrasonic;peony seed protein;α-glycosidase inhibition rate;enzymatic hydrolysis reaction;response surface methodology
2016-02-26
颜辉(1971- ),男,博士,副教授,研究方向:生物制药,E-mail:yanh1006@163.com。
市重点研发计划-产业前瞻与共性关键技术(GY2015006)。
TS201.1
B
1002-0306(2016)17-0220-06
10.13386/j.issn1002-0306.2016.17.035

