线粒体未折叠蛋白反应在Sir2抑制帕金森转基因果蝇中的作用
戚欣欣,肖志超,范晓丽,孙 莉,李清华
线粒体未折叠蛋白反应在Sir2抑制帕金森转基因果蝇中的作用
戚欣欣1,肖志超2,范晓丽1,孙 莉1,李清华3
目的 探讨Sir2对帕金森病(PD)转基因果蝇是否有神经保护作用及与线粒体未折叠蛋白反应(UPRmt)的相关性。方法 选用Mhc-GAL4启动子,利用经典的GAL4-UAS系统构建Mhc-GAL4/UAS系统Pink1B9PD转基因果蝇模型,通过遗传干预使Sir2在Mhc-GAL4/UAS系统PD转基因果蝇运动神经元内过表达,观察Sir2过表达对果蝇运动神经元变性是否具有神经保护作用,然后通过RNAi技术抑制UPRmt相关基因热休克蛋白60(Hsp60)、GCN-2的表达,观察Sir2过表达对抑制果蝇运动神经元变性的作用,以及验证这种作用是否与UPRmt相关。结果 Sir2过表达明显抑制了PD转基因果蝇运动神经元变性,显著改善了果蝇运动能力,而在UPRmt被抑制后,Sir2的保护作用明显减弱。结论 Sir2对PD转基因果蝇具有神经保护作用,而这种神经保护作用与UPRmt相关。
帕金森病;Sir2;转基因果蝇;线粒体未折叠蛋白反应
帕金森病又称特发性帕金森病(idiopathic Parkinson′s disease,PD),简称PD,也称为震颤麻痹,是第二大常见的中枢神经系统退行性疾病,仅次于阿尔茨海默病(Alzheimer′s disease,AD),临床表现为面具脸、静止性震颤、行动迟缓、随意运动缺失、肌张力增高、关节僵硬等一系列症状[1]。研究[2]指出PINK1的缺失能够导致线粒体形态功能异常。而近几十年的研究[3]表明,线粒体的功能紊乱是PD发病的一个重要原因。沉默信息调节因子2(silent information regulator 2,Sir2)是一类从古细菌到人类进化都高度保守的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖的组蛋白去乙酰化酶(histone deacetylase,HDAC)[4],是sirtuin蛋白家族的一员,在DNA损伤修复、细胞周期控制、抑制细胞凋亡、抵抗氧化应激、能量代谢、线粒体功能保护等方面起着重要作用[5-7]。最近的研究[8]表明,Sir2可增加线粒体编码的MTCO1(线粒体氧化呼吸链复合物IV亚单位)和核编码的ATP5A(线粒体氧化呼吸链复合物IV亚单位)之间的比率,破坏线粒体核蛋白失衡,诱导线粒体未折叠蛋白反应(mitochondrial unfolded protein response,UPRmt) ,改善线粒体功能并显著延长了线虫的寿命。由此,该研究利用已建立的PD转基因果蝇模型,探讨Sir2是否能够保护PD转基因果蝇的神经变性,以及抑制UPRmt后Sir2还能否抑制PD转基因果蝇的神经变性,进一步研究UPRmt在Sir2神经保护的作用。
1 材料与方法
1.1 材料 果蝇品系:野生型基因w1118、Mhc-GAL4、Sir2、Hsp60 RNAi、GCN-2 RNAi购自美国Bloomington果蝇种系中心。UAS-PINK1B9及双平衡系果蝇sco/CyO;TM3/TM6由中南大学医学遗传学国家重点实验室惠赠。
1.2 方法
1.2.1 果蝇杂交
1.2.1.1 构建w1118/+;Mhc-GAL4/+的果蝇 将w1118的处女蝇与Mhc-GAL4的雄果蝇杂交,收取F1代雄果蝇,即基因型为w1118/+;Mhc-GAIA/+的目的果蝇,此为PD转基因果蝇的正常对照组果蝇(control)。
1.2.1.2 构建PINK1B9/y;Mhc-GAL4/+的果蝇 将PINK1B9/FM6;Mhc-GAL4的处女蝇与w1118的雄果蝇杂交,收取F1代雄果蝇,即基因型为PINK1B9/y;MHC-GAL4/+,即为PD转基因疾病组果蝇(PD flies)。
1.2.1.3 构建PINK1B9/y;Sir2/+;Mhc-GAL4/+的果蝇 将PINK1B9/FM6;Mhc-GAL4/+的处女蝇与Sir2的雄果蝇杂交,收取F1代雄果蝇,即基因型为PINK1B9/y;Sir2/+;Mhc-GAL4/+,此为Sir2过表达干预PD转基因果蝇[Sir2(+)PD flies]。
1.2.1.4 构建PINK1B9/y;Sir2/+;Mhc-GAL4,Hsp60 RNAi的果蝇 将Sir2处女蝇与双平衡系果蝇sco/CyO;TM3/TM6雄果蝇杂交构建Sir2/ sco;TM3/+的平衡果蝇;同时Hsp60 RNAi的处女蝇与双平衡系果蝇sco/CyO;TM3/TM6雄果蝇杂交,构建+/CyO;Hsp60 RNAi/TM6的平衡果蝇。然后将Sir2/ sco;TM3/+处女蝇与+/CyO;Hsp60 RNAi/TM6雄果蝇杂交,得到Sir2/CyO;Hsp60 RNAi/TM3的双平衡系果蝇,再将此雄果蝇与PINK1B9/FM6;Mhc-GAL4/+处女蝇杂交,收取F1代不带卷翅且不带短刚毛的雄性目的果蝇,即基因型PINK1B9/y;Sir2/+;Mhc-GAL4,Hsp60 RNAi,此为抑制UPRmt干预组1,敲除分子伴侣Hsp60而Sir2过表达的PD转基因果蝇[Sir2(+)PD flies Hsp60(-)]。
1.2.1.5 构建PINK1B9/y;Sir2/+;Mhc-GAL4,GCN-2 RNAi的果蝇 将GCN-2 RNAi的处女蝇与双平衡系果蝇sco/CyO;TM3/TM6雄果蝇杂交,构建+/CyO;GCN-2RNAi/TM6的平衡果蝇。然后将已构建好的Sir2/sco;TM3/+处女蝇与+/CyO;GCN-2 RNAi/TM6雄果蝇杂交,得到Sir2/CyO;GCN-2 RNA i/TM3的双平衡系果蝇,再将此雄果蝇与PINK1B9/FM6;Mhc-GAL4/+处女蝇杂交,收取F1代不带卷翅且不带短刚毛的雄性目的果蝇,即基因型PINK1B9/y;Sir2/+;Mhc-GAL4,GCN-2 RNAi,此为抑制UPRmt干预组2,GCN-2基因敲除而Sir2过表达的果蝇[Sir2(+)PD flies GCN-2(-)]。
1.2.2 数据采集
1.2.2.1 果蝇形态学检测 观察五组果蝇体态:基因型w1118/+;Mhc-GAL4/+的果蝇为对照组(control);基因型PINK1B9/y;Mhc-GAL4/+的果蝇为PD疾病模型组(PD flies);基因型PINK1B9/y;Sir2/+;Mhc-GAL4/+的果蝇为Sir2(+)PD flies;基因型PINK1B9/y;Sir2/+;Mhc-GAL4,Hsp60 RNAi果蝇为Sir2(+)PD flies Hsp60(-);基因型PINK1B9/y;Sir2/+;Mhc-GAL4,GCN-2 RNAi的果蝇为Sir2(+)PD flies GCN-2(-)。
1.2.2.2 果蝇飞行试验 观察分组同1.2.2.1果蝇的翅膀异常率、飞行率。将5 d的各组果蝇随机挑选100只雄性果蝇,CO2麻醉后,每5只装入1个空的果蝇培养管中,半小时果蝇完全复苏后,观察果蝇翅膀异常率,轻轻敲打培养管壁计算果蝇飞起数。在同样的恒温恒湿及相同观察时间,重复至少3次实验。
1.2.2.3 果蝇线粒体三磷酸腺苷(ATP)浓度检测 分别取control、PD flies、Sir2(+)PD flies三组第5天的雄性果蝇各50只,切取果蝇胸部组织,分别放入液氮研磨,并加入200 μl HClO4继续研磨,研磨后3 500 r/min离心15 min,取上清液,缓慢加入0.2 mol/L KOH,调节pH至7.5,再3 500 r/min离心15 min后取上清液至新EP管,得到样品。采用高效液相色谱仪(HPLC)检测制备成功的样品中ATP含量。以上实验至少重复3次。
1.2.2.4 果蝇mRNA水平检测 果蝇分组同1.2.2.1,切取5 d的雄性果蝇胸部各40只,分别提取各组的总RNA,使用TaKaRa Code No.RR047A试剂盒对提取的总RNA进行逆转录得到各组果蝇的cDNA,再以cDNA为模板,应用7500Fast Real-Time PCR System(Applied Biosystems)仪器进行qRT-PCR,检测mRNA表达水平。应用primer 5.0软件设计合成引物,合成18S、Sir2、Hsp60、Hsc70-5、Hsp10、Clpx的各引物序列(美国Invitrogen有限公司)。见表1。

表1 引物序列
1.2.2.5 Western blot检测烟酰胺腺嘌呤二核苷酸脱氧酶铁-硫蛋白3(NDUFS3)、Hsp60、p-eIF2α等蛋白的表达 果蝇分组同1.2.2.1,切取5 d的雄性果蝇胸部,各称重10 mg,按比例加入RIPA裂解液提取各组总蛋白,与5×loading buffer混合后上样,经聚丙烯酰氨凝胶(10%分离胶+5%浓缩胶)电泳后转移到PVDF膜上,5%脱脂牛奶封闭1 h,TBST洗涤,一抗孵育4 ℃过夜,回收抗体,TBST洗涤后,二抗室温孵育2 h,TBST洗涤,与免疫印迹发光试剂进行反应,暗室压胶片显影、定影。


图1 果蝇形态学观察
A:Control(基因型为w1118/+;Mhc-GAL4/+,果蝇翅膀重合率较好);B:PD files(基因型为PINK1B9/y;Mhc-GAL4/+,果蝇翅膀分叉异常);C:Sir2(+) PD files(基因型为PINK1B9/y;Sir2/+;Mhc-GAL4/+,改善了PD转基因果蝇表型)
2 结果
2.1 Sir2过表达对PD转基因果蝇的神经变性作用 在Mhc-GAL4肌肉启动子启动下,利用果蝇GAI4-UAS系统将靶基因特异性地在肌肉组织中表达,表现在翅膀异翅率与飞行能力的变化。与control比较,PD转基因果蝇的翅膀有明显翅膀分叉、下垂、甚至竖立不闭合的异常表现,并且飞行能力明显减弱,见图1。Sir2过表达对PD转基因果蝇干预后,翅膀异翅率明显得到改善,飞行能力提高,见图1、2。检测3组果蝇Sir2的mRNA水平,Sir2过表达干预组Sir2(+) PD flies较control、PD flies表达水平均较高,见图3。检测ATP水平,结果显示PD转基因果蝇组ATP水平明显较Sir2(+)PD flies及control低,见图4。Western blot检测通过条带灰度分析检测NDUFS3蛋白水平表达量(将β-actin蛋白表达水平设置成内参进行校准比较),Sir2(+)PD flies中NDUFS3蛋白的表达量增高,挽救了线粒体Complex I,见图5。
2.2 抑制UPRmt后Sir2过表达对PD转基因果蝇的神经变性作用 敲除PD转基因果蝇神经元内UPRmt的标志物Hsp60、GCN-2基因,抑制UPRmt而Sir2过表达,对PD转基因果蝇进行干预,翅膀异常较Sir2(+)PD flies低,异常表现显著,飞行能力也较弱,抑制UPRmt而Sir2过表达干预并未挽救PD转基因果蝇,见图6。
2.3 Sir2过表达对PD转基因果蝇神经元UPRmt的诱导作用 检测control、PD flies及三个干预组果蝇Hsp60及其他分子伴侣的mRNA水平,Sir2(+)PD flies干预后诱导UPRmt相关分子伴侣mRNA表达水平升高,阻断UPRmt的干预组较低,见图7。Western blot检测,通过条带灰度分析检测Hsp60、Total eIF2α、eIF2α磷酸化蛋白水平表达量(将β-actin蛋白表达水平设置成内参进行校准比较,所有结果重复3次),Hsp60表达水平Sir2(+)PD flies较control、PD flies及其它两组干预组都高,与qRT-PCR Hsp60 mRNA水平表达一致;Total eIF2α表达水平相似,eIF2α磷酸化蛋白表达水平PD flies较control升高,低于Sir2(+)PD flies,抑制UPRmt干预组2的eIF2α磷酸化蛋白表达水平最低,见图8。
3 讨论
PD是仅次于AD的第二大神经退行性疾病[1],也是中老年人最常见的锥体外系疾病,65岁以上老人发病率约为1 000/10万,随年龄而增高,通常从发病至诊断平均为2.5年。主要病理标志为中脑黑质致密部多巴胺神经元缺失,剩余存活的神经元a-突触核蛋白(a-synuclein,a-syn)和胞质内包涵体(lewy body,LB)形成,黑质-纹状体通路多巴胺释放减少。目前已经鉴定了18个与PD相关的致病基因,如parkin、PINK1、DJ-1、LRRK2、HtrA2、ATP13A2,其中PINKI(phosphatase and tensin-homolog-(PTEN-)induced kinase J,PINK1)的突变与常染色体隐性遗传的PD有关。其发病机制相当复杂[2],PD并非单一因素致病,可能多种因素参与,如年龄老化、环境因素、遗传因素、氧化应激和自由基生成、免疫学异常、线粒体功能缺陷等[3]。线粒体是细胞内生成ATP主要的能量场所[9],也是各种细胞应激损伤最为敏感的细胞器[10-11]。线粒体损伤所产生的氧自由基累积被认为导致了PD等许多神经退行性疾病的发生[12-13]。最近有关线虫的研究[14]表明,激活UPRmt,线粒体应激并未导致线粒体功能障碍,反而增加了ATP生成,延长了线虫寿命。

图2 果蝇飞行结果
1:Control;2:PD flies;3:Sir2(+) PD flies;A:果蝇翅膀异常率;B:果蝇飞行率;与control比较:***P<0.001
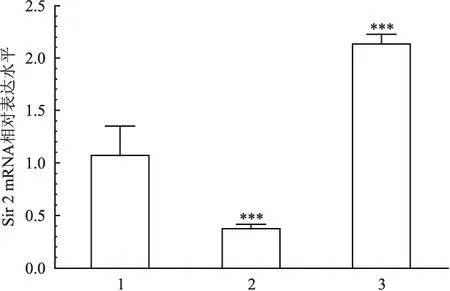
图3 qRT-PCR检测Sir2 mRNA表达水平
1:control;2:PD flies;3:Sir2(+) PD flies;与control比较:***P<0.001

图4 Sir2过表达对PD转基因果蝇模型的线粒体功能的影响
1:control;2:PD flies;3:Sir2(+) PD flies;与control比较:***P<0.001

图5 Western blot检测Complex I的组分NDUFS3蛋白的表达量
1:control;2:PD flies;3:Sir2(+) PD flies;与control比较:***P<0.001
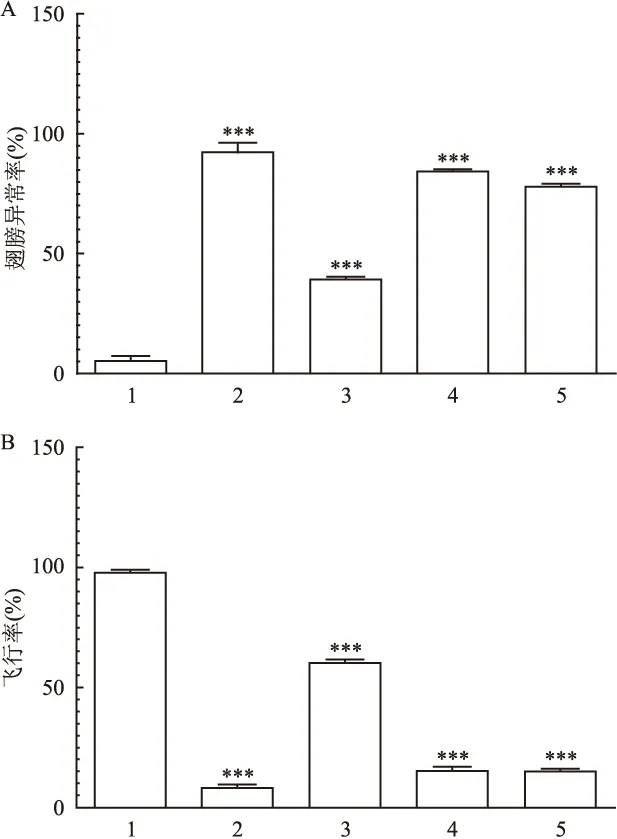
图6 阻断UPRmt对Sir2过表达抑制PD转基因果蝇作用的影响
1:control;2:PD flies;3:Sir2(+) PD flies;4:抑制UPRmt干预组1;5:抑制UPRmt干预组2;A:果蝇翅膀异常率;B:果蝇飞行率;与control比较:***P<0.001

图7 qRT-PCR检测UPRmt相关线粒体分子伴侣mRNA表达水平
1:control;2:PD flies;3:Sir2(+) PD flies;4:抑制UPRmt干预组1;5:抑制UPRmt干预组2;与control比较:**P<0.01,***P<0.001

图8 Western blot检测神经元内eIF2α磷酸化及Hsp60蛋白表达水平
1:control;2:PD flies;3:Sir2(+) PD flies;4:抑制UPRmt干预组1;5:抑制UPRmt干预组2;与control比较:***P<0.001
UPRmt是近年来发现的一种线粒体应激保护机制,当线粒体遭遇某些应激而致功能紊乱时,打破了线粒体核蛋白平衡,诱导更多线粒体分子伴侣如Hsp60、Hsp10、Hsc70-5的表达,进而更好地促进蛋白正确折叠或降解[15],并促进GCN-2对真核细胞翻译起始因子eIF2α的磷酸化,抑制了除线粒体应激反应外的其它蛋白合成,减少了蛋白向线粒体的输入,降低线粒体分子伴侣的负荷[9]。
Sir2是依赖的NAD+去乙酰化酶,在线粒体功能保护中具有十分显著的作用。Sir2能够打破线虫线粒体核蛋白平衡,诱导UPRmt[8]。本实验选用Mhc-GAL4启动子,利用经典的GAL4-UAS系统,构建Mhc-GAL4/UAS系统Pink1B9PD转基因果蝇模型,通过遗传干预使Sir2在Mhc-GAL4/UAS系统PD转基因果蝇运动神经元内过表达,Sir2过表达对PD转基因果蝇同样具有神经保护作用,挽救了PINK1B9PD转基因果蝇模型表型,抑制PD转基因果蝇的神经变性,提高了果蝇运动能力,使飞行得到改善,以及提高其线粒体的功能,增加了ATP的生成。
Western blot检测结果显示线粒体氧化呼吸链中Complex I的组分NDUFS3蛋白的表达量也明显升高。本研究探讨Sir2过表达对PD转基因果蝇的作用是否通过诱导UPRmt而增加线粒体的应激适应性,从而提高了线粒体功能而具有的神经保护作用。敲除与UPRmt相关的基因分子伴侣Hsp60及与eIF2α磷酸化有关的GCN-2的基因后,Sir2过表达并未挽救PD转基因果蝇PINK1B9的神经毒性,其翅膀分叉竖立较多残翅较明显,飞行率较低。qRT-PCR检测5组果蝇的分子伴侣mRNA的表达量,PD转基因果蝇的Hsp60相关分子伴侣mRNA水平较control升高,线粒体发生应激反应,而Sir2过表达干预后其mRNA表达水平较其它各组均较高,提示Sir2过表达诱导UPRmt提高了果蝇线粒体的应激适应性从而改善线粒体功能。在果蝇转录水平Sir2过表达干预组分子伴侣表达量较高,同样Western blot检测Hsp60蛋白表达量也是升高的,以及提高了真核细胞翻译起始因子eIF2α的磷酸化水平,明确UPRmt在Sir2过表达抑制PD转基因果蝇神经变性中的作用。PD等许多神经退行性疾病的发病机制并非单一因素,目前其发病机制并不明确,临床上并无有效的药物进行治疗,线粒体的损伤及功能障碍与PD密切相关,Sir2通过诱导UPRmt提高线粒体应激适应性抑制PD转基因果蝇的神经变性,为临床探索利用UPRmt诱导药物治疗PD疾病提供理论依据。
[1] Huang Y,Halliday G M.Aspects of innate immunity and Parkinson′s disease[J].Front Pharmacol,2012,3:33.
[2] Park J,Lee S B,Lee S,et al.Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin[J].Nature,2006,441(7097):1157-61.
[3] Winklhofer K F,Haass C.Mitochondrial dysfunctionin Parkinson′s disease[J].Biochim Biophy Acta,2010,1802(1):29-44.
[4] Yang X J,Seto E. HATs and HDACs:from structure,function and regulation to novel strategies for therapy and prevention[J].Oncogene,2007,26(37):5310-8.
[5] Herskovits A Z,Guarente L.SIRT1 in neurodevelopment and brain senescence[J].Neuron,2014,81(3):471-83.
[6] Banerjee K K,Ayyub C,Sengupta S,et al.Fat body dSir2 regulates muscle mitochondrial physiology and energy homeostasis nonautonomously and mimics the autonomous functions of dSir2 in muscles[J].Mol Cell Biol,2013,33(2):252-64.
[7] Koh H,Kim H,Kim M J,et al.Silent information regulator 2 (Sir2) and Forkhead box O (FOXO) complement mitochondrial dysfunction and dopaminergic neuron loss in Drosophila PTEN-induced kinase 1 (PINK1) null mutant[J].Biol Chem,2012,287(16):12750-8.
[8] Papa L,Germain D.SirT3 Regulates the mitochondrial unfolded protein response[J].Mol Cell Biol,2014,34(4):699-710.
[9] Ma T,Trinh M A,Wexler A J.Suppression of eIF2α kinases alleviates Alzheimer′s disease-related plasticity and memory deficits[J].Nat Neurosci,2013,16(9):1299-305.
[10]Exner N,Lutz A K,Haass C,et al.Mitoehondrial dys-function in Parkinson′s disease molecular mechanisms and pathophysiological consequences[J].EMBO J,2012,31(14):3038-62.
[11]Winklhofer K F,Haass C.Mitochondrial dysfunction in Parkinson′s disease[J].Biochim Biophy Acta,2010,1802(1):29-44.
[12]Sai Y,Zou Z,Peng K,et al.The Parkinson′s disease-related genes act in mitochondrial homeostasis[J].Neurosci Biobehav Rev,2012,36(9):2034-43.
[13]Dillin A,Hsu A L,Arantes-Oliveira N,et al.Rates of behavior and aging specified by mitochondrial function during development[J].Science,2002,298(5602):2398-401.
[14]Houtkooper R H, Mouchiroud L, Ryu D, et al. Mitonuclear protein imbalance as a conserved longevity mechanism[J]. Nature,2013,497(7450):451-7.
[15]Haynes C M,Ron D.The mitochondrial UPR-protecting organelle protein homeostasis[J].J Cell Sci,2010,123(Pt 22):3849-55.
Role of mitochondrial unfolded protein response in Sir2 suppresses the neurodegeneration of PD transgenic Drosophila
Qi Xinxin1,Xiao Zhichao2,Fan Xiaoli1,et al
(1BasicMedicalCollege,GuilinMedicalUniversity,Guilin541000;2DeptofCardiothoracicSurgery,AffiliatedHospitalofGuilinMedicalUniversity,Guilin541000)
ObjectiveTo investigate whether Sir2 has a neuroprotective effect on PD transgenic Drosophila and the relevance of UPRmt.MethodsThe Mhc-GAL4 promoter and the classical GAL4-UAS system were used to construct PD transgenic Drosophila models-Pink1B9 which could be expressed in Drosophila muscles. To investigate whether Sir2 overexpression in PD transgenic Drosophila of the Mhc-GAL4/UAS system by genetic intervention had neuroprotective effects on neurodegeneration. The chaperone Hsp60 and GCN-2 expression associated with UPRmtby RNA interference were inhibited to observe the role of Sir2 overexpression in suppressing neurodegeneration in PD transgenic Drosophila and verify the correlation with UPRmt.ResultsSir2 overexpression significantly inhibited neurodegeneration in PD transgenic Drosophila and improved the athletic ability. The effect of Sir2 was weakened by inhibiting UPRmt.ConclusionSir2 overexpression has neuroprotective effects on PD transgenic Drosophila which is associated with UPRmt.
PD;Sir2;transgenic Drosophila;UPRmt
国家自然科学基金(编号:81160163、81460180)
1桂林医学院基础医学院,桂林 541000 桂林医学院附属医院2心胸外科、3神经内科,桂林 541000
戚欣欣,女,硕士研究生; 孙 莉,女,教授,硕士生导师,责任作者,E-mail:635109710@qq.com; 李清华,男,教授,博士生导师,责任作者,E-mail:qhli1999@163.com.cn
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.002.html
R 74;R 394
A
1000-1492(2016)11-1559-07
10.19405/j.cnki.issn1000-1492.2016.11.002
2016-06-22接收

