HW236-5发酵产品
——纳豆激酶的酶学特性研究
孙建华,曲晓军,王金英,于冲,夏海华,原韬,潘钰,姜宏宇,于丽萍
(1.黑龙江省科学院微生物研究所,哈尔滨 150010;2.黑龙江省科学院高技术研究院,哈尔滨 150020)
HW236-5发酵产品
——纳豆激酶的酶学特性研究
孙建华,曲晓军,王金英,于冲,夏海华,原韬,潘钰,姜宏宇,于丽萍
(1.黑龙江省科学院微生物研究所,哈尔滨 150010;2.黑龙江省科学院高技术研究院,哈尔滨 150020)
本次试验所用纳豆激酶是由本所分离并命名的HW236-5纳豆芽孢杆菌,发酵大豆经提取分离获得,主要对纳豆激酶的酶学特性进行研究。采用SDS-PAGE法以及Zeta电位法分别测得纳豆激酶的分子量为28 kDa,等电点为8.58,纳豆激酶的酶活为62520 U/g。纳豆激酶在不同的加热温度时,温度越高,其酶活越低。NaCl在浓度低于1.35 mol/L时,对纳豆激酶的酶活起到促进作用,但是高于此浓度时,纳豆激酶的酶活明显受到了抑制。
HW236-5纳豆芽孢杆菌;纳豆;纳豆激酶
纳豆激酶最早来源于日本的一种传统大豆发酵食品纳豆,它是由275个氨基酸组成的单链多肽的丝氨酸蛋白酶,其酶活性质容易变性失活[1]。1987年,由日本的须见洋行[2]等人发现并命名。其实纳豆是起源于中国传统的发酵豆制品——豆豉,后被僧人传入日本[3]。因为它是来源于传统食品中的一种药物,并且其毒副作用小,因而具有广阔的开发前景并极有可能成为新一代的溶栓药物[4,5]。但纳豆激酶的缺点也限制了其发展,比如纳豆激酶的纯酶稳定性差、容易失活、不利于储存以及运输等,故而引起人们对其酶学特性的研究[6,7]。
本次试验主要是研究本单位分离自纳豆的纳豆芽孢杆菌B.Subtlis HW236-5,经中国微生物菌种保藏管理委员会普通微生物中心鉴定并保藏,发酵大豆[3]提取的纳豆激酶在不同条件下的酶学稳定性,采用纤维蛋白-琼脂糖平板法测定纳豆激酶的酶活。在不同加热温度、pH、加热时间以及不同NaCl离子强度时,对纳豆激酶酶活稳定性的影响。
1 材料和方法
1.1 材料
纳豆激酶:以黑龙江省科学院微生物研究所筛选的纳豆芽孢杆菌HW236-5发酵大豆经提取获得。
试剂:实验涉及的试剂均采用分析纯、生化纯。
设备:电子分析天平、电热恒温培养箱、超净工作台等。
1.2 方法
1.2.1 纳豆激酶的基础性质
纳豆激酶的分子量及等电点。
A.分子量的测定:采用SDS-PAGE电泳法
SDS-PAGE电泳法操作步骤:
a.将模具准备好,并用适量的水溶液检测其是否漏水,如果漏水,做相应的调整至不漏水,然后进行下面的操作。
b.在小烧杯中配制所需浓度的分离胶,配置溶液所需体积按表1,用玻璃棒搅拌使溶液混匀,用移液枪吸取适量的凝胶溶液,并小心加入到不漏水的模具内,避免气泡的出现。加入分离胶结束后,并在其上层加入一层水或者乙醇,既隔绝空气又消除气泡,保证凝胶表面的平整。
c.待分离胶凝结后,在模具上层插入梳子,并配制浓缩胶,配置溶液所需体积按表1,轻轻搅拌混匀后,加至分离胶的上层。
d.将凝胶模具放入到电泳槽内备用,并将配好的电泳缓冲液先加入到内部的电泳槽中,使其没过最低的那个平板,再往外部电泳槽中倒入电泳缓冲液,从而使所制得的凝胶无论是加样的部位,还是远离加样的部位,都能够浸泡在电泳缓冲溶液中。
e.将纳豆激酶样品与配置好的放置在4℃冰箱中备用的样品缓冲液按1∶5的比例,在带盖的试管中混合,然后置于沸水浴中,煮沸5 min后取出,待混合液冷却后,取10 μL混合样品加入到样品位置处。
f.通电,直至样品线跑至凝胶的底端为止。
g.将凝胶取下,放入培养皿中,倒入染色液,染色1.5 h;最后进行脱色处理。
h.将脱色处理后的凝胶,用凝胶成像仪或者相机进行拍照记录。

表1 SDS-不连续体系凝胶配置Tab.1 SDS-discontinuous gel system prepared
B等电点的测定:采用Zeta电位测定法
纳豆激酶的等电点在8.6±0.3的范围内,故用酸碱溶液对纳豆激酶溶液调节pH,使pH的范围在8.4~8.9,并测定每一个pH下的Zeta电位。等电点为Zeta电位为零的点。
1.2.2 纳豆激酶的酶学特性研究
纳豆激酶酶活性质的测定是参照Astrup法制备纤维蛋白——琼脂糖平板,并依据《中华人民共和国卫生部WS2011(X2005)95》中“尿激酶琼脂糖-纤维蛋白平板法”进行测定。
1.2.2.1 试剂配制
A.磷酸盐缓冲溶液(0.01 mmol/LpH=7.75)。取磷酸氢二钠(Na2HPO4·12H2O),磷酸二氢钠(NaH2PO4· 2H2O)混合制备0.01 mol/L、pH=7.75的磷酸盐缓冲溶液。
B.工作液。取磷酸盐缓冲液(0.01 mmol/L)与0.9%氯化钠(即生理盐水)按照1:17的体积比混匀即可。
C.1%的琼脂糖溶液。取琼脂糖1 g,加工作液100 mL,放置在微波炉中,用中火加热3 min后,即可溶解得到琼脂糖溶液。
D.纤维蛋白原溶液。取纤维蛋白原148mg,加工作液配成0.3%的溶液,便为纤维蛋白原溶液,现用现配。
E.凝血酶溶液。取凝血酶20 BP单位(5.24 mg),加生理盐水20 mL,配成1 BP/mL的凝血酶溶液。
1.2.2.2 纤维蛋白——琼脂糖平板的制备
取经过微波炉加热溶解后的琼脂糖溶液16.2 mL置于烧杯中,放入45℃水浴中保温,同时将纤维蛋白原液16.2 mL、凝血酶液1.3 mL亦在45℃水浴中加热和保温,待温度平衡后,将三种液体混匀,然后迅速倒入平皿中,室温下放置30 min凝固即成。之后储存于4℃层析柜中待用,并在使用之前对平板进行打孔处理,用于纳豆激酶的酶活测定。
1.2.2.3 纳豆激酶活性测定方法
用移液枪吸取经过处理的酶液10 μL滴在平板上,加盖,在恒温培养箱37℃中培育18 h,到时间后,取出平板,用千分尺测量平板溶解圈的两垂直直径,以垂直两直径的乘积为酶的酶活。
1.2.2.4 纳豆激酶酶活标准曲线
根据纤维蛋白——琼脂糖平板测定方法,以尿激酶作为标准品,并以其相应的浓度作为横坐标,经游标卡尺测量的相对直径的乘积,所得的面积为纵坐标,绘制标准曲线。
1.2.2.5 纳豆激酶的最适反应温度
用0.02 mol/L的磷酸盐缓冲溶液(pH=7.4)配制一定酶活力的纳豆激酶溶液。将酶液分别置于40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃的水浴中保温30 min,用纤维蛋白-琼脂糖平板法测定其相对酶活。并以25℃的酶活力为100%,其他温度下的酶活与其比值为该温度下的相对酶活。
1.2.2.6 纳豆激酶的最适反应pH
用磷酸——柠檬酸缓冲液(pH=3~8)、碳酸钠缓冲液(pH=9~10)及NaOH溶液(pH=11)配制酶液(pH值取的间隔为0.5),并在温度为40℃的水浴中保温30 min,然后用纤维蛋白-琼脂糖平板法测定其相对酶活。以其中最高酶活时的pH值相对应的纳豆激酶的酶活力为100%,其余pH下的酶活与其的比值为该pH下的相对酶活。
1.2.2.7 纳豆激酶的保温时间稳定性
用pH为6.5的缓冲溶液配置相应浓度的纳豆激酶溶液,在40℃的水浴中保温不同的时间(30 min、60 min、90 min、120 min、150 min、180 min),然后用纤维蛋白-琼脂糖平板法测定其相对酶活。以其中最高的残余酶活为相对酶活100%,其他时间的残余酶活与其的比值为该时间下的相对酶活。
1.2.2.8 NaCl浓度对纳豆激酶酶学性质的影响
在40℃水浴中、溶液为pH=6.5以及加热时间为60 min条件下,在酶的水溶液中添加不同浓度的NaCl,测定纳豆激酶在离子强度分别为0.15 mol/L、0.55 mol/L、0.95 mol/L、1.35 mol/L、1.75 mol/L时的酶活。以不含金属的相应纳豆激酶溶液的残余酶活为相对酶活100%,其他相应的含有不同浓度NaCl的纳豆激酶溶液的残余酶活与其的比值为该NaCl浓度下的相对酶活。
2 结果与分析
纳豆激酶的分子量:
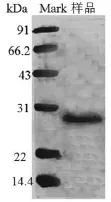
图1 纳豆激酶的电泳图Fig.1 The electrophore gram of natto kinase
将制备的纳豆激酶样品,经过Sephadex G-75凝胶层析纯化后,利用SDS-PAGE法测定纳豆激酶的分子量,并使所得到的样品与凝胶中的蛋白标品进行比较,从而得到样品的分子量。实验结果如图1所示。
由图1可知,第一条条带的是蛋白标准品,分别显示不同的分子量,从下往上依次为14.4 kDa、22 kDa、31 kDa、43 kDa、66.2 kDa、97.4 kDa。所得到的纳豆激酶的条带在22 kDa~31 kDa。经测定纳豆激酶的分子量为28 kDa。
纳豆激酶等电点,纳豆激酶在不同pH下的Zeta电位,并选择zeta电位接近零时的pH,进行相应的细分,以能得到Zeta电位为0时的pH,该pH即为纳豆激酶的等电点。实验结果如图2所示。
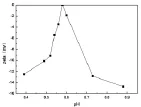
图2 纳豆激酶的Zeta电位图Fig.2 The picture of zeta about nattokinase
由图2可知,在pH=8.58时,纳豆激酶所带的电荷为零,故此纳豆激酶的等电点为8.58。
纳豆激酶的酶活测定,根据纤维蛋白-琼脂糖平板测定方法,以尿激酶作为标准品,并以其相应的浓度作为横坐标,经游标卡尺测量溶解圈的相对直径,并以两直径的乘积为纵坐标,绘制酶活的标准曲线,结果如图3所示。

图3 纳豆激酶酶活标准曲线Fig.3Standard of nattokinase's enzyme activity concentration
得到纳豆激酶酶活的标准回归方程为:y=1.5695 x+157.06,其中R2=0.9805。表明此方法用于测定纳豆激酶的活性,在浓度为20~100 U/mL时,线性关系良好。
由纤维蛋白一琼脂糖平板法测定样本中的纳豆激酶的酶活,经由游标卡尺测量后得到纳豆激酶的溶解圈面积为255.19 mm2,并由图3中的标准曲线计算可得,样品中纳豆激酶的基本酶活为62 520 U/g。
以25℃时的纳豆激酶的残余活性为相对酶活100%,其他温度下的纳豆激酶的残余酶活与之的比值为该温度下的相对酶活。实验结果如图4所示。
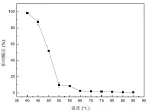
图4 温度对纳豆激酶酶学性质的影响Fig.4 The temperature influence on nattokinase's enzyme activity
由图4可知,随着温度的逐渐上升,纳豆激酶的相对酶活是逐渐下降的趋势。在低温的环境下,纳豆激酶的酶活受到的影响较小,稳定性能够得到较好的保存;且纳豆激酶的酶活在40℃~55℃下降趋势明显;高温条件下,纳豆激酶的酶活会完全失活,丧失了其溶解血栓的能力。故而,在对纳豆激酶的储存或者使用时,都应该控制温度在40℃以下,从而使纳豆激酶能够有较高的酶活。
不同pH对纳豆激酶酶活性质的影响,实验条件为:水浴温度40℃、加热时间30 min、pH为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0。并以其中最高的纳豆激酶残余酶活为相对酶活100%,其他pH下的纳豆激酶残余酶活与之的比值为该pH下的相对酶活。实验结果如图5所示。

图5 pH对纳豆激酶酶学性质的影响Fig.5The pH influence on nattokinase's enzyme activity
由图5可知,随着pH值的增加,纳豆激酶的相对酶活会逐渐升高然后再下降,最后纳豆激酶的相对酶活几乎为零,也表示纳豆激酶在此pH的区间内,完全失去活性。纳豆激酶的最适pH为6.5,并且其可以在pH=4.5~8.0时维持较高的酶活。
温度对酶活的影响具有不可逆性,在高温下失活变性后,酶的结构被破坏。酶在pH=6.5、水浴温度40℃下进行保温处理,保温的时间对酶活稳定性的影响如图6。
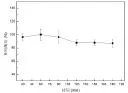
图6 保温时间对纳豆激酶酶活性质的影响Fig.6 The heat-time influence on nattokinase's enzyme activity
在保温时间较短时,对酶活起到了激发的作用,促使酶活逐渐上升;当保温时间过长,酶活随着时间的延长而逐渐降低。故在以后对酶进行应用研究时,尽量控制酶反应的时间在60 min以内,以保证在反应期间酶活能够保持较高的活性。
不同NaCl浓度对纳豆激酶酶活稳定性的影响,实验条件是:加热温度40℃、加热时间为60 min,以不含金属的相应纳豆激酶溶液的残余酶活为相对酶活100%,其他相应的含有不同浓度NaCl的纳豆激酶溶液的残余酶活与其的比值为该NaCl浓度下的相对酶活,实验结果如图7所示。

图7 NaCl浓度对纳豆激酶酶学性质的影响Fig.7The concentration of Na+influence on nattokinase's enzyme activity
由图7可知,随着NaCl溶液浓度的逐渐加大,纳豆激酶的相对酶活呈现出先上升后下降的趋势。低浓度的NaCl对纳豆激酶的活性有相应的促进作用;但当浓度较高时,又会对纳豆激酶的相对酶活有一定的抑制作用。当NaCl的浓度低于1.35 mol/L时,纳豆激酶的相对酶活都有相应程度的升高,尤其是当NaCl的浓度为0.95 mol/L时,纳豆激酶的相对酶活为最高,其相对酶活为127.87%,激活作用相对明显;但当NaCl的浓度高于1.35 mol/L时,纳豆激酶的相对酶活受到一定程度的抑制,从而导致其相对酶活降低。
3 结论
通过本次试验研究,测得经菌号HW236-5的纳豆芽孢杆菌发酵大豆提取的纳豆激酶的酶学特性,纳豆激酶的分子量为28 kDa,等电点为8.58,酶活为62 520 U/g;纳豆激酶的酶活稳定性随着温度的升高而逐渐降低;并且当温度足够高时,纳豆激酶会彻底失活,纳豆激酶应该在40℃以下进行储存以及应用;纳豆激酶在中性pH时,能保持较高的活性;但当pH值偏向酸或者碱的情况下,纳豆激酶的相对活性会相应降低。当pH=6.5~8.0时,纳豆激酶的相对酶活相对较高;但当pH<6.5或者pH>8.0时,纳豆激酶的酶活急剧下降;纳豆激酶的酶活稳定性随着保温时间的延长,会受到一定的损失;NaCl在低浓度时对纳豆激酶的酶活起到相应的促进作用;但在高浓度时,其对纳豆激酶的酶活起到一定的抑制作用。人体中的NaCl浓度为0.155 mol/L,处于对纳豆激酶的酶活起促进作用的浓度范围内。因此,在使用或者食用纳豆激酶时,应该注意对NaCl浓度的控制,因为当NaCl浓度超过1.35 mol/L时,对纳豆激酶的酶活是起到相应的抑制作用的,故应合理控制NaCl浓度的大小,从而使酶能最大化的发挥其作用。
[1]张玉岩.多功能保健食品纳豆的营养价值[J].湖南农机(学术版),2013,40(2):237.
[2][日]须见洋行,马场健史,岸丁明.纳豆中のづロウキナゼ活性化酵素と血栓溶解能[J].日本食品科学工学会志,1996,43(10):46-49.
[3]黑龙江省科学院应用微生物研究所.发酵大豆-纳豆及其成分的保健功能[M].哈尔滨:黑龙江人民出版社,2005.
[4]刁建中,陈桂光,马波,等.纳豆激酶的最新研究进展[J].轻工科技,2012,160(3):7-8.
[5]关海琳.药食两用纳豆激酶的研究进展[J].生物技术世界,2014,(02):82.
[6]赵仲麟,李淑英,聂莹,等.纳豆激酶生产菌的筛选及发酵纳豆特性研究[J].生物技术通报,2015,31(003):161-164.
[7]Kwon E Y,Kim K M,Kim M K,et al.Production of nattokinase by high cell density fed-batch culture of Bacillus subtilis[J].Bioprocess and Biosystems Engineering,2011,34(7):789-793.
Research of enzymology characteristics of natto kinase
SUN Jian-Hua,QIU Xiao-jun,WANG Jin-Ying,YU Chong,XIA Hai-Hua,YUAN Tao,PAN Yu,JIANG Hong-Yu,YU Li-Ping
(1.Iistitute of Microbiology,Heilongjiang Academy of ciences,Harbin 150010,China;
2.Iistitute of Advanced Technology,Heilongjiang Academy of Sciences,Haerbin 150020,China)
The main study of this experiment focuses on enzymology characteristics of natto kinase,by use of Bacillus natto HW236-5 isolated and named by Institute of Microbiology.Bacillus natto HW236-5 was obtained from extraction and separation of fermented soybean.By methods of SDS-PAGE and Zeta Potentiometry,it respectively measured that the molecular weight of natto kinase is 28 kDa,isoelectric point is 8.58, enzyme activity of natto kinase is 62520 U/g.When natto kinase is in different temperature,it finds out that the higher is the temperature,the lower is its enzyme activity.When NaCl concentration is lower than 1.35 mol/L,it plays promoting effects on enzyme activity of natto kinase.On the contrary,it is higher than 1.35 mol/L,the enzyme activity of natto kinas is inhibited.
Bacillus natto HW236-5;Natto;Nattokinase
Q55
A
1674-8646(2016)01-0004-04
2015-10-20
兼具整肠、调脂及调节免疫力的纳豆软胶囊保健食品的研制(KY14BSJH07)
孙建华(1961-),女,黑龙江哈尔滨人,学士,研究员,主要从事医学微生物、免疫制剂及保健食品研究。
于丽萍(1962-),女,黑龙江大庆人,学士,高级工程师,主要从事微生物研究及科研管理工作。

