高效絮凝剂产生菌的分离选育及培养条件优化
张海,曲睿娟,李日强
(山西大学环境与资源学院,山西太原030006)
高效絮凝剂产生菌的分离选育及培养条件优化
张海,曲睿娟,李日强
(山西大学环境与资源学院,山西太原030006)
为了研究微生物产絮凝剂的最佳培养条件,由此提高微生物絮凝剂的絮凝率。以采集于山西省晋阳湖湖心岛和平定县玉米地10~15 cm深处土壤为试验样品,通过常规细菌分离和高岭土悬浊液法,从中筛选出编号为PY-M3和PY-F6絮凝活性较高的2株菌株。优化培养试验表明,菌株PY-M3的最佳培养条件为:培养时间72 h,碳源为葡萄糖,含量为2 g/50 mL,氮源为复合氮源,培养基初始pH值为7.0,培养温度为30℃,摇床转速180 r/min,碳氮比值45,接种量2%;在最佳培养条件下,其发酵液絮凝率从92.57%提高到94.43%。菌株PY-F6的最佳培养条件为:培养时间72 h,碳源为葡萄糖,含量为0.5 g/50 mL,氮源为酵母膏,培养基初始pH值为7.0,培养温度为30℃,摇床转速140 r/min,碳氮比值30,接种量3%;在最佳培养条件下,其发酵液絮凝率从95.95%提高到98.61%。
微生物絮凝剂;絮凝率;培养条件优化
微生物絮凝剂是一类由微生物或其分泌物产生的代谢产物,且高效、无毒、可消除二次污染的有机高分子物质[1-3]。由于微生物絮凝剂能够克服无机絮凝剂和合成有机絮凝剂的多种缺陷,最终实现零污染排放,且安全无毒[4-5],逐渐成为国内外新型水处理剂的研究热点[6-8],被称为第三代絮凝剂。美国科学家Butterfield在1935年从活性污泥中首次筛选到了絮凝剂产生菌,Nakamuara[9]从1976年才开始深入对微生物絮凝剂的研究,最终以酱油曲霉(Aspergillums)原料生产了AJ7002微生物絮凝剂。高艺文等[10]从油田采出水中分离筛选出一株高效微生物产生菌GL-6,在碳源质量浓度为20 g/L、有机氮源质量浓度为0.5 g/L、初始pH值为7.0的发酵条件下,微生物絮凝剂对含油废水中浊度的去除率为92.4%,絮凝效果明显优于无机絮凝剂。张本兰[11]从活性污泥中分离筛选出菌株P.alcaligenes,其产生的絮凝剂对氯霉素废水的脱色率高达98%以上。
在实际应用中,由于微生物絮凝剂使用成本高、使用量大的弊端,制约了其发展应用。因此,寻找高效絮凝剂产生菌以及优化培养条件具有很重要的现实意义。本研究通过从土壤中筛选出絮凝活性较高的菌株,旨在通过优化其培养条件以提高絮凝率。
1 材料和方法
1.1 试验材料
1.1.1 样品来源样品取自山西晋阳湖湖心岛和平定县玉米地10~15 cm土层的土壤。
1.1.2 试剂高岭土,盐酸,氢氧化钠,硫酸铵,硝酸钠,苯酚,乙醇,蔗糖,淀粉,乳糖,葡萄糖,尿素,蛋白胨,酵母膏等(均为分析纯)。
1.1.3 主要仪器电子分析天平(FA3204B,上海精科天美贸易有限公司);高压蒸汽灭菌锅(ZDX-35B,上海申安医疗器械厂);恒温振荡培养箱(HZQF160,哈尔滨市东联电子技术开发有限公司);电热恒温培养箱(DHP-9272,上海一恒科技有限公司);六连搅拌器(J6-1,江苏金坛市金城国胜实验仪器厂);pH计(MP511,上海三信仪表厂);分光光度计(721,上海第三分析仪器厂)。
1.1.4 分离及保藏培养基[12]细菌分离培养基:牛肉膏3 g,蛋白胨10 g,琼脂15~20 g,NaCl 5 g,蒸馏水1 000 mL,pH值7.0~7.2,121℃灭菌15 min。
放线菌分离培养基:KCl 0.5 g,K2HPO41 g,NaNO32 g,FeSO40.01 g,MgSO40.5 g,蔗糖30 g,琼脂15~20 g,pH值自然,121℃灭菌15 min。
霉菌分离培养基:可溶性淀粉20 g,琼脂15~20 g,KNO31 g,NaCl 0.5 g,FeSO40.01 g,K2HPO40.5 g,MgSO40.5 g,蒸馏水1 000 mL,pH值7.2~7.4,121℃灭菌15 min。
发酵培养基[13]:葡萄糖20 g,尿素0.5 g,酵母膏0.5 g,(NH4)2SO40.2 g,K2HPO45 g,KH2PO42 g,MgSO4·7H2O 0.2 g,NaCl 0.1 g,pH值7.0,蒸馏水1 000 mL,112℃灭菌30 min。
1.2 试验方法
1.2.1 絮凝率的测定方法[14]向100 mL量筒中依次加入70mL蒸馏水,质量分数为1%的CaCl25mL,培养液2 mL,最后定容至100 mL。称取0.40 g高岭土放入200 mL的烧杯中,然后将量筒中的溶液加入烧杯,调节pH值到8.0左右。使用六连搅拌器以200 r/min速度搅拌30 s,再以50 r/min速度搅拌5 min,在静置10 min后,使用分光光度计测定上清液在波长为550 nm处的吸光度,以蒸馏水代替CaCl2和培养液溶液,作为对照。计算待测样品的絮凝率。
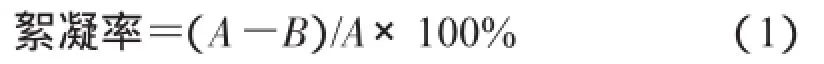
式中,A为对照上清液550 nm处吸光度;B为样品上清液550 nm处吸光度。
1.2.2 微生物絮凝剂产生菌的分离筛选将样品制成稀释液分别接种于1.1.4的3种分离培养基中富集培养,然后将菌液稀释成10-5,10-6,10-7倍,在相应的培养基平板上划线,待菌落长出,再挑取单菌落于相应的平板培养基中纯化。将分离出的菌株编号,然后接种到标有相应编号的发酵培养基中,在恒温振荡培养箱(120 r/min,温度为30℃)中培养72 h进行初筛。再将初筛获得的有絮凝活性的菌株预发酵液分别以2%接种量接入发酵培养基中,在恒温振荡培养箱(120 r/min,30℃)中培养72 h进行复筛,测定培养液的絮凝率。将絮凝率高的菌株作为后续试验用菌株。
1.2.3 优化微生物产生絮凝剂的培养条件
1.2.3.1 培养时间对菌体生长及絮凝活性的影响将预发酵液以2%的接种量接种于8个150 mL三角瓶培养基中(每个三角瓶装有50 mL发酵液培养基),在恒温振荡培养箱(120 r/min,30℃)中培养12,24,36,48,60,72,84,96 h。
1.2.3.2 菌体生长量的测定方法[15]称量净滤纸的质量A,用此滤纸过滤50 mL的培养液,并在105℃下烘干直至恒质量B,菌体的干质量即为二者的质量之差(B-A),并换算为质量浓度单位(g/L),表示菌体生长量。
1.2.3.3 不同碳源对菌株产生絮凝剂的影响[16]在培养基其他成分不变的条件下,分别用与原培养基碳原子含量相同的葡萄糖、蔗糖、乳糖、淀粉和乙醇作为培养基的碳源。在恒温振荡培养箱(120 r/min,30℃)中培养72 h,确定最适碳源。
1.2.3.4 碳源含量对菌株产生絮凝剂的影响在培养基其他成分不变的条件下,每50 mL分别用0.5,1,1.5,2,2.5 g的葡萄糖作为微生物的碳源,在恒温振荡培养箱(120 r/min,30℃)中培养72 h,然后测定其絮凝率,确定最适碳源含量。
1.2.3.5 不同氮源对菌株产生絮凝剂的影响在培养基其他成分不变的条件下,分别用与原培养基氮原子含量相同的复合氮源:酵母膏、(NH4)2SO4、尿素、蛋白胨、NaNO3作为培养基的氮源。在恒温振荡培养箱(120 r/min,30℃)中培养72 h,确定最适的氮源。
1.2.3.6 初始pH值对菌株产生絮凝剂的影响在培养基其他条件不变的情况下,以不同的培养基初始pH值在恒温振荡培养箱(120 r/min,30℃)中培养72 h,确定最适初始pH值。
1.2.3.7 正交试验优化其他培养条件利用正交试验优化培养基初始碳氮比、培养温度、摇床转速和接种量。正交试验因素水平列于表1。

表1 培养条件优化正交试验因素与水平
1.2.3.8 最佳条件下菌株产生絮凝剂的絮凝率在最佳的培养条件下培养菌株,测定其优化条件下的絮凝率。
2 结果与分析
2.1 絮凝菌株的分离选育
试验共分离纯化出108株菌,通过初筛试验,确定有8株菌具有絮凝活性,对其进行复筛并测定其絮凝率,结果列于表2。

表2 絮凝菌株复筛结果
从表2可以看出,絮凝率较高的2株菌分别为PY-M3和PY-F6,其絮凝率分别为92.57%和95.95%。因此,将PY-M3和PY-F6作为后续试验的研究对象。
2.2 菌株产生絮凝剂培养条件的优化
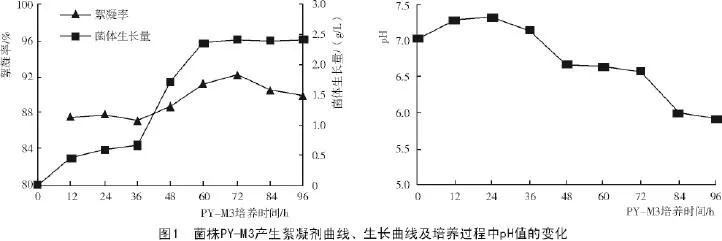
2.2.1 培养时间对菌体生长及絮凝活性的影响从图1可以看出,菌株PY-M3发酵液絮凝率与菌体生长量不具有相关性。菌株PY-M3的生长量在36~60 h生长最迅速,随后进入稳定期,几乎不再增加;而发酵液絮凝率在36~72 h中不断提升,72 h达到最高,为91.2%,随后下降,可能是由于菌体在后期生长过程中合成的某种分泌物降解了絮凝活性物质,从而导致絮凝率下降。从pH值的变化曲线可以看出,培养初期,pH值略有上升,从24 h开始,随着培养时间的延长,pH值呈阶梯性下降,可能是因为菌体会分泌某种碱性物质,所以初期pH值上升,而菌体利用碳源的过程中产生了酸,随着培养时间的延长,菌体数目不断增大,酸性物质也不断增多,从而导致培养基pH值不断下降。综上所述,72 h为菌株PY-M3的最佳产生絮凝剂的时间。
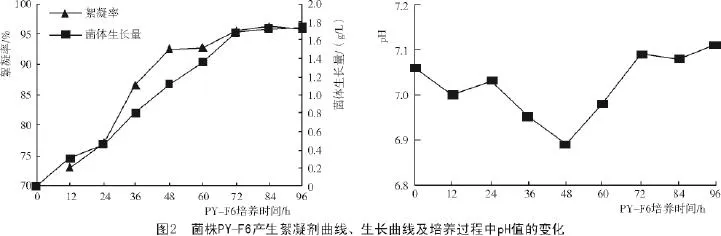
从图2可以看出,在72 h前菌体生长量迅速增加,发酵液的絮凝率随菌体生长量的增加同步升高,在菌体生长稳定期84 h时,絮凝活性达到最高,絮凝率达96.2%。可以看出,菌体生长与絮凝活性物质的产生呈明显的正相关,表明引起絮凝的活性物质是由微生物合成分泌到体外的,而不是细胞自融造成的[17]。当进入菌体生长的衰亡期,不再产生絮凝物质,絮凝率随之也不再提升。pH值在整个培养过程中变化幅度不大,前48 h pH值下降,之后回升趋于稳定,这可能是由于微生物利用葡萄糖产生了酸,使pH值下降,而絮凝活性物质的增加伴随某种碱性物质也不断增加,又导致pH值升高;当菌体进入衰亡期,絮凝活性物质稳定不再增加,使得pH值趋于稳定。综上所述,考虑到实际应用中的动力消耗,确定72 h为菌株PY-F6产生絮凝剂的最佳时间。
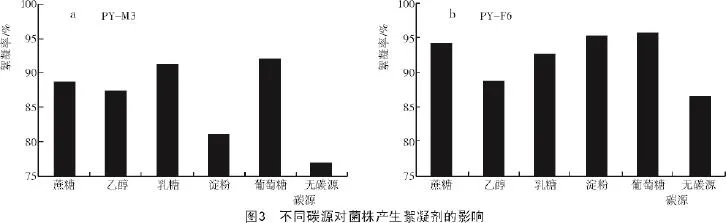
2.2.2 不同碳源对菌株产生絮凝活性物质的影响
由于不同碳源分子式不同,所以其碳原子质量分数也不同,为使碳原子含量与原培养基相等,所以不同碳源的取量不同(表3)。
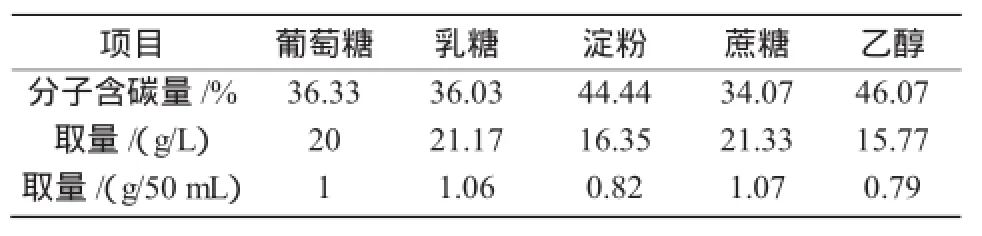
表3 不同碳源取量
从图3-a可以看出,对于菌株PY-M3,碳源为葡萄糖时絮凝率最高,达到91.89%;乳糖次之,絮凝率达到90.32%。所以,葡萄糖为菌株PY-M3的最佳碳源。
从图3-b可以看出,蔗糖、淀粉和葡糖糖作为PY-F6的碳源时均有较高的絮凝活性,尤其是葡萄糖,其絮凝率高达95%,说明菌株PY-F6对碳源的适应性较广。因此,菌株PY-F6的最佳碳源为葡萄糖。
2.2.3 不同氮源对菌株产生絮凝剂的影响氮源是微生物的重要组成部分,提供微生物细胞合成蛋白质的物质。不同氮源的分子式不同,其氮原子分子质量分数也不同,为使不同氮源的氮原子含量与原培养基相同,所以不同氮源的取量不同(表4)。
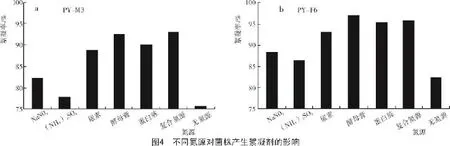
由图4-a可知,复合氮源和酵母膏作为菌株PYM3的氮源时,其絮凝率较高,均超过90%;NaNO3和(NH4)2SO4作为氮源时,菌株PY-M3絮凝率较低,甚至不足80%。表明无机氮源不利于菌株PY-M3的吸收利用。综合考虑,由于复合氮源价格低廉,所以,用复合氮源作为菌株PY-M3的最佳氮源。
从图4-b可以看出,尿素、酵母膏、蛋白胨、复合氮源作为菌株PY-F6的氮源时,其絮凝效果均较好,絮凝率都达到了90%以上,尤其酵母膏,其絮凝率高达97%。所以,选择菌株PY-F6的最佳氮源为酵母膏。
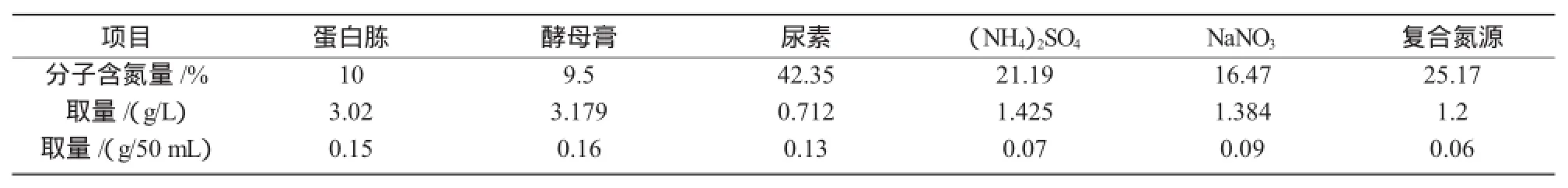
表4 各种氮源的取量
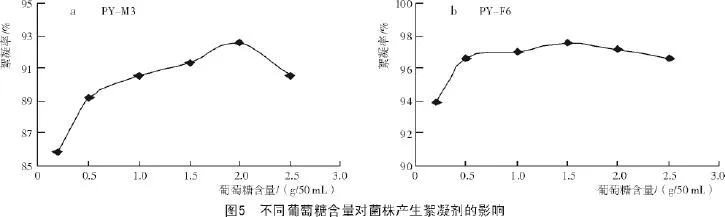
2.2.4 碳源含量对菌株产生絮凝剂的影响由图5-a可知,随着葡萄糖含量的增加,菌株PY-M3的絮凝率也不断提升,在葡萄糖含量为2 g/50 mL时,其絮凝率最高,达到92.6%,随后迅速下降。由图5-b可知,菌株PY-F6随着葡萄糖含量的增加,其絮凝率不断提升,在葡萄糖含量为1.5 g/50 mL时,其絮凝率最高,达到97.5%,而在0.5 g/50 mL时,其絮凝率就已达到96.6%。综合考虑,2 g/50 mL为PY-M3的最佳碳源含量;0.5 g/50 mL为PY-F6的最佳碳源含量。
2.2.5 发酵培养基初始pH值对菌株产生絮凝剂的影响由图6-a可知,菌株PY-M3发酵液的絮凝活性受培养基初始pH值影响较大,当pH值为6.5~8.5时,该菌株产生的絮凝剂具有较好的絮凝活性,絮凝率达到90%;当pH值为7.0时,絮凝活性最高,絮凝率达92.6%;而在碱性条件下,该菌株产生的絮凝剂的絮凝活性受到严重抑制,絮凝率迅速下降,最低不足50%。所以,菌株PY-M3产生絮凝剂的最适pH值为7.0。
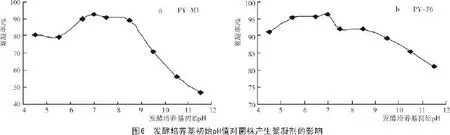
由图6-b可知,菌株PY-F6发酵液的絮凝活性受培养基初始pH值影响相对较小,当pH值为4.5~8.5时,该菌株产生的絮凝剂均有较高的活性,其絮凝率维持在90%以上;当pH值为7.0时,其絮凝率最高,达到96.2%;但在过碱的条件下,其絮凝活性明显受到抑制。因此,菌株PY-F6产絮凝剂的最适pH值为7.0。
2.2.6 正交试验优化培养基成分配比和其他培养条件通过比较4个因素的R值可知,对菌株PY-M3产絮凝剂的影响程度由大到小依次为接种量>摇床转速>培养温度>碳氮比值(表5)。
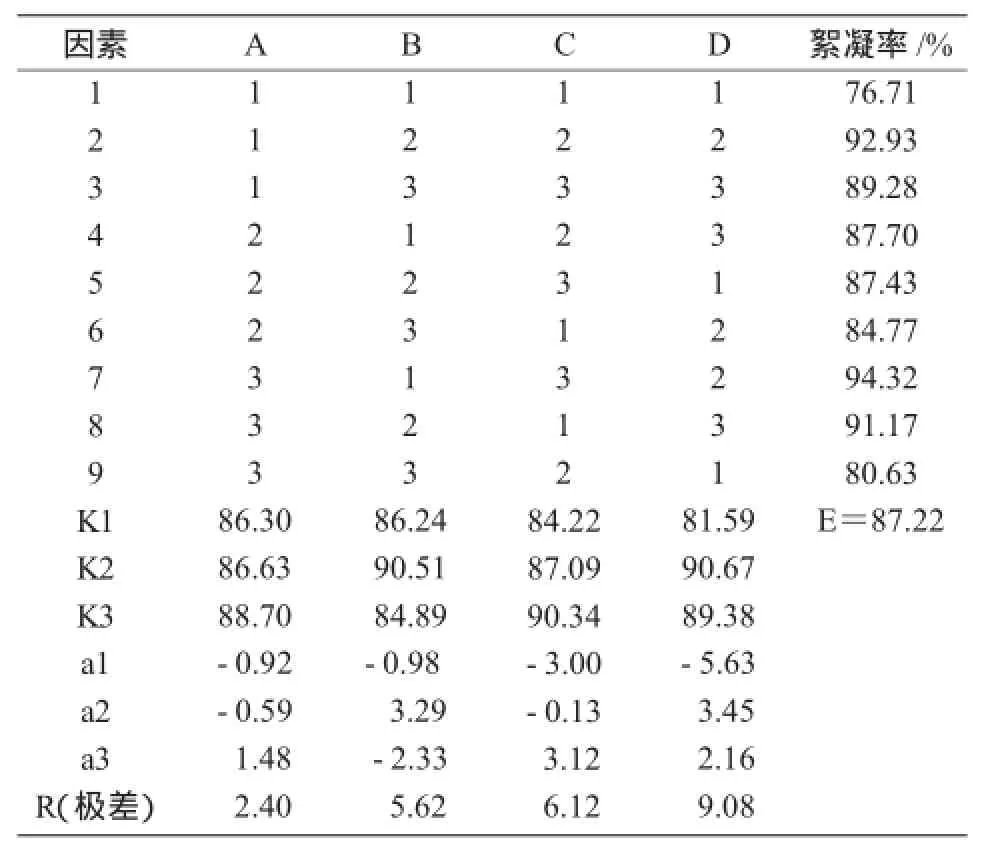
表5 菌株PY-M3培养条件优化正交试验结果
从表6可以看出,接种量(因素D)对菌株PY-M3产生絮凝剂有显著影响,另外3个因素对菌株产生絮凝剂没有显著差异,间接表明,该菌株对碳氮比、温度、转速有较宽的适应范围。结合因素水平趋势(图7)和表5中的K值(各因素各水平絮凝率平均值)可知,各因素最佳水平是A3B2C3D2,即碳氮比值45,培养温度30℃,摇床转速180 r/min,接种量2%。
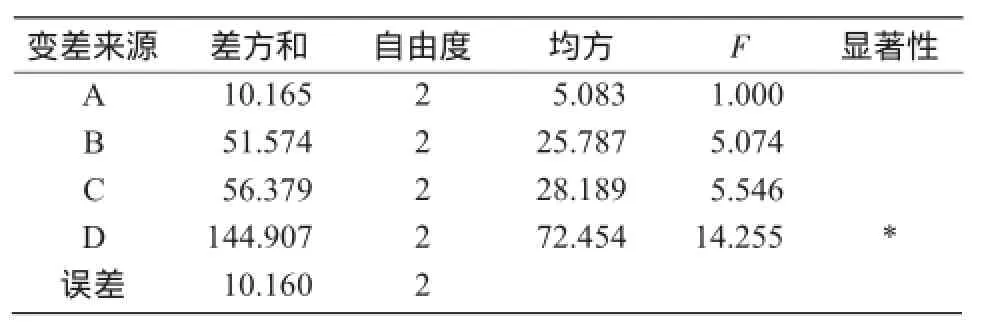
表6 菌株PY-M3正交试验方差分析
通过比较4个因素的R值可知,对菌株PY-F6产生絮凝剂的影响程度由大到小依次为摇床转速>碳氮比>培养温度>接种量(表7)。
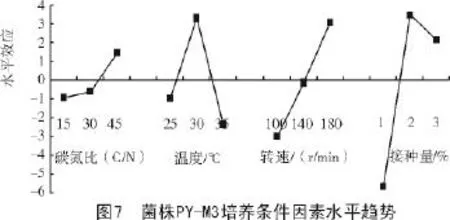
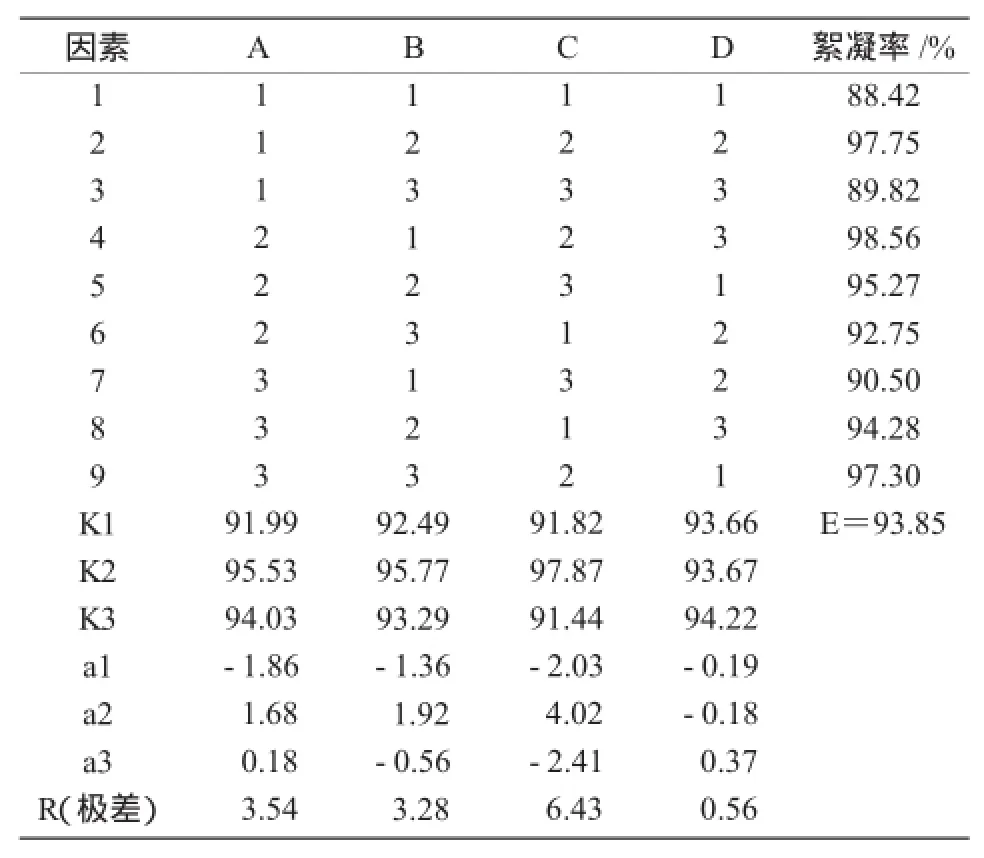
表7 菌株PY-F6培养条件优化正交试验结果
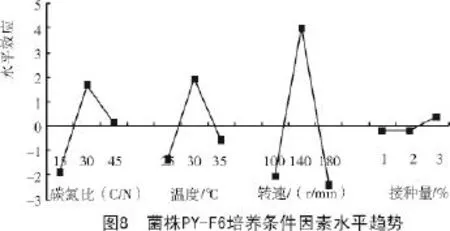
由表8可知,转速(因素C)对菌株PY-F6产絮凝剂具有极显著影响,碳氮比(因素A)和温度(因素B)对菌株PY-F6产生絮凝剂具有显著影响,接种量(因素D)影响不显著。结合因素水平趋势(图8)和表7中的K值(各因素各水平絮凝率平均值)可知,各因素最佳水平是A2B2C2D3,即碳氮比值30,培养温度30℃,摇床转速140 r/min,接种量3%。
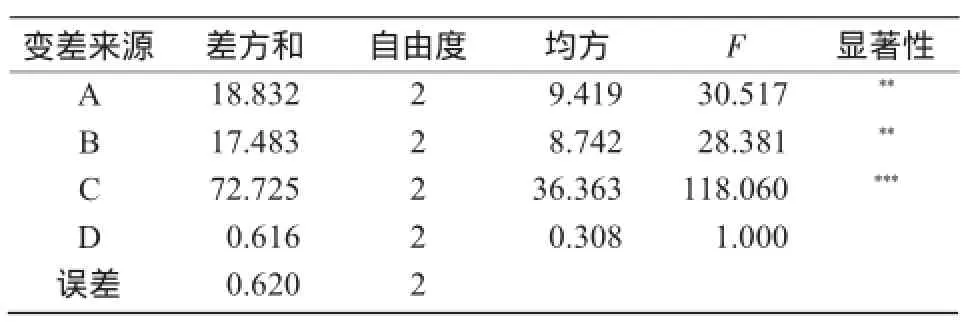
表8 菌株PY-F6正交试验方差分析
2.2.7 最佳优化条件下菌株产生絮凝剂的絮凝率
从表2,9可以看出,菌株PY-M3在最佳条件下培养,其发酵液絮凝率从92.57%提高到94.43%;菌株PY-F6在最佳条件下培养,其发酵液絮凝率从95.95%提高到98.61%。
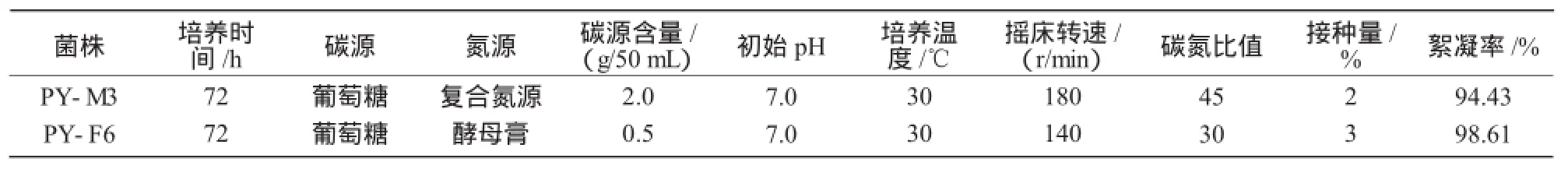
表9 最佳优化条件下菌株的絮凝率
3 结论
通过常规细菌分离法从样品中共分离出108株菌体,并采用高岭土悬浊液检验其絮凝能力,进而得到8株具有絮凝能力的菌体。在此基础上,进行复筛,最终获得2株絮凝能力强且稳定性好的菌株:PY-M3和PY-F6。
菌株PY-M3的最佳培养条件为:培养时间72 h;碳源为葡萄糖,含量为2 g/50 mL;氮源为复合氮源;培养基初始pH值为7.0;培养温度为30℃;摇床转速180 r/min;碳氮比值45;接种量2%。在最佳培养条件下,其发酵液絮凝率从92.57%提高到94.43%。菌株PY-F6的最佳培养条件为:培养时间72 h;碳源为葡萄糖,含量为0.5 g/50 mL;氮源为酵母膏;培养基初始pH值为7.0;培养温度为30℃;摇床转速140 r/min;碳氮比值30;接种量值3%。在最佳培养条件下,其发酵液絮凝率从95.95%提高到98.61%。
[1]ZhangX H,Liss,YangG W,et al.Preparation of flocculant producing microorganism and property analysis of microbial flocculant[J]. Safety and Environmental Eengineering,2008,15(4):39-42.
[2]周云,刘英,张志强,等.微生物絮凝剂制备的研究性进展[J].环境污染与防治,2014,36(4):80-85,91.
[3]王兰,唐静,赵璇.微生物絮凝剂絮凝机理的研究方法[J].环境工程学报,2011,5(3):481-489.
[4]张悦周,吴耀国,胡思海,等.微生物絮凝剂的研究与应用进展[J].化工进展,2008,27(3):340-348.
[5]陈秀莉,侯永平.微生物絮凝剂的发展趋势及应用研究[J].阴山学刊:自然科学版,2008,22(1):56-62.
[6]王劲松,胡勇有.微生物絮凝剂促进厌氧污泥颗粒化及其机制的研究[J].环境科学学报,2005,25(3):361-367.
[7]张娜,尹华,秦华明,等.微生物絮凝剂改善城市污水厂浓缩污泥脱水性能的研究[J].环境工程学报,2009,3(3):525-529.
[8]李静,马放,赵光,等.利用沼液制备微生物絮凝剂及产絮条件优化[J].中国给水排水,2014,30(5):14-19.
[9]Nakamura Junji.Screening,isolation,and some properties of microbial cell flocculants[J].Agri Biol Chem,1976,40(2):377-381.
[10]高艺文,李伟斯,李政,等.高效微生物絮凝剂产生菌GL-6发酵条件优化及对含油废水处理的研究[J].化学与生物工程,2015,32(9):54-56.
[11]张本兰.新型高效无毒水处理剂:微生物絮凝剂的开发与应用[J].工业水处理,1996,16(1):7-8.
[12]邓德丰.废水之絮凝作用与COD去除率[J].屏东科技大学学报,1999,8(1):9-26.
[13]沈萍,范秀容,李广武,等.微生物学实验[M].北京:高等教育出版社,1999:40-41.
[14]魏炜,霍石磊,李佳,等.高效微生物絮凝剂的研究及应用[J].沈阳建筑大学学报:自然科学版,2011,27(2):351-367.
[15]胡子全,赵海泉.一株有机解磷菌的筛选及其最佳生长条件的研究[J].中国给水排水,2007,23(17):66-71.
[16]石璐.高效微生物絮凝剂产生菌的筛选及培养条件研究[D].湘潭:湘潭大学,2003:29-30.
[17]Stephen R Robinson,Glenda M Bishop.Aβ as a bioflocculant: implications for the amyloid hypothesis of Alzheimer's disease[J]. Neurobiology of Aging,2002,23:1051-1072.
Isolation and Breeding of High Efficient Flocculant Producing Strains and Optimization of Its Culture Conditions
ZHANG Hai,QU Rui-juan,LI Ri-qiang
(College of Environment and Resources,Shanxi University,Taiyuan 030006,China)
The study was undertaken to investigate the best culture conditions of flocculant producing microbial,thus increasing flocculating rate.The samples were collected from10-15 cm depth corn-soil in Jinyang lake and Pingding county in Shanxi province.By routine bacteria separation and Kaolin suspension method,two effective strains PY-M3 and PY-F6 were screened.Optimization of PY-M3 culture condition test showed that culture time was 72 h;the most suitable carbon source was glucose,with 2 g/50 mL concentration;nitrogen source was complex nitrogen and C/N was 45;medium initial pH was 7;culture temperature was 30℃;agitation rate was 180 r/min and inoculation quantity was 2%.Under the best culture conditions,flocculation rate increased from 92.57%to 94.43%.Optimization of PY-F6 culture condition test showed that carbon source was glucose,with 0.5 g/50 mL;nitrogen source was yeast extract and C/Nwas 30;culture time was 72 h;medium initial pH was 7;culture temperature was 30℃;agitation rate was 140 r/min and the inoculation quantity was 3%.As a result,the flocculation rate was increased from95.95%to98.61%.
microbial flocculant;flocculantion rate;culture condition optimization
X172
A
1002-2481(2016)02-0222-07
10.3969/j.issn.1002-2481.2016.02.24
2015-11-19
张海(1988-),男,山西太原人,在读硕士,研究方向:环境工程水处理。李日强为通信作者。

