泰妙菌素生产菌种原生质体制备条件优化
杨 智, 孙金刚, 牛 春, 张 萍
(宁夏泰瑞制药股份有限公司,宁夏银川 750101)
泰妙菌素生产菌种原生质体制备条件优化
杨 智, 孙金刚, 牛 春, 张 萍
(宁夏泰瑞制药股份有限公司,宁夏银川 750101)
[目的]探讨泰妙菌素生产菌种原生质体的最优制备方法。[方法]通过对原生质体制备条件进行优化,建立泰妙生产菌种原生质体制备体系。[结果]优化后制备条件:以培养3 d的菌丝体为材料,将其置于含质量浓度0.10%溶壁酶、0.60 mol/L MgSO4的酶液中,25 ℃酶解3.0~3.5 h,将酶解液用G2砂芯漏斗过滤,滤液即为原生质体悬液。采用该方法,泰妙生产菌种原生质体制备率达1.5×106个/mL。[结论]试验结果为提高泰妙菌素生产菌种的产量提供了理论依据。
泰妙菌素;原生质体;溶壁酶
延胡索酸泰妙菌素是新型兽用抗生素,对支原体及部分革兰氏阳性菌有良好的抗菌活性[1],主要用于防治猪支原体肺炎、猪密螺旋体痢疾、鸡慢性呼吸道疾病。该菌种遗传背景资料较少,目前常采用诱变的手段进行育种研究。原生质体是诱变试验的良好材料,对射线和化学诱变剂敏感,有利于提高突变率。笔者研究了泰妙菌素生产菌种原生质体(以下简称泰妙原生质体)的制备方法,以期为提高泰妙生产菌种的产量提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌。泰妙菌素生产菌(Clitopilusprunulus)TMII14-28由宁夏泰瑞制药股份有限公司菌种研究室保藏。
1.1.2 主要试剂。葡萄糖、KH2PO4、MgSO4·7H2O、琼脂、溶壁酶(上海蓝季科技发展有限公司)、蜗牛酶(上海华蓝化学科技有限公司)、纤维素酶。
1.1.3 主要仪器。LDZX-75KBS立式蒸汽压力灭菌器(上海申安医疗器械厂)、YT-CJ-2N双人双面净化工作台(北京亚泰科隆仪器技术有限公司)、HZQ-F280全温振荡培养箱(江苏省太仓市华美生化仪器厂)、PSX智能型恒温恒湿培养箱(浙江省宁波莱福科技有限公司)。
1.1.4 培养基。斜面培养基:马铃薯(浸提液)200 mg/g,葡萄糖20 mg/g,琼脂20 mg/g,pH 6.50。种子瓶培养基:马铃薯(浸提液)200 mg/g,葡萄糖20 mg/g,pH 6.50。
1.2 方法
1.2.1 菌丝体的培养。取斜面培养基上3 cm2菌丝体置于组织研磨器中,充分研磨至无片状菌丝,将菌悬液接种到种子瓶培养基中,25 ℃、220 r/min振荡培养3 d。
1.2.2 渗透液的配制。以磷酸盐缓冲液(pH 6.86)为溶剂,配制终浓度为0.60 mol/L的MgSO4作为渗透液。
1.2.3 酶液的配制。以渗透液为溶剂配制终质量浓度为0.10%的溶壁酶溶液,用0.45 μm滤膜过滤除菌,现用现配。
1.2.4 原生质体的制备。取20 mL培养3 d的种子液,3 000 r/min离心10 min,收集菌丝。将20 mL过滤除菌的酶液加入到上述菌丝中,25 ℃酶解3.0~3.5 h,期间每隔0.5 h振荡混匀1次,最后用G2砂芯漏斗过滤,收集滤液。用渗透液稀释后,血球计数板计数。
1.2.5 泰妙菌种对数生长期的确定试验。将处于对数生长期中期的菌丝制备成原生质体,其复苏率最高,所以试验首先是确定泰妙菌丝体的对数生长期。以泰妙斜面菌丝为材料,接种36瓶,每隔12 h测定1次菌丝浓度,绘制生长曲线,确定菌种的对数生长期。
1.2.6 工作酶类型的确定试验。选择纤维素酶、蜗牛酶、溶壁酶以及这3种酶的两两组合,作为工作酶。酶质量浓度均为0.10%,pH为6.80,温度为25 ℃,酶解时间为4.0 h,渗透液为0.60 mol/L MgSO4。期间每隔0.5 h振荡混匀1次,最后显微镜观察菌丝水解情况。显微镜放大倍数为10×100。
1.2.7 渗透液浓度的确定试验。用MgSO4配制不同浓度的渗透液,筛选适合泰妙原生质体的渗透液浓度。
1.2.8 原生质体分离方法的确定试验。选择4种方法,筛选适合泰妙菌种的原生质体分离方法,分别是:①将制备好的原生质体悬液500 r/min离心10 min,收集沉淀;②将制备好的原生质体悬液3 000 r/min离心10 min,收集沉淀;③将制备好的原生质体悬液3 000 r/min离心10 min,收集沉淀,用等量渗透液完全溶解沉淀,重复离心,再收集沉淀,即用渗透液清洗1次沉淀,去除残留的工作酶;④将制备好的原生质体悬液用G2砂芯漏斗过滤,收集滤液。处理后显微镜观察,显微镜放大倍数为10×100。
1.2.9 酶解时间的确定试验。以0.5~4.0 h为酶解时间,每隔0.5 h取样1次,观察结果,确定酶解时间。酶质量浓度为0.04%,渗透液浓度为0.60 mol/L,溶壁酶浓度为0.10%,pH 6.80,温度为25 ℃。
1.2.10 酶浓度的确定试验。为提高原生质体得率,对溶壁酶质量浓度进行优化,设计0.04%、0.10%、1.00%共3个梯度。其他条件:pH 6.80,温度为25℃,渗透液为0.60 mol/L MgSO4,酶解时间为3.0~3.5 h。1.2.11 优化条件验证试验。对上述结果进行验证,泰妙原生质体制备条件:工作酶为溶壁酶,质量浓度为0.10%;渗透液为0.60 mol/L MgSO4;pH 6.80;温度 25 ℃;酶解时间3.0~3.5 h;分离方法为G2砂芯漏斗过滤。通过血球计数板计数。2 结果与分析
2.1 泰妙菌种对数生长期的确定 由图1可知,泰妙生产菌种的对数生长期为接种后46~103 h,选择72 h,即处于对数生长期中期的菌丝为材料,制备原生质体。
2.2 工作酶类型的确定 结果显示,只有单独使用溶壁酶能获得泰妙原生质体,获得的原生质体数量为1.2×105个,所以将溶壁酶作为工作酶。溶壁酶与其他2种酶组合时,未获得原生质体,是因为试验使用的蜗牛酶和纤维素酶均为复合酶,其含有的蛋白酶将溶壁酶分解,使溶壁酶失去活性。单独使用溶壁酶的酶解效果较好,这与陈鹏等[2]、张炳炽[3]、Hongg[4]、Cheng等[5]的研究结果一致。
2.3 渗透液浓度的确定 泰妙原生质体失去了细胞壁的保护,由于胞内为高渗状态,很容易吸水从而导致细胞破裂。因此,制备原生质体时需要环境提供合适的渗透压力,以保证原生质体的完整,防止细胞死亡。
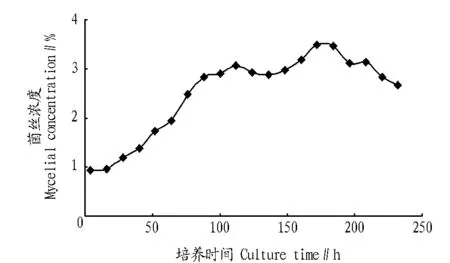
图1 泰妙菌种生长曲线Fig.1 The growth curve of Tiamulin production strains
结果表明:以0.55~0.80 mol/L MgSO4作为渗透液,均可以获得再生单菌落,其中在0.60 mol/L 浓度下再生的单菌落数量最多,为21,所以选择0.60 mol/L MgSO4作为渗透液。
2.4 原生质体分离方法的确定 结果表明,G2砂芯漏斗过滤法是可行的泰妙原生质体分离方法(图2)。500 r/min离心10 min,离心力小,不能达到分离的目的,该方法甚至未获得固形物,所以不适合泰妙原生质体的分离。3 000 r/min离心10 min获得固形物,但没有观察到原生质体,可能是因为离心过程中原生质体破碎。

注:a.500 r/min离心10 min;b.3 000 r/min离心10 min;c.3 000 r/min离心10 min,渗透液清洗1次;d.G2砂芯漏斗过滤。Note:a.500 r/min centrifuge for 10 min;b.3 000 r/min centrifuge for 10 min;c.3 000 r/min centrifuge for 10 min,and cleaning penetrant for one time;d.Filtering by G2 sand core funnel.图2 原生质体分离显微镜观察结果Fig.2 Microscope observation result of protoplast separation
2.5 酶解时间的确定 由图3可知,当酶解时间在3.0~3.5 h,反应趋于平衡,且有大量原生质体释放到渗透液中,再生的单菌落数量符合试验要求。因此,酶解时间确定为3.0~3.5 h。2.6 酶质量浓度的确定 由图4可知,3个质量浓度条件下,均能观察到原生质体,其中在0.10%和1.00%质量浓度条件下,原生质体数量较多。考虑到试验成本,确定溶壁酶质量浓度为0.10%。
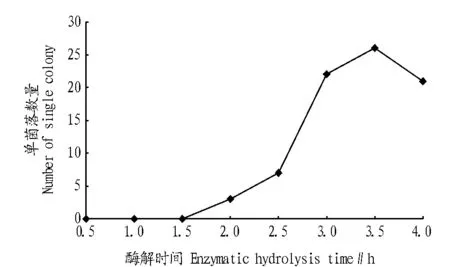
图3 酶解时间试验结果Fig.3 Result of enzymatic hydrolysis time experiment
2.7 优化条件验证 结果表明,采用该方法制备的原生质体浓度为1.5×106个/mL。该研究建立的泰妙原生质体制备体系高效、可靠,能够清晰地观察到原生质体(图5),与文献报道一致[6]。
3 结论与讨论
通过对泰妙原生质体制备过程中各个步骤进行优化,最终确定:①菌丝体。采用种瓶培养3 d的菌丝,取20 mL菌丝体于无菌离心管中,3 000 r/min离心10 min,收集沉淀。②酶液。酶液为质量浓度0.10%溶壁酶、0.60 mol/L MgSO4,用磷酸盐缓冲液(pH 6.86)溶解,配制好后用0.45 μm滤芯过滤除菌。 ③酶解条件。向上述菌丝体加入20 mL酶液,25 ℃酶解3.0~3.5 h,期间每隔0.5 h振荡混匀1次。④原生质体分离方法。采用G2砂芯漏斗过滤分离。采用该方法制备的泰妙原生质体浓度为1.5×106个/mL。
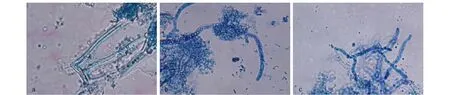
注:a.0.04%溶壁酶;b.0.10%溶壁酶;c.1.00%溶壁酶。 Note:a.0.04% dissolve enzyme;b.0.10% dissolve enzyme;c.1.00% dissolve enzyme.图4 溶壁酶质量浓度试验显微镜观察结果Fig.4 Microscope observation result of dissolve enzyme concentration experiment
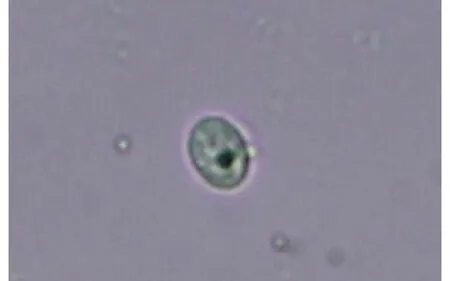
图5 原生质体显微镜观察结果Fig.5 Microscope observation result of protoplast
该研究采用对数生长期中期的菌丝体为材料,开展原生质体制备试验。对数期的菌丝细胞壁薄且成分相对简单,有利于酶解反应的进行[7]。采用伞菌科真菌制备原生质体时,广泛使用的溶壁酶为工作酶[3,7-8]。溶壁酶为复合型酶,具有β-葡聚糖酶、几丁质酶、蛋白酶活性[7-8],能有效破除泰妙菌丝细胞壁。该研究通过浓度梯度试验,确定渗透液浓度为0.60 mol/L。合适的渗透液浓度有利于原生质体的稳定及得率的提高[7]。
[1] 黄贺贤,曾振灵,黄显会.截短侧耳素类抗生素——泰妙菌素的研究进展[J].中国兽药杂志,2010,44(6):42-45.
[2] 陈鹏,郭成金.金针菇原生质体制备和再生探究[J].江苏农业科学,2014,42(9):200-204.
[3] 张炳炽.金针菇原生质体制备和再生条件实验[J].山东师范大学学报(自然科学版),1990,5(3):74-77.
[4] HONGG S W.Formation and regeneration of protoplasm inLentinusedodes[J].Mushroom newsletter for the tropics,1988,5(4):1-3.
[5] CHENG Y,BÉLANGER R R.Protoplast preparation and regeneration from spores of the biocontrol fungusPseudozymaflocculosa[J].FEMS Microbiology Letters,2000,190(2):287-291.
[6] 董汪洋,王郑隆,杨云乔,等.杏鲍菇的菌株筛选与原生质体制备条件优化[J].浙江农业学报,2015,27(5):782-786.
[7] 王鑫,车振明,黄韬睿.原生质体融合技术在微生物菌种选育中的应用[J].食品研究与开发,2008,29(10):174-176.
[8] 李艳丽.原生质体技术筛选刺芹侧耳高产多糖和漆酶菌株的研究[D].长春:吉林农业大学,2012.
Optimization on Protoplast Preparation Conditions of Tiamulin Producing Strain
YANG Zhi, SUN Jin-gang, NIU Chun et al
(Ningxia Tairui Pharmaceutical Company Co., Ltd.,Yinchuan,Ningxia 750101)
[Objective] The aim was to explore the optimal protoplast preparation method of Tiamulin producing strain.[Method] We established a system for protoplast preparation of Tiamulin producing strain by optimizing protoplast preparation conditions. [Result] The opotimal conditions were as followed:used 3 days cultured mycelium as material;put it into a solution which contain 0.10% lyticase, 0.60 mol/L MgSO4; hydrolyzed the mycelium with enzyme under 25 ℃ for 3.0-3.5 hours, then filtered the solution with G2 sintered discs;the filter liquor was protoplast suspension. By using this method, the protoplast preparation rate of Tiamulin producing strain could reach 1.5×106per milliliter.[Conclusion] The results provide theoretical basis for the improvement of Tiamulin producing strain.
Tiamulin;Protoplast;Lyticase
杨智(1987- ),男,宁夏石嘴山人,助理工程师,硕士,从事分子生物学研究。
2016-09-28
S 859.79+6
A
0517-6611(2016)35-0005-03

