过氧化氢(H2O2)对PC12细胞的氧化应激损伤的研究
赵立理,张振昶,苏 刚,关智媛,姚春荣,石正洪*
(1.兰州大学第二附属医院神经内科,甘肃 兰州 730000;2.兰州大学基础医学院遗传所,甘肃 兰州 730000;3.兰州大学第二临床医学院,甘肃 兰州 730000;4.甘肃省平凉市妇幼保健院,甘肃 平凉 744000)
脑神经系统是人体最精密,复杂的器官,并控制着躯体其他器官的功能等[1]。神经系统疾病是由于感染,肿瘤,血管病变,外伤,中毒,免疫障碍,变性,遗传,先天发育障碍,代谢等引起的疾病。而脑神经系统疾病的发病率全球与日俱增,据报道现有150万人患有神经系统疾病[2]。脑血管病具有较高的发病率,致残率,死亡率[3]。近年来,氧化应激(oxidative stress)等非传统风险因素已成为脑卒中的研究焦点,因为氧化应激反应始终贯穿于脑卒中发展的整个病理过程,且是早期发生,故目前诸多学者着眼于脑血管疾病的氧化应激机制的研究[4]。增强机体抗氧化应激能力为防治急性脑卒中的重要措施之一。大鼠肾上腺嗜铬细胞系(pheochromocytoma cells,PC12)是一种很好的研究神经细胞生理,病理及药理的模型[5]。本文采用了H2O2造成PC12细胞氧化应激损伤,通过观察细胞形态的变化,MTT检测及相关氧化应激指标MDA,SOD的检测,Hoechest 33258凋亡检测,及H2O2的作用下PC12细胞周期变化,来证明H2O2对PC12细胞的氧化应激损伤。
1 资料与方法
1.1 一般资料
H2O2(由Sigma公司购买),1640(Gibico),小牛血清(BI),超氧化物歧化酶(SOD),丙二醛(MDA)试剂盒,均购于南京建成生物技术研究所,批号(SOD A001-3,MDA A003-4)MTT(sigma公司)
1.2 仪器
超净工作台,流式细胞仪,超低温-80℃冰箱(美国赛默飞世尔科技公司生产);脱色摇床(沃德生物医学仪器公司生产),恒温水浴箱(天津艾薇欧科技发展有限公司生产);台式冷冻高速离心机(上海安亭科学仪器公司生产)。
1.3 方法
PC12氧化应激损伤模型的建立。
1.3.1 MTT法检测细胞活力
取对数生长期PC12细胞,用含10%小牛血清的RPIM-1640完全培养液配成1×105个/mL单细胞悬液,接种于96孔板中,每孔100 uL,每组设6个平行孔,实验分为3组,阴性对照组:不加药物仅加基础培养液;药物组:分为5组,各组所加的H2O2浓度分别为200,100,50,25,12.5 mmol/L。空白组:不加药物,而仅以RPIM-1640基础培养液代替细胞。将以上的对照组,空白组,药物组置于37.5℃,5%的CO2,相对湿度为95%培养箱中培养2,4,6 h后在每个实验孔中加入MTT20 uL,孵育结束时弃上层清液,加入DMSO150 uL,用酶标仪570 nm波长处测定吸光度(A)值。各组细胞存活率按照如下公式计:细胞存活率=(测定组OD值一测定空白管OD值)/(正常组O值一测定空白管OD值)×100%。
1.3.2 细胞形态学的观察,倒置显微镜下观察细胞形态
1.3.3 细胞核Houchest33258凋亡染色
取盖玻片在70%乙醇中浸泡5 min,将其放在六孔内,约为50%~80%。200,100,50,25,12.5 umol/mL的H2O2作用4 h后,每孔加入0.5 mL的固定液,固定10 min或更长时间(可4℃过夜)去固定液,用PBS洗两遍。加入0.5 mL的Hoechst33258染色液,染色5 min,去染色液,用PBS洗两遍,滴一滴抗荧光碎灭封片液于载玻片上,盖上贴有细胞的盖玻片,荧光显微镜检测呈蓝色的细胞核。
1.3.4 MDA含量、SOD活性的检测,收集细胞及培养液,按照南京建成试剂盒说明书测定SOD及MDA含量。
1.3.5 流式细胞周期检测
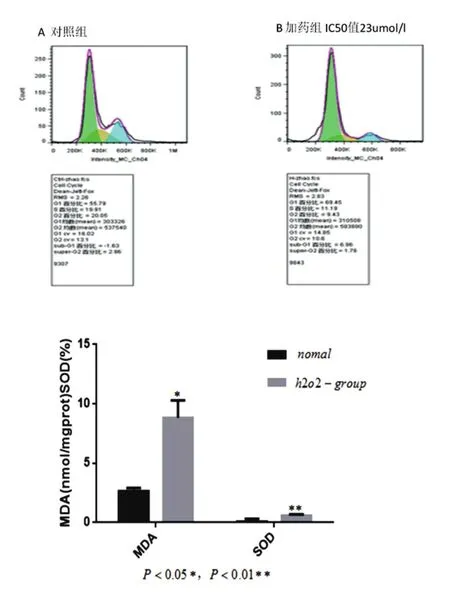
细胞铺于6孔板内,培养过夜,IC50值23 umol/mL的H2O2孵育4 h。胰酶消化细胞后,离心1500 rpm 10 min,取上清,用300 uLPBS重悬细胞,将细胞液滴加入预冷的700 uL的无水乙醇中,4度避光固定过夜,固定过的细胞1500 rpm离心10 min,弃上清,用PBS洗涤,再用含RNageA重悬细胞,37℃避光孵育30 min,加入100 ug/mL PI 500 uL,4℃避光孵育30 min。用300目孔径为40~50 unL尼龙网膜(筛网)过滤细胞。
1.3.6 结果分析
采用SPSS 19.0统计学软件对数据进行处理,采用t检验,结合布尔逻辑运算符进行处理,以P<0.05为差异有统计学意义。
2 结 果
2.1 H2O2对PC12细胞形态的影响
IC50值H2O2作用于PC12细胞,正常对照组细胞为呈长梭形的贴壁细胞, 折光度强,生长速度快。而损伤组细胞折光度减弱,细胞圆缩、脱落。
2.2 H2O2作用于PC12细胞增殖活性的影响
H2O2作用于PC12细胞的活力影响,图为200,100,50,25,12.5 mol/L的H2O2作用于PC12细胞4 h。H2O2的浓度分别为200,100,50,25,12.5 mmol/L,提示H2O2浓度为25,12.5 mmol/L时,差异有统计学意义,故其IC50值在25 mol/L到12.5 mol/L之间。
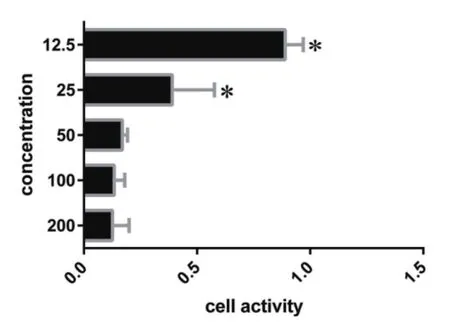
图1 为不同浓度的H2O2对PC12细胞的氧化应激损伤MTT检测,其中25 M和12.5 mM有明显的统计学意义
2.3 不同浓度梯度的H2O2对PC12细胞凋亡染色Hoechst 33258(见图2)
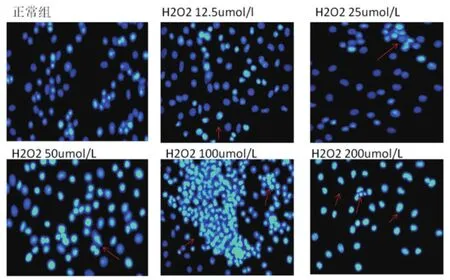
图2
2.4 细胞周期结果
与正常对照组比较,给予与IC50值的H2O2损伤后的PC12细胞后,G1期细胞增多。
2.5 H2O2对PC12细胞MDA含量和SOD活性的影响
与正常组比较,随着H2O2的浓度增加,损伤组的细胞MDA明显增加(P<0.05),SOD活力明显抑制(P<0.01)
3 讨 论
缺血性脑卒中的发病机理复杂,而在急性脑卒中发生早期4 h,为脑卒中黄金抢救时间,已证实缺血性脑卒中的发病机理中氧化应激损伤占有重要的作用,故目前多数学者着眼于缺血性脑卒中氧化应激损伤的研究。ROS是氧化应激产物,释放出的氧化应激酶可引起细胞线粒体损伤。如Cao.L.等人通过葡萄糖-6-磷酸脱氢酶(G6PD)过表达研究了G6PD在脑血管病的氧化应激损伤机制中的重要保护作用。PPP在脑血管病发生过程中起着保护神经元的作用,且会使NADPH合成增加,从而减少了rGSH的生成[6]。Zhang.Y.等人通过研究证明在脑卒中发生后的不同时间点里氧化应激损伤产生的NOX2表达不同,阐述了NOX2不是早期的脑卒中氧化应激损伤时出现的酶,而是持续再灌注损伤时重要的氧化应激酶,故此酶可以作为潜在的治疗脑卒中的作用靶点。现今H2O2诱导PC12细胞氧化应激损伤模型为公认的脑血管病氧化应激模型[7]。
本研究显示:与正常组细胞相比,损伤组的细胞存活率明显降低,且MDA释放量增加,SOD活力减弱,细胞核出现凋亡,G1期明显阻滞,而G1期为开始合成细胞生长需要的各种蛋白质,糖类,脂类及RNA等,是DNA合成预备期。我们的实验结果证明H2O2可引起PC12细胞停滞在G1,出现不分裂。且可出现细胞核明显凋亡,故为今后的神经细胞氧化应激损伤机制的研究提供的新的思路及方向,但其具体相关信号通路机制还需进一步研究及探讨。同时除了基础的细胞研究以外,还需进行临床观察与基础实验相结合,通过对脑卒中氧化应激机制的研究寻找新颖和有效的药物靶点。
[1] McKinnon PJ. Genome integrity and disease prevention in the nervous system[J]. Genes & development. 2017,31(12):1180-94.
[2] Huang L,Hu J,Huang S,Wang B,Siaw-Debrah F,Nyanzu M,et al.Nanomaterial applications for neurological diseases and central nervous system injury[J].Progress in neurobiology.2017.
[3] Feigin VL,Forouzanfar MH,Krishnamurthi R,Mensah GA,Connor M,Bennett DA,et al.Global and regional burden of stroke during 1990-2010:findings from the Global Burden of Disease Study 2010[J].Lancet (London,England).2014,383(9913):245-54.
[4] Francis A,Baynosa R.Ischaemia-reperfusion injury and hyperbaric oxygen pathways:a review of cellular mechanisms[J].Diving and hyperbaric medicine.2017,47(2):110-7.
[5] Chen L,Wei ML,Zhao JJ,Hong H,Qu W,Feng F,et al.GTS40,an active fraction of Gou Teng-San (GTS),protects PC12from H2O2-induced cell injury through antioxidative properties[J].Chinesejournal of natural medicines.2017,15(7):495-504.
[6] Cao L,Zhang D,Chen J,Qin YY,Sheng R,Feng X, et al.G6PD plays a neuroprotective role in brain ischemia through promoting pentose phosphate pathway[J].Free radical biology & medicine.2017.
[7] Che H,Fu X,Zhang L,Gao X,Wen M, Du L,et al.Neuroprotective Effects ofn-3 Polyunsaturated Fatty Acid-Enriched Phosphatidylserine Against Oxidative Damage in PC12 Cells[J].Cellular and molecular neurobiology.2017.

