遗传性远端肾小管性酸中毒合并耳聋相关基因Atp6v0a4在小鼠内耳发育过程中的表达
刘亚青李琦辛凤袁永一
1南京医科大学附属儿童医院耳鼻咽喉-头颈外科(南京 210008) 2解放军总医院耳鼻咽喉头颈外科(北京100853)
·基础研究·
遗传性远端肾小管性酸中毒合并耳聋相关基因Atp6v0a4在小鼠内耳发育过程中的表达
刘亚青1,2李琦1辛凤2袁永一2
1南京医科大学附属儿童医院耳鼻咽喉-头颈外科(南京 210008) 2解放军总医院耳鼻咽喉头颈外科(北京100853)
目的常染色体隐性遗传远端肾小管酸中毒是一种严重的酸碱平衡紊乱性疾病,常常合并有感音神经性聋,ATP6V0A4被证实是其致病的相关基因,目前仍不明确致病机制。我们拟通过研究Atp6v0a4在不同发育阶段小鼠的内耳表达来探究ATP6V0A4在听觉系统形成中的作用。方法 选择不同发育时期健康的昆明小鼠(E18, P1,P7,P14,P21),应用免疫荧光标记技术结合激光共聚焦显微镜观察Atp6v0a4蛋白在内耳的定位与表达。West⁃ern-blot定性定量研究该蛋白在不同时期小鼠内耳蛋白表达变化。结果 Atp6v0a4蛋白主要表达部位为耳蜗内毛细胞、外毛细胞、血管纹、内淋巴囊以及螺旋神经节,且在不同发育阶段表达位置稳定。Western-blot结果提示Atp6v0a4在小鼠内耳广泛表达,在不同发育阶段,Atp6v0a4在Corti’s器及螺旋神经节及血管纹中表达相对稳定,而在前庭组织中表达下降。结论 通过对不同发育阶段的小鼠耳蜗切片进行Atp6v0a4蛋白表达分析研究,明确了Atp6v0a4在小鼠内耳的表达,为深入研究Atp6v0a4在内耳发育过程中的作用和致聋机制奠定了基础。
Atp6v0a4;表达定位;内耳
Fund projects:The National Natural Science Foundation of China(81371098);Project of Natural Science Foundation of Beijing (7132177);Jiangsu provincial key research and development of special funds(BE2015608);Science and education in Jiangsu province key medical personnel(RC2011028);Jiangsu Province,"the 333 high-level personnel training project"fund(2015);The peak of six talents in Jiangsu Province(2015-wsw-063).
Declaration of interest:The authors report no conflicts of interest.
耳聋是严重影响人类社会交流和生活质量的常见疾病之一。早期耳聋可导致患儿言语功能发育障碍,为家庭和社会带来沉重的负担。遗传性耳聋根据是否伴有听觉系统以外其他系统病变的临床表现可分为两大类,即综合征性聋(Syndromic Hearing Loss,SHL)和非综合征性聋(Nonsyndromic Hearing Loss,NSHL),前者指除了耳聋以外,还同时存在眼、肾、骨、皮肤等其他部位的病变,此类耳聋约占遗传性聋的30%;而后者则只出现耳聋的症状,无其他系统病变表现,在遗传性聋中约占70%。遗传性远端肾小管性酸中毒,即经典型远端肾小管性酸中毒(经典型RTA,distal renal tubular acidosis,dRTA),该疾病因远端肾小管泌氢障碍,使得可滴定酸及尿NH4+排出减少,从而导致一系列的临床表现,如高氯性代谢性酸中毒、低钾低钙血症、尿液不能酸化等,遗传性远端肾小管性酸中毒常合并有感音神经性耳聋,ATP6V0A4被证实是其相关致病基因[1],其致病机制尚不清楚。
本研究拟进一步探究Atp6v0a4在小鼠耳蜗中的表达,及其在各个发育时期的小鼠耳蜗中表达的稳定性,我们采用免疫荧光、免疫组化及West⁃ern-blot对不同发育阶段的听力正常小鼠行蛋白表达分析,为后续的功能研究奠定基础,并为临床上早期dRTA合并感音神经性聋患儿提供有效筛查诊断和积极干预。
1 材料与方法
1.1实验动物
挑选40只健康且耳廓反应灵敏的育龄昆明小鼠作为种鼠,公母比例为1:4,合笼后,早晚定点(早8点及晚17点)观察母鼠阴栓,若有则记为0.5天(Embryo 0.5)。同样挑选耳廓反应灵敏的健康孕鼠,每日早晚定点观察生产情况(早8点及晚17点),若生产,则记为0.5天(Postnatal 0.5)。分组:实验动物按照日龄分组,每组五只,时间点分别为胚胎18天(Embryo 18,E18),出生后1天(Postna⁃tal 1),2天(P2),7天(P7),14天(P14),21天(P21)。(实验动物均由北京军事医学科学院实验动物中心提供)
1.2 标本处理
按以上分组取小鼠,断头取耳蜗,解剖显微镜下快速去移除镫骨并去除圆窗膜,用4%多聚甲醛在4℃冰箱固定至少24h,除E18耳蜗外,所有耳蜗组织均于10%EDTA中至完全脱钙,置于摇床上的固定液内洗样两次,每次至少10min,30%蔗糖溶液脱水后再次置于4℃冰箱过夜,蔗糖饱和3-5天,取出用OCT胶包埋过夜,显微镜下包埋,-20℃冰冻切片机切片,室温静置20min后置于切片盒,存储于-80℃冰箱备用。
1.3免疫荧光染色
取出冰冻切片,室温下静置约30min,0.01M PBS洗5min,30%的山羊血清0.3%Triton X-100 PBS封闭通透30min;0.01M PBS洗10min,加入1: 150一抗(anti-ATP6V0A4,ab110752,abcam)37℃孵育40min,0.01M PBS洗片三次,每次5min;加入1:1000二抗(Alexa Flour 488,HPA028918,SIGMA)37℃孵育60min,0.01M PBS洗片三次,时间分别为5min,10min,60min;分别加入 1:150一抗(an⁃ti-MYO7A,HPA028918,SIGMA;anti-Neuroflia⁃ment,ab7795,abcam),37℃40min,PBS洗3遍,各5min;加入1:1000二抗(Alexa Flour 568,Alexa Flour 568,SIGMA),37℃1h;0.01M PBS洗片三次,5min,10min,60min;加入DAPI(4,6-二脒基-2-苯基吲哚),室温作用10min;0.01M PBS洗片一次5min;甘油封片,进行共聚焦扫描成像。
1.4免疫组化
取出冰冻切片,室温下静置约30min,0.01M PBS洗片5min;加2%双氧水于37℃下作用20min,0.01M PBS洗片3次,每次5min;30%羊血清+0.3% Triton于37℃封闭60min;加入1:150一抗(an⁃ti-ATP6V0A4),4℃冰箱过夜后取出,0.01M PBS洗3次,每次5min,加入生物素化二抗,37℃下30min,0.01M PBS洗4次,每次5min;DAB显色5-10min,镜下查看染色程度,轻柔流水冲洗10min;苏木素复染1-5min流水冲洗15分钟左右,梯度酒精脱水:80%酒精脱水2分钟;95%酒精脱水2分钟;100%酒精脱水2次,每次5分钟;二甲苯透明:两次各5分钟;中性树胶封片后镜检。
1.5 Western-blot
取不同发育阶段的小鼠(P2,P7,P21)各十只,断头取出耳蜗,在解剖显微镜下去除耳蜗周围结缔组织,仔细分离耳蜗分别取基底膜、蜗轴、血管纹以及前庭组织。使用碧云天提取蛋白试剂盒提取组织蛋白:耳蜗组织置于1~2ml匀浆器中,用吹打枪头将组织块剪碎。加400 μ含PMSF的去污剂裂解液于匀浆器中进行匀浆,冰上静置10min,重复碾压使组织尽量碾碎,裂解半小时后移至1.5ml离心管中,4℃12000rpm离心5min,取上清分装并置于-20℃冰箱保存。BCA法行蛋白定量:BCA工作液=1:8,37℃30min,酶标仪570nm波长读取OD值。RIPA调整蛋白浓度,5×还原样品缓冲液调整样品的终浓度,煮沸变性5min。根据目的蛋白的分子量,配制分离胶,浓度分别为8%和12%,浓缩胶的浓度为5%,待检蛋白20ug/孔上样。电泳条件:浓缩胶恒压90V 20min;分离胶恒压160V。转膜:300mA恒流,0.45um孔径NC膜1.5h。封闭:3%BSA-TBST,室温轻摇30min。
1)一抗孵育:3%BSA-TBST稀释一抗室温10min,放4℃冰箱过夜。

编号1一抗名称ATP6V0A4稀释比例1:4000稀释后体积4ml
2)隔天从4℃冰箱取出,室温30min。TBST洗5次,各3min。
3)二抗孵育:山羊抗兔IgG(H+L)(5%脱脂奶粉-TBST稀释二抗),HRP 1:20000,室温40min,TBST洗膜6次,各3min。
4)ECL加到膜上,作用3-5min,胶片曝光10s-5min,显影2min,定影。
内参蛋白WB实验:TBST洗膜3次,每次3min。后浸没于5%脱脂奶粉-TBST中,室温下作用30min;GAPDH鼠单抗,用5%脱脂奶粉-TBST稀释抗体(1:20000),室温孵育40min;TBST洗膜5次,各3min;山羊抗小鼠IgG(H+L)(5%脱脂奶粉-TBST稀释)HRP,1:10000,室温下作用40min。TBST洗膜5次,各3min。将ECL加到膜上,反应3-5min,胶片曝光10s-5min,显影2min,定影。
2 结果
2.1 我们采用免疫荧光法检测了Atp6v0a4蛋白在小鼠内耳发育过程中在耳蜗的定位以及表达情况。结果见图1,通过对E18、P1、P7、P14及P21天昆明小鼠内耳切片行免疫荧光染色,可以看到在昆明小鼠耳蜗多个部位,即Corti’s器的内毛细胞、外毛细胞及螺旋神经节上,Atp6v0a4均有明显表达,在毛细胞上的荧光表达与毛细胞特异性染色抗体MYO7A的荧光重合,而在螺旋神经节上的免疫荧光表达则与螺旋神经节的特异性抗体Neurofila⁃ment的荧光表达位置重合。此外,该蛋白在血管纹、前庭的椭圆囊及球囊处可见表达。在不同发育阶段的小鼠中,Atp6v0a4的表达位置较为恒定。


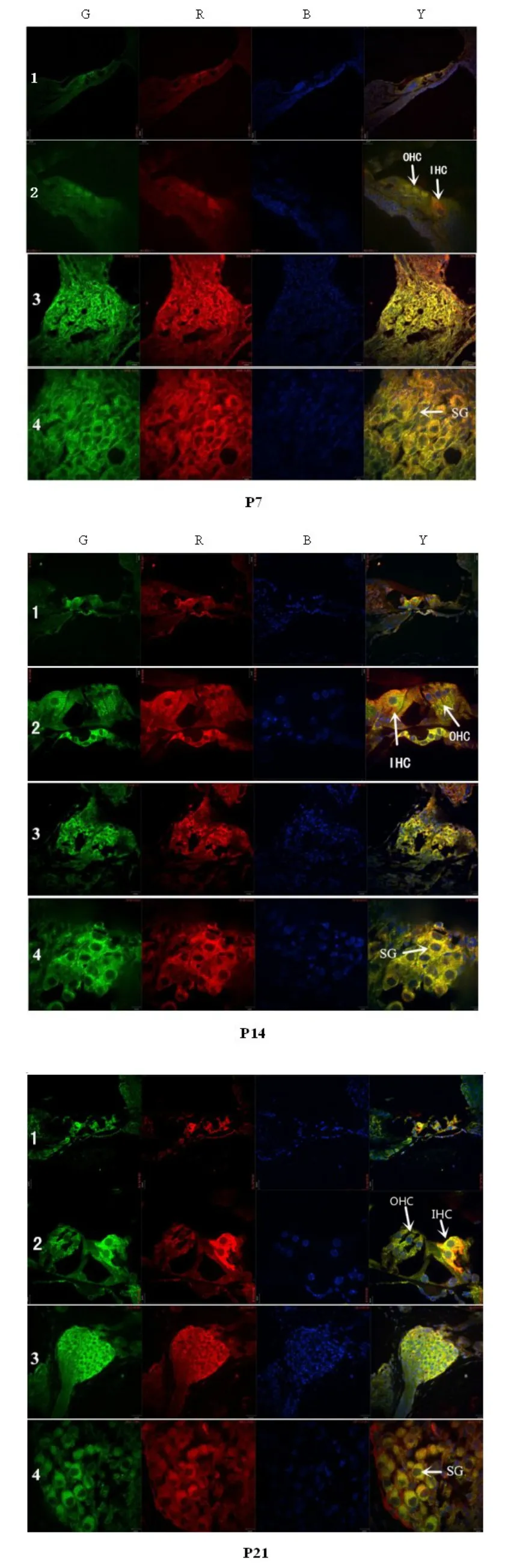
图1 免疫荧光染色,Atp6v0a4蛋白在小鼠内耳发育过程中的表达与定位(E18,P1,P7,P14,P21)。(1)Corti’s器(×20倍);(2)Corti’s器(×40倍);(3)螺旋神经节(×20倍);(4)螺旋神经节(×40倍);(G)ATP6V0A4(R)MYO7A(1-2),Neu⁃rofliament(3-4);(B)DAPI荧光染色-细胞核;(Y)整合图Fig.1 Immunofluorescence staining,The expression and location of Atp6v0a4 in developing mouse inner ear(E18,P1, P7,P14,P21).(1))Corti's organ(×20times);(2)Corti's organ(×40times);(3)spiral ganglion neuron(×20times);(4)spiral ganglion neuron(×40times);(G)ATP6V0A4(R)MYO7A(1-2),Neurofliament(3-4);(B)nuclear staining;(Y)synthetic map
2.2 通过辣根过氧化物酶染色结果见图2,Atp6v0a4在昆明小鼠耳蜗中的表达与上述免疫荧光法染色结果一致,即均表现为在小鼠耳蜗耳蜗Corti’s器的内外毛细胞、螺旋神经节、血管纹及前庭淋巴囊存在表达。

图2 免疫组化分析Atp6v0a4蛋白在小鼠耳蜗的表达与定位。耳蜗切片与ATP6V0A4一抗及相应二抗结合,10倍光学显微镜下观察。(上)耳蜗(×10倍);(左下)Corti’s器(×40倍);(右下)对照(×40倍)Fig.2 Immunohistochemical,he expression and location of Atp6v0a4 in developing mouse inner ear,Cochlear slices were reacted with the corresponding two antibodies of ATP6V0A4,Observation under optical microscope.(upper figure):cochlea(×10times); (bottom-left figure):Corti's organ(×40times);(bottom-right figure):contrast(×40times)
2.3我们通过提取不同发育阶段昆明小鼠的内耳前庭组织、耳蜗内血管纹、Corti’s器基底膜、螺旋神经节(取蜗轴)的蛋白进行Western-blot定性并半定量分析了Atp6v0a4的表达,实验结果见图3,实验成功检测到了特异性阳性条带,结果显示Atp6v0a4在内耳前庭组织、耳蜗内血管纹、Corti’s器基底膜、螺旋神经节均有表达,在昆明小鼠的不同发育时期,Corti’s器及螺旋神经节中表达相对稳定,P21小鼠前庭组织蛋白表达下降,P2小鼠血管纹蛋白表达相对较高,Atp6v0a4蛋白在血管纹及前庭组织在各个发育阶段可能存在差异表达。
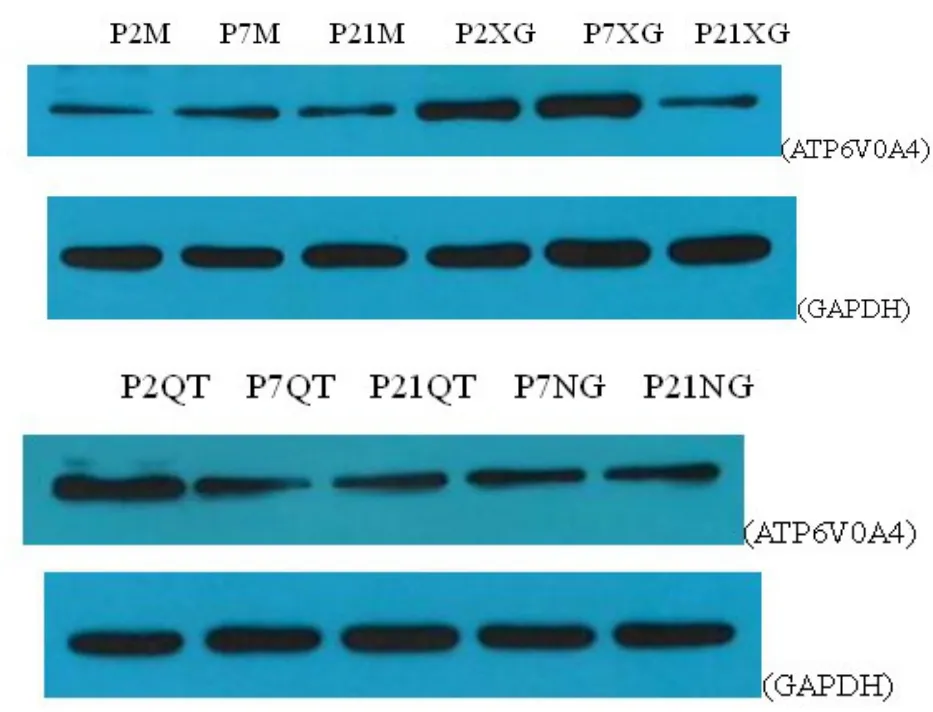
图3 western-blot:目标蛋白与内参蛋白Western-blot胶片扫描显影结果;(M)Corti’s器基底膜;(QT)前庭;(XG)血管纹;NG(螺旋神经节)Fig.3 Western-blot:The imaging results of The target protein and reference protein.(M)basement membrane of Corti’s;(QT)vestibula;(XG)vasculars;(NG)spiral ganglion neuron
3 讨论
遗传性远端肾小管性酸中毒合并SNHL是一种具有遗传异质性的罕见的耳、肾共同发病的常染色体隐性遗传综合征,ATP6V0A4编码V型质子泵的a4亚基,是目前已知的疾病相关基因,ATP6V0A4突变患者多表现为迟发性感音神经性耳聋[2]。目前对于ATP6V0A4在听觉系统中发挥作用的机制及其功能仍不明确。有学者认为其致病机理可能为V-H+-ATPase功能的破坏,从而导致耳蜗内淋巴的紊乱[3]。而内淋巴的pH在维持正常听力中发挥重要作用[4],它的维持有赖于H+ATPase以及Cl−–HCO3−交换,突变等因素引起它们功能的破坏,将会导致听力损失。为了进一步探究ATP6V0A4在听觉系统发生中的作用。我们对不同发育阶段的小鼠内耳进行了Atp6v0a4表达的研究,以明确Atp6v0a4在小鼠内耳耳蜗中的表达。
囊泡型质子泵V-ATPase是生物膜H+-ATPase一种类型,广泛分布于原核即真核生物中,它可通过水解ATP,从而逆浓度梯度转运H+[5]。分为两类,即位于胞质中水溶性的V1和疏水性的镶嵌于膜上的V0,本研究中A4为其A亚基的一个亚型。ATP6V0A4位于7q34,一共有24个外显子,由840个氨基酸组成,编码V-H+-ATPase的a4亚基。已证实,骨质疏松[6]和糖尿病[7]等许多疾病和V-ATPase的功能障碍相关。目前已知包括ATP6V1B1、ATP6V1B2、ATP6V0A4的突变可导致感音神经性耳聋[3,8,9]。
为了明确Atp6v0a4蛋白在小鼠内耳毛细胞及螺旋神经节发育过程中的表达,我们采用了毛细胞特异性抗体MYO7A及螺旋神经节特异性抗体Neurofilament双标。实验中目标蛋白Atp6v0a4先行反应,二抗清洗后再做MYO7A及Neurofilament的免疫组化。实验过程中,我们设置了阴性对照(所有一抗均用PBS稀释的5%羊血清替代)。此外我们采用传统的免疫组化法辅助验证免疫荧光的结果,显示Atp6v0a4在不同发育阶段小鼠内耳Cor⁃ti’s器、螺旋神经节稳定表达。此外在血管纹及前庭淋巴囊等亦有表达,说明Atp6v0a4可能参与维持内耳的正常功能和内耳环境的稳态,与听觉系统的形成有关。我们根据免疫荧光的亮度可以初步判断表达量,为进一步探究各个阶段蛋白表达的变化,我们还提取了P2、P7以及P21天的小鼠内耳的蜗轴、基底膜、血管纹和前庭,通过Western-blot来定量研究Atp6v0a4蛋白的表达情况,结果显示基底膜、蜗轴、血管纹以及前庭均有Atp6v0a4蛋白表达,在Cortis器及螺旋神经节中表达相对稳定,P21小鼠前庭组织蛋白表达下降,P2小鼠血管纹蛋白表达相对较高,血管纹及前庭组织在各个发育阶段可能存在差异表达。有研究显示Atp6v0a4纯合突变小鼠模型整个蜗管显著扩大,处于中阶的Cortis器异常膨胀,耳蜗和内淋巴管显著扩张[9],结合本研究结果,Atp6v0a4除了在前庭内淋巴囊有表达并发挥作用外,在耳蜗毛细胞、血管纹、及螺旋神经节等听觉传导通路上可能也发挥重要作用。
Stover等提取成人内耳组织,通过RT-PCR首次证实ATP6V0A4在人内耳组织中的表达[3]。Eliz⁃abeth等研究了Atp6v0a4基因敲除小鼠,通过β-半乳糖苷酶标记敲除的基因发现a4除了在预期的肾脏和内耳有表达外,在骨、鼻、眼以及皮肤等组织也有表达。Beatriz通过免疫化学方法提示了Atp6v0a4在前庭内淋巴囊上皮细胞内有表达[10],这和我们提取小鼠前庭组织的Western-blot结果以及免疫荧光结果相一致。耳蜗内血管纹不仅是高代谢组织,而且具有分泌和吸收内淋巴液电解质的功能,对耳蜗内电位的产生具有重要的作用。耳蜗毛细胞含有丰富的溶酶体,而V-H+-ATPase广泛存在于溶酶体膜表面,通过水解ATP将质子转运到溶酶体内,以维持其酸性环境,PH的变化可能会影响其他离子的通透平衡,近年大量研究发现,很多造成溶酶体失稳的因素可导致细胞凋亡[3,11]。有研究显示Atp6v0a4和耳聋相关基因Foxi1以及Pds有作用关系。Foxi1是和a4启动子序列相关的转录因子,调节a4在内耳的表达,但a4突变不影响Foxi1的表达,表明a4可能是Foxi1的下游靶点[2]。在Atp6v0a4-/-基因敲除小鼠模型的内淋巴囊均有Foxi1以及Pds的强表达,且Kcnj10 and Kcnq1(分别在血管纹中间细胞及边缘细胞表达),即参与耳蜗内电位形成的主要钾离子通道在Atp6v0a4-/-小鼠强表达,我们的研究和以上诸多研究均提示Atp6v0a4可能参与其他基因的协同调控,但是对于其突变引起的耳蜗内电位降低或消失发生的机制却依然不清楚。
为了研究ATP6V0A4在内耳的功能,有学者建立了Atp6v0a4-/-基因敲除小鼠模型,该模型表现出了与以上所述的dRTA患者V-H+-ATPase功能缺失相同的临床表现,但它们之间也有差异性表现,如该模型动物早期即出现严重的听力障碍,且比临床上绝大多数病人严重。该研究亦显示,a4早期表达的减弱可能会导致Atp6v0a4-/-基因敲除小鼠的内耳解剖及功能破坏[12]。而在纯合突变模型小鼠即Atp6v0a4-/-基因敲除小鼠的听觉系统的结构和功能的研究方面,听性脑干反应(ABR)阈值显著升高,提示严重的听力损害,而杂合子的阈值则是正常的。涂料填充内耳胚胎显示Atp6v0a4-/-小鼠耳蜗和内淋巴管显著扩张[10],这与临床上部分dRTA合并感音神经性聋的患者内耳影像学相一致。然而该动物模型早期即出现听觉系统功能障碍,这与多数患者临床表现却不相符,有待进一步探讨。
ATP6V1B1和ATP6V0A4均是传性远端肾小管合并感音神经性聋的疾病相关基因,相关病例报告显示,在检出率上,ATP6VIB1显著高于ATP6V0A4,两者存在听力表型差异[13]。ATP6V1B1突变致感音神经性耳聋多出现在早期(10岁以前),而ATP6V0A4多表现为迟发性感音神经性耳聋(10岁以后甚至成年),即ATP6VIB1基因突变患者多表现为早发性感音神经性耳聋,而后者大多数表现为听力正常[2]。有学者构建了一个Atp6v1b1-/-小鼠模型,并没有观察到自发性酸中毒[14],这与ATP6V0A4-/-小鼠模型完全不同,考虑可能为早期胚胎发生补偿机制,比如b2亚基对于b1亚基的补偿作用大于其他a亚基对a4亚基的作用,使得小鼠模型研究中相关临床表现不明显。未来可进一步研究内耳atp6v1b1的表达及a4亚基与b1亚基之间的相互作用。
我们的研究明确了Atp6v0a4编码的蛋白在昆明小鼠内耳中的表达定位,以及在小鼠内耳发育过程中的表达情况,为进一步探讨ATP6V0A4在听觉系统的功能研究奠定基础。
1 Karet FE,Finberg KE,Nelson RD et al.Mutations in the gene en⁃coding B1 subunit of H+-ATPase cause renal tubular acidosis with sensorineural deafness.Nat Genet 1999;21:84–90.
2 Vidarsson,H.,Westergren,R.,Heglind,M et al.The forkhead transcription factor Foxi1 is a master regulator of vacuolar H-ATPase proton pump subunits in the inner ear,kidney and epi⁃didymis.2009 PLoS ONE 4,e4471.
3 Stover EH,Borthwick KJ,Bavalia C et al.Novel ATP6V1B1 and ATP6V0A4 mutations in autosomal recessive distal renal tubular acidosis with new evidence for hearing loss.J Med Genet 2002; 39:796–803.
4 Lang F,Vallon V,Knipper M et al.Functional significance of channels and transporters expressed in the inner ear and kidney. Am JPhysiol Cell Physiol 2007;293:C1187–C1208.
5 Kawasaki·Nishi S,Nishi T,Forgac M.Proton translocation driv⁃en by ATP hydrolysis in V·ATPases.FEBS Lett,2003.545:76.85.
6 Yao G,Feng H,Cai Y et al.Characterization of vacuolar-ATPase and selective inhibition of vacuolar-H(+)-ATPase in osteoclasts. Biochem.Biophys.Res.Commun.2007,15;357(4):821-827.
7 Rojas JD,Sennoune SR,Martinez GM et al.Plasmalemmal vacuo⁃lar H+-ATPase is decreased in microvascular endothelial cells from a diabetic model.J.Cell.Physiol.2004,201(2):190-200.
8 Yuan Y,Zhang J,Chang Q et al..De novo mutation in ATP6V1B2 impairs lysosome acidification and causes dominant deafness-ony⁃chodystrophy syndrome.Cell Research,2014,24(6):1370–1373.
9 Rybak LP,Whitworth CA.Ototoxicity:therapeutic opportunities. Drug Discov Today 10:1313–1321,2005.
10 Beatriz Lorente-Canovas B,Ingham N,Norgett EE et al.Mice de⁃ficient in H+-ATPase a4 subunit have severe hearing impairment associated with enlarged endolymphatic compartments within the inner ear.Dis Model Mech.2013,6(2):434-42.
11 Vargas-Poussou,R.,Houillier,P.,Le Pottier,N.et al.Genetic in⁃vestigation of autosomal recessive distal renal tubular acidosis:ev⁃idence for early sensorineural hearing loss associated with muta⁃tions in the ATP6V0A4 gene.J.Am.Soc.Nephrol.2006,17, 1437-1443.
12 Norgett EE,Golder ZJ,Lorente-Cánovas B et al..Atp6v0a4 knock out mouse is a model of distal renal tubular acidosis with hearing loss,with additional extrarenal phenotype.Proc Natl Acad Sci U S A.2012 Aug21;109(34):13775-80.
13 Antunes F,Cadenas E,Brunk UT.Apoptosis induced by exposure⁃to a low steady-state concentration of H2O2 is a consequence of lysosomal rupture.Biochem J,2001,356(2):549-555.
14 Dou H,Finberg K,Cardell EL et al.Mice lacking the B1 subunit of H+-ATPase have normal hearing.Hear Res 2003,180:76–84.
The expression of a combined distal renal tubular acidosis(dRTA)-deafness related geneATP6V0A4 in developing inner ears of the mice
LIU Yaqing1,2,LI Qi1,XIN Feng2,YUAN Yongyi2
1.Department of Otolaryngology,Head&Neck Surgery,Children,s hospital affiliated to Nanjing medical University 2.Department of Otolaryngology,Head&Neck Surgery,Chinese PLA General Hospital Corresponding author:YUAN Yongyi Email:yyymzh@163.com
Objective Autosomal recessive distal renal tubular acidosis(dRTA),a severe disorder of acid–base homeostasis,is often accompanied by sensorineural deafness.The ATP6V0A4 is considered as the causative gene;however,it is unknown how this gene causes the diseases.This study aims to investigate the expression of ATP6V0A4 in the mice inner ear at different stages of development.Methods Kunming mice at different developmental stages(Embryo 18,Postnatal 1,Postnatal 7,Postnatal 14,Postnatal 21)were used.The expression of Atp6v0a4 in the mice inner ear was analyzed using combined techniques of immunohistochemistry and immunofluorescence under confocal laser scanning microscopy.In addition,western-blot was used to analyze the expression of Atp6v0a4 quantitatively and qualitatively in mice inner ear.Results Atp6v0a4 was steadily expressed in the inner and outer hair cells,stria vascularis,spiral ganglion,and endolymphatic sac during the inner ear development,as shown by confocal laser scanning microscopy. The western-blot showed that the expression of Atp6v0a4 is relatively stable in the organ of Corti,spiral ganglion,andstria vascularis,while the expression of Atp6v0a4 in vestibule decreased during inner ear development.Conclusions Expression and localization of Atp6v0a4 in the mice inner ear at different developmental stages are demonstrated.This study may pave the way for further investigation in theAtp6v0a4 related deafness mechanisms.
Atp6v0a4;Expression and localization;Inner ear
R764
A
1672-2922(2017)01-88-6
2016-09-28审核人:郭维维)
10.3969/j.issn.1672-2922.2017.01.018
国家自然科学基金面上项目(81371098);北京市自然科学基金面上项目(7132177);江苏省省级重点研发专项资金(BE2015608);江苏省科教兴卫重点医学人才(RC2011028);江苏省“333高层次人才培养工程”基金(2015);江苏省六大人才高峰(2015-wsw-063)联合资助
刘亚青,硕士,住院医师,研究方向:感音神经性耳聋
刘亚青和李琦为并列第一作者
袁永一,Email:yyymzh@163.com

